2. 湖南省人民医院, 湖南 长沙 410007
脓毒症是儿童重症病房的常见病,患儿可存在不同程度的微循环障碍,影响组织灌注导致器官功能障碍[1],当超过三个以上的器官被累及时,其死亡率为60%到98%[2-3]。乳酸是反映组织缺血缺氧的敏感产物,可间接反映器官功能障碍和休克的发生发展[4-5]。目前已有研究表明,入院时血乳酸水平与脓毒症患者不良预后呈正相关,提高乳酸清除率可改善脓毒症患者预后[6],并有研究指出入住ICU后第一个24 h内的乳酸清除率与脓毒症患者预后的相关性最佳,即使超出最初6 h的最佳治疗窗,治疗也应以乳酸清除率为指导[7]。但以上研究均只是定性地表明乳酸水平与脓毒症严重程度或者预后的关系。本研究拟进一步证实儿童血乳酸水平与脓毒症严重程度的关系,并找到能及早发现病情变化,判断脓毒症的严重程度及与预后的界值,为临床提供参考。
1 资料与方法 1.1 研究对象收集2011年6月至2013年6月入住湖南省儿童医院重症监护室的脓毒症患儿,脓毒症的诊断依据中华医学会儿科学分会急救学组、中华医学会急诊学分会儿科组和中国医师协会儿童重症医师分会制定的儿童脓毒性休克(感染性休克)诊治专家共识(2015版)[8]。将脓毒症患儿分为:普通脓毒症组、严重脓毒症组和脓毒症休克组;另外根据血乳酸水平将脓毒症患儿分为乳酸≤1 mmol/L组,乳酸~ 2 mmol/L组,乳酸~ 4 mmol/L组和乳酸>4 mmol/L组。
1.2 定义脓毒症:感染(可疑或已证实)的基础上导致的全身炎症反应综合征。
严重脓毒症:脓毒症诱导的两个或两个以上的器官功能障碍(不包含满足脓毒症休克诊断标准者)。
脓毒症休克:脓毒症诱导的组织低灌注和(或)心血管功能障碍。
高乳酸血症:血乳酸>1 mmol/L。
1.3 研究方法入组脓毒症患儿均在治疗前采集外周动脉血1 mL,采用GEM Premier 3500全自动血气分析仪测血乳酸浓度。治疗前乳酸>2 mmol/L的脓毒症休克患儿在早期复苏后(约在入院后6 h)再次复查血乳酸,各组治疗方法均予对症和原发病治疗。
1.4 统计学分析采用SPSS 18.0统计学软件进行分析。计量资料以均数±标准差(x±s)表示,计数资料以率(%)表示,组间比较采用方差分析或卡方检验。采用受试者工作特征ROC曲线评价乳酸对严重脓毒症、脓毒症休克的诊断价值及预后的预测价值。P<0.05为差异有统计学意义。
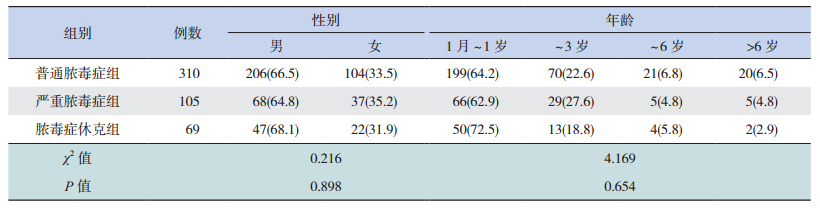
2 结果 2.1 一般资料本研究共纳入脓毒症患儿484例,其中男321例,女163例;普通脓毒症310例(64.0%),严重脓毒症105例(21.7%),脓毒症休克69例(14.3%);年龄1月~14岁,平均1.3±2.1岁。各组患儿性别和年龄比较差别无统计学意义,见表 1。
| 表 1 脓毒症患儿一般临床资料比较[n(%)] |
2.2 脓毒症患儿高乳酸血症的发生率
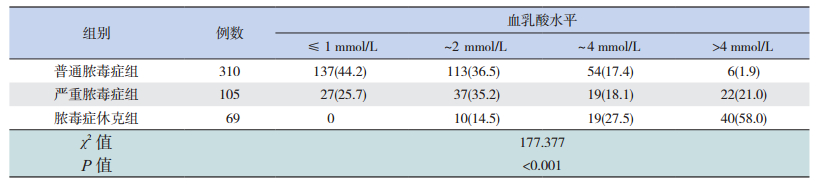
脓毒症患儿高乳酸血症的总发生率为66.1%(320/484),随着脓毒症严重程度的增加,高乳酸血症的发生率显著增高,脓毒症休克组高乳酸血症发生率为100%,明显高于严重脓毒症组(74.3%)和普通脓毒症组(55.8%)(χ2=177.377,P<0.01),见表 2。
| 表 2 脓毒症患儿高乳酸血症的的发生率[n(%)] |
2.3 脓毒症患儿血乳酸水平的比较
治疗前患儿血乳酸水平随脓毒症严重程度增加而逐渐增高,脓毒症休克组患儿的血乳酸水平(6.3±4.3 mmol/L)明显高于普通脓毒症组(1.5±1.0 mmol/L)和严重脓毒症组(2.8±2.9 mmol/L),而严重脓毒症组患儿血乳酸水平也明显高于普通脓毒症组,差异均有统计学意义(F=127.705,P<0.01)。
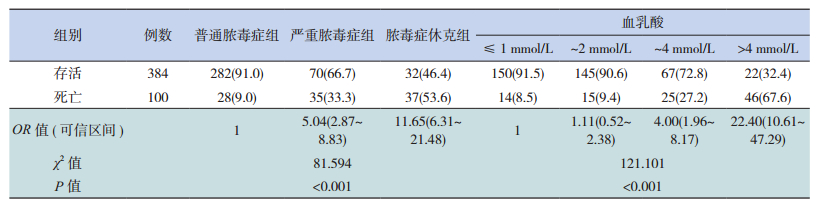
2.4 脓毒症患儿的预后分析脓毒症严重程度越重,其病死率越高,普通脓毒症组,严重脓毒症组和脓毒症休克组的病死率依次为9.0%(28/310),33.3%(35/105),53.6%(37/69),其中脓毒症休克组病死率明显高于普通脓毒症组和严重脓毒症组(χ2分别为78.977和7.067,均P<0.01),严重脓毒症组病死率明显高于普通脓毒症组(χ2=35.972,P<0.001);血乳酸值越高,其预后也越差,乳酸≤1 mmol/L、~2 mmol/L、~4 mmol/L和>4 mmol/L的病死率分别为8.5%(14/164)、9.4%(15/160)、27.2%(25/92)、67.6%(46/68),其中乳酸>4 mmol/L的死亡风险为乳酸≤1 mmol/L的22.4倍,差异有统计学意义(P<0.01),见表 3。
| 表 3 脓毒症患儿的预后分析[n(%)] |
2.5 治疗前乳酸>2 mmol/L的脓毒症休克患儿复苏后乳酸水平与预后的相关性分析
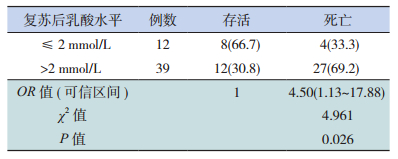
复苏前,69例脓毒症休克患儿中59例患儿的血乳酸水平>2 mmol/L,其中4例复测血乳酸前死亡,另有4例早期液体复苏后未复查血乳酸,故本部分研究共纳入51例。复苏后仍有39例患儿血乳酸水平>2 mmol/L,其中27例死亡,其死亡率(69.2%)明显高于复苏后乳酸≤2 mmol/L的患儿(33.3%),复苏后乳酸>2 mmol/L组的死亡风险为≤2 mmol/L组的4.5倍,见表 4。
| 表 4 乳酸>2 mmol/L的脓毒症休克患儿复苏后乳酸水平与预后分析[n(%)] |
2.6 血乳酸水平的ROC曲线分析
研究发现,区分脓毒症休克与无休克的血乳酸截止值取2.25 mmol/L时,曲线下面积(AreaUnder Curve,AUC)为0.891,灵敏度=82.6%,特异性=79.8%;当截止值取4.0 mol/L时,其AUC为0.891,灵敏度=58%,特异性=92.5%。区分严重脓毒症(含脓毒症休克)和普通脓毒症的血乳酸值截止值取2.25 mmol/L时,AUC为0.749,灵敏度=54.9%,特异性=85.2%;区分脓毒症死亡与存活的血乳酸值截止值取2.55 mmol/L时,AUC为0.781,灵敏度=65%,特异性=84.1%,见图 1。
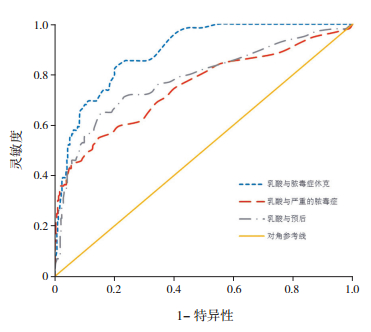
|
图 1 血乳酸的ROC曲线分析 |
3 讨论
脓毒症是感染的基础上发生的全身炎症反应综合症,其病死率为30%~70%[9],而严重脓毒症和脓毒症休克的发生是导致病死率增高的主要原因[10],本研究发现,随着脓毒症严重程度增加,患儿病死率逐渐增高。因此,找到早期评估脓毒症病情严重程度的简便、合适指标,对指导治疗脓毒症,阻止其病情恶化具有重要的临床意义。
乳酸为体内葡萄糖无氧代谢的一种产物,正常情况下产量较少,但在危重症状态下,患者体内不同程度的组织低灌注和氧合障碍的存在,可导致全身组织低氧状态,无氧代谢增加,继而乳酸量显著增多,严重者可发生乳酸性酸中毒[11]。脓毒症全身炎症反应的持续失控可导致机体微循环障碍,引起组织氧供不足,进一步发展可造成组织功能损伤。本研究发现随着脓毒症严重程度增加,患儿血乳酸水平和高乳酸血症比率也逐渐增高,差异均有统计学意义,说明乳酸水平与脓毒症病情严重程度呈正相关,提示血乳酸可作为脓毒症病情严重程度的评价指标。
研究发现高乳酸血症与脓毒症的预后显著相关[12-13]。Levy等[14]报道,成人严重脓毒症患者若同时合并低血压及乳酸>4 mmol/L,其病死率高达46.7%,相比仅低血压患者的病死率(36.7%)增高了10%,说明血乳酸>4 mmol/L是严重脓毒症患者不良预后的重要危险因素。对于儿童,因其各系统脏器发育的不完全,对体内稳态的要求更高于成人,故高乳酸血症可能会对儿童带来更为严重的打击。本研究发现,血乳酸>4 mmol/L的脓毒症患儿病死率远远高于乳酸正常的患儿,乳酸>4 mmol/L的脓毒症患儿死亡风险为乳酸≤1 mmol/L患儿的22.4倍。因此,不论成人还是儿童,血乳酸值均可作为预后的重要预测因素。
研究发现,乳酸≥4 mmol/L的全身炎症反应综合征患儿24 h内发生多器官功能障碍的概率是乳酸<4 mmol/L的5.5倍[15]。早期复苏降低血乳酸水平是脓毒症休克患儿的主要治疗目标之一[16]。本研究发现,复苏后血乳酸>2 mmol/L的患儿病死率明显高于乳酸≤2 mmol/L的患儿,复苏后乳酸>2 mmol/L的患儿死亡风险为乳酸≤2 mmol/L的4.5倍,提示乳酸增高的脓毒症休克患儿应尽早干预使其乳酸值降至正常水平,即提高早期乳酸清除率,对于脓毒症休克患儿的预后具有重要意义。此外,ROC曲线分析发现,为区分脓毒症休克和非脓毒症休克,取血乳酸值2.25 mmol/L时AUC曲线下面积为0.891,诊断灵敏度为82.6%,特异性为79.8%。
综上,本研究发现血乳酸值可以作为脓毒症病情严重程度和预后判断的评价指标,当脓毒症患儿血乳酸>2.25 mmol/L时需高度警惕脓毒症休克的发生,并尽早复苏使血乳酸值恢复至正常水平可改善脓毒症休克患儿的预后。
| [1] | 张永利, 李素玮. 脓毒症微循环障碍机制的研究进展[J]. 中华医学杂志,2015,95 (43) :3554–3556. |
| [2] | Krau SD. Making sense of multiple organ dysfunction syndrome[J]. Crit Care Nurs Clin North Am,2007, 19 (1) :87–97 . |
| [3] | Chen YC, Jenq CC, Tian YC, et al. Rifle classification for predicting in-hospital mortality in critically ill sepsis patients[J]. Shock,2009, 31 (2) :139–145 . |
| [4] | Singer AJ, Taylor M, Domingo A, et al. Diagnostic Characteristics of a Clinical Screening Tool in Combination With Measuring Bedside Lactate Level in Emergency Department Patients With Suspected Sepsis[J]. Academic Emergency Medicine,2014, 21 (8) :853–857 . |
| [5] | 刘潇, 祝益民, 胥志跃. 重症监护室中脓毒症患儿血乳酸水平与动脉血氧分压相关性分析[J]. 现代医学,2011 (02) :200–202. |
| [6] | 吕晓春, 许强宏, 蔡国龙, 等. ScVO2联合乳酸清除率指导脓毒症休克患者的容量复苏[J]. 中华医学杂志,2015,95 (07) :496–500. |
| [7] | 田慧艳, 于斌, 胡振杰, 等. 早期乳酸动态监测指标对严重脓毒症及脓毒症休克患者预后的评价[J]. 河北医药,2015 (10) :1449–1453. |
| [8] | 中华医学会儿科学分会急救学组, 中华医学会急诊医学分会儿科学组, 中国医师协会儿童重症医师分会. 儿童脓毒性休克(感染性休克)诊治专家共识(2015版)[J]. 中华实用儿科临床杂志,2015,30 (22) :1687–1691. |
| [9] | Barochia AV, Cui X, Eichacker PQ. The Surviving Sepsis Campaign's Revised Sepsis Bundles[J]. Curr Infect Dis Rep,2013, 15 (5) :385–393 . |
| [10] | Paulsen J, Mehl A, Askim A, et al. Epidemiology and outcome of Staphylococcus aureus bloodstream infection and sepsis in a Norwegian county 1996-2011: an observational study[J]. BMC Infect Dis,2015, 15 :116. |
| [11] | 黄可强. 血乳酸水平动态监测在ICU患者中的应用价值[J]. 医学综述,2015 (13) :2459–2460. |
| [12] | 谈定玉, 夏仲芳, 郑爱东, 等. 急诊脓毒症死亡风险评分联合血乳酸对急诊严重脓毒症患者危险分层的价值研究[J]. 中华危重病急救医学,2014,26 (3) :159–164. |
| [13] | Bai Z, Zhu X, Li M, et al. Effectiveness of predicting in-hospital mortality in critically ill children by assessing blood lactate levels at admission[J]. BMC Pediatr,2014, 14 :83. |
| [14] | Levy MM, Dellinger RP, Townsend SR, et al. The Surviving Sepsis Campaign: results of an international guideline-based performance improvement program targeting severe sepsis[J]. Intensive Care Med,2010, 36 (2) :222–231 . |
| [15] | Scott HF, Donoghue AJ, Gaieski DF, et al. The utility of early lactate testing in undifferentiated pediatric systemic inflammatory response syndrome[J]. Acad Emerg Med,2012, 19 (11) :1276–1280 . |
| [16] | Dellinger RP, Levy MM, Rhodes A, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012[J]. Intensive Care Med,2013, 39 (2) :165–228 . |
 2016, Vol. 18
2016, Vol. 18