川崎病(Kawasaki disease,KD)是一种主要发生于5岁以下儿童的急性炎症性血管炎,发病率在东亚人群正逐步增高,未及时治疗可导致严重的心血管并发症,已成为儿童获得性心脏病最主要的病因[1]。越来越多的研究表明,免疫系统激活后形成的炎症瀑布反应在KD发病中有着重要的作用[2-3]。髓样细胞触发受体-1(triggering receptorexpressed on myeloid cells-1,TREM-1)是一种与炎症相关的激发受体,配体尚未明确,当与衔接蛋白DNAX-活化蛋白12(DNAX-activating proteinl2,DAP12)结合后,能诱导机体生成多种炎症趋化因子和细胞因子,在多种炎症性疾病的发病中发挥重要作用[4]。sTREM-1(soluble triggeringreceptor expressed on myeloid cells-1)是其可溶性形式,为基质金属蛋白酶作用下膜型TREM-1裂解后的产物,与感染的严重程度密切相关。关于该受体激活后形成的信号通路在川崎病中的作用及机理目前国内外尚无报道。本文通过观察KD急性期TREM-1、DAP12及下游信号通路的单核细胞趋化因子-1(monocyte chemoattractant protein-1,MCP-1)、白细胞介素-8(interleukin-8,IL-8)表达水平,探讨TREM-1激活在川崎病发病及冠状动脉损伤中的作用。
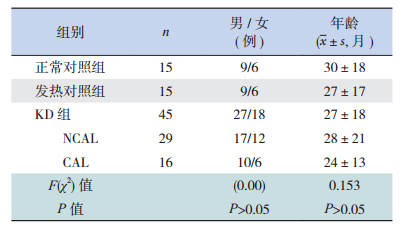
1 资料与方法 1.1 研究对象选择2014年6月至2015年10月期间南通大学附属医院住院的45例KD患儿为研究对象。诊断按照第7次世界小儿KD研讨会修订标准进行[5]。其中男27例、女18例,年龄3个月至6岁9个月。根据心脏超声检查,将KD患儿分为有冠状动脉损害(coronary artery lesions,CAL)组16例和无冠状动脉损害(non coronary artery lesions,NCAL)组29例。CAL的判断标准[6]为:冠状动脉内膜回声增强;冠状动脉内径超过邻近节段内径的1.5倍;冠状动脉内径/主动脉瓣环内径比值>0.2。
随机选择同期因呼吸道疾病(包括上呼吸道感染、支气管炎、轻症肺炎)住院的15例发热(体温≥ 38.5℃)患儿作为发热对照组,15例门诊常规体检的健康儿童作为正常对照组。KD组与两对照组在性别、年龄构成比方面差异均无统计学意义(P>0.05),见表 1。
| 表 1 3组患儿一般资料比较 |
1.2 标本采集
急性期KD患儿在IVIG治疗前,发热对照组在入院时,正常对照组在门诊体检时分别收集两份静脉血,1份为非抗凝血(干燥管取血),2 000转/min,离心20 min后收集血清,保存于-80℃冰箱待测;另1份为含EDTA抗凝血,用淋巴细胞分离液离心后分离外周血单个核细胞,加1 mL Trizol(美国Invitrogen公司)裂解细胞后于-80℃保存待提取RNA。
1.3 ELISA检测血清sTREM-1、DAP12、MCP-1、IL-8蛋白水平采用酶联免疫吸附法(enzyme-linkedimmunosorbent assay,ELISA)检测血清sTREM-1、DAP12、MCP-1、IL-8蛋白水平,试剂盒购自美国R&D公司,操作按照说明书进行。
1.4 荧光定量PCR检测TREM-1 mRNA、DAP12mRNA表达水平在NCBI查找TREM-1 mRNA、DAP12 mRNA序列,由上海生工设计并合成Real-time PCR引物。TREM-1 mRNA上游引物为5'-GTGTGTGATCTACCAGCCT-3',下游引物为5'-TTCAGAGTCAGGAGTGGAG-3'(232 bp);DAP12 mRNA上游引物为5'-GAGACCGAGTCGCCTTATCA-3',下游引物为5'-GTCATGATTCGGGCTCATTT-3'(101 bp)。经Trizol裂解的外周血单个核细胞依次经过氯仿、异丙醇等提取总RNA,按RevertAidTM FirstStrand cDNA Synthesis Kit(Thermo Scientific)说明配制mRNA逆转录体系,逆转录合成cDNA。取1 μL cDNA行PCR,反应体系20 μL:Fast SYBRGreen Master Mix(Roche)10 μL,上下游引物各1 μL,ddH2O 7 μL,cDNA模板1 μL。反应条件为:95℃预变性5 min,共45个循环(95℃ 15 s,57℃ 1 min,72℃ 1 min),每个循环在72℃延伸阶段收集荧光。
1.5 统计学分析应用SPSS 19.0统计软件处理。结果以均数±标准差(x±s)表示,两组间比较采用t或t’检验,多组间比较采用单因数方差分析,多组间两两比较采用SNK-q检验;相关分析采用直线相关分析。P<0.05为差异有统计学意义。
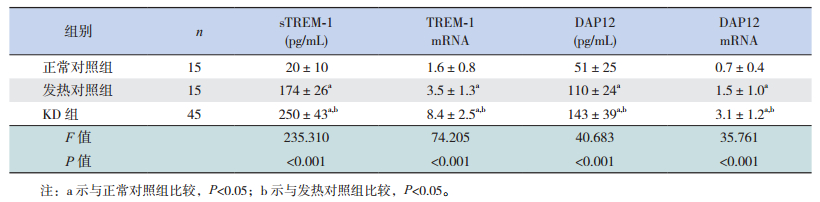
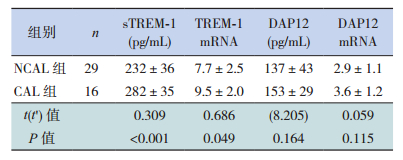
2 结果 2.1 血清sTREM-1、DAP12蛋白及TREM-1mRNA、DAP12 mRNA表达水平KD患儿血清sTREM-1、DAP12蛋白及外周血单个核细胞中TREM-1 mRNA、DAP12 mRNA表达水平明显高于两对照组(P<0.05),且CAL亚组sTREM-1蛋白及TREM-1 mRNA表达水平较NCAL亚组高(P<0.05);发热对照组的血清sTREM-1、DAP12蛋白及外周血单个核细胞中TREM-1 mRNA、DAP12 mRNA表达水平明显高于正常对照组(P<0.05)。见表 2~3。
| 表 2 3组患儿的sTREM-1、DAP12蛋白及TREM-1 mRNA、DAP12 mRNA的相对表达水平(x±s) |
| 表 3 两组KD患儿的sTREM-1、DAP12蛋白及TREM-1 mRNA、DAP12 mRNA相对表达水平(x±s) |
2.2 下游信号分子血清蛋白表达水平
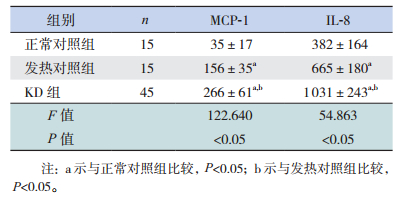
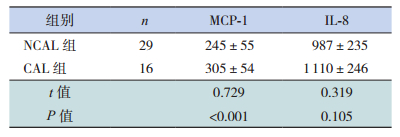
KD患儿血清MCP-1、IL-8蛋白明显高于两个对照组(P<0.05),且CAL亚组MCP-1蛋白较NCAL组高(P<0.05);发热对照组血清MCP-1、IL-8蛋白明显高于正常对照组(P<0.05)。见表 4~5。
| 表 4 3组患儿的MCP-1、IL-8蛋白浓度比较(x±s, pg/mL) |
| 表 5 两组KD患儿血清MCP-1及IL-8蛋白浓度比较(x±s, pg/mL) |
2.3 sTREM-1、MCP-1及IL-8之间的相关性分析
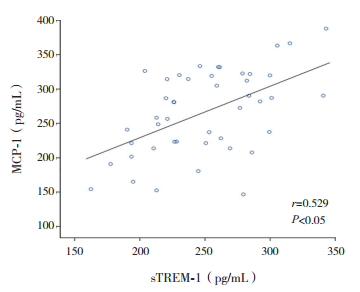
KD患儿血清sTREM-1与MCP-1水平呈正相关(r=0.529、P<0.05),见图 1;血清sTREM-1与IL-8水平无显著相关性(r=0.282,P>0.05);MCP-1与IL-8水平无显著相关性(r=0.23,P>0.05)。
|
图 1 KD患儿sTREM-1与MCP-1的相关性分析 |
3 讨论
TREM-1属于免疫球蛋白超家族的成员,高表达于单核/巨噬细胞及中性粒细胞的表面,是与炎症反应密切相关的跨膜受体,在机体受细菌和病原微生物侵袭时,其表达明显上调[7]。TREM-1是一种能识别病原相关分子模式(pathogen-associatedmolecular patterns,PAMPs)的受体,当PAMPs分泌时,可介导机体对组织降解及微生物感染作出反应,最终放大免疫反应并促进细胞因子的产生[8-10]。研究表明,TREM-1的胞内部分很短,缺乏内在的信号基序,具体配体尚未明确,当与衔接蛋白DAP12交联后,可使DAP12胞浆区免疫受体酪氨酸激活基序中的酪氨酸激酶发生磷酸化,促使钙离子内流,活化核转录因子-κB、激活子蛋白-1及ETS样蛋白1等,从而活化下游信号通路,导致多种炎症趋化因子和细胞因子如MCP-1、IL-6、IL-8、肿瘤坏死因子-α和活性氧大量释放,使中性粒细胞快速脱颗粒并发生吞噬作用[11-13]。这些释放的炎性物质可损伤血管,同时又能反过来再次作用于机体,介导机体产生更多的细胞因子和炎性介质,使炎症扩大甚至失去控制,并介导内皮损伤,可能在KD血管炎及冠脉损害中发挥重要作用。
TREM-1从细胞膜表面裂解后形成可溶性形式sTREM-1,在机体感染过程中,细胞表面TREM-1受体逐渐增多,从细胞表面脱落释放入体液中的sTREM-1也增多,故sTREM-1的表达在一定程度上可反映炎症的严重程度,其变化趋势被报道与急性胰腺炎、牙周炎等多种炎症性疾病的转归有密切关系[14-15]。本研究通过ELISA检测发现,川崎病患儿急性期血清sTREM-1、DAP12蛋白浓度较正常对照组及发热对照组明显增高,表明TREM-1活化参与了川崎病急性期血管炎的形成,且CAL组血清sTREM-1水平高于NCAL组,推测TREM-1异常活化可能参与了KD冠状动脉损害的形成,检测血清sTREM-1水平对川崎病早期诊断及冠状动脉损害的预测可能有重要作用。本研究进一步用荧光定量PCR法检测单个核细胞中TREM-1、DAP12的表达量,发现川崎病患儿TREM-1 mRNA、DAP12 mRNA表达较两对照组明显升高,且CAL组TREM-1 mRNA高于NCAL组,表明TREM-1基因表达水平的改变可能参与了KD的发生发展过程,这与蛋白表达水平结果一致,进一步表明TREM-1活化在KD血管炎形成及进一步发展成冠状动脉损害过程中可能有重要的作用。
为进一步研究TREM-1激活后如何启动KD血管炎症反应,本研究用ELISA检测下游MCP-1、IL-8蛋白的表达,发现MCP-1、IL-8在KD组表达明显增高。MCP-1属于一种趋化因子,可介导单个核细胞向血管壁迁移并进入动脉壁,从而可能在KD的血管损伤中发挥重要作用,本研究还发现CAL组血清MCP-1水平高于NCAL组,提示MCP-1与CAL的发生可能也有一定的相关性,这与国内外一些研究一致[16]。血清MCP-1水平可能是诊断KD及预测CAL发生的一项重要依据。IL-8也是一种细胞趋化因子,在机体受到外源病原体感染时能趋化及激活多种细胞,从而在KD血管炎症的发病过程中具有重要的作用。本研究发现,IL-8蛋白浓度在KD两亚组间并没有显著的区别,IL-8不能早期预测CAL的发生。对于这一结果,我们分析可能是有其它机制参与并抑制了IL-8的进一步分泌。另外,本研究对KD急性期血清sTREM-1、MCP-1及IL-8之间的相关性进行分析,发现仅sTREM-1与MCP-1存在中等程度的正相关关系,这表明sTREM-1与MCP-1在KD血管炎形成及冠状动脉损害的发病机理中可能发挥了一定的协同作用。由于本研究病例较少,进一步积累更多的病例可能会有进一步发现。
由于KD患儿在早期症状不典型时常常被误诊为呼吸道感染,本研究为了进一步探究TREM-1信号通路在KD早期诊断中的价值,将呼吸道感染所致发热设为发热对照组。研究显示,KD急性期及发热对照组的TREM-1信号通路的表达高于正常对照,表明TREM-1信号通路表达增高并非是KD特异性表现,但KD组高于发热对照组,表明TREM-1信号通路在KD早期诊断中可能有重要的作用。
本文首次从基因转录及蛋白表达水平证实KD急性期TREM-1、DAP12的表达及下游相关炎性因子MCP-1、IL-8蛋白水平明显增高,表明TREM-1异常活化可能导致前炎细胞因子及趋化因子过度产生,而TREM-1/DAP12信号通路中炎性因子的过度表达可能是导致KD血管炎发生及冠状动脉损害的原因之一。另外,检测血清TREM-1/DAP12信号通路中细胞因子的表达可望作为KD早期诊断的指标,且血清sTREM-1、MCP-1蛋白水平在预测KD是否合并冠状动脉损害中可能也有重要价值。
| [1] | Dimitriades VR, Brown AG, Gedalia A. Kawasaki disease: pathophysiology, clinical manifestations, and management[J]. Curr Rheumatol Rep,2014, 16 (6) :423. |
| [2] | Yeung RS. Kawasaki disease: update on pathogenesis[J]. Curr Opin Rheumatol,2010, 22 (5) :551–560 . |
| [3] | Gerding R. Kawasaki disease: a review[J]. J Pediatr Health Care,2011, 25 (6) :379–387 . |
| [4] | Tessarz AS, Cerwenka A. The TREM-1/DAP12 pathway[J]. Immunol lett,2008, 116 (2) :111–116 . |
| [5] | Japaness Circulation Society Joint Research Group. Guidelines for diagnosis and management of cardiovascular sequelae in Kawasaki disease[J]. Pediatr Int,2005, 47 (6) :711–732 . |
| [6] | Belay ED, Maddox RA, Holman RC, et al. Kawasaki syndrome and risk factors for coronary artery abnormalities: United States, 1994-2003[J]. Pediatr Infect Dis J,2006, 25 (3) :245–249 . |
| [7] | Bouchon A, Dietrich J, Colonna M. Cutting edge: inflammatory responses can be triggered by TREM-1, a novel receptor expressed on neutrophils and monocytes[J]. J Immunol,2000, 164 (10) :4991–4995 . |
| [8] | Ornatowska M, Azim AC, Wang X, et al. Functional genomics of silencing TREM-1 on TLR4 signaling in macrophages[J]. Am J Physiol Lung Cell Mol Physiol,2007, 293 (6) :L1377–1384 . |
| [9] | Schenk M, Bouchon A, Seibold F, et al. TREM-1–expressing intestinal macrophages crucially amplify chronic inflflammation in experimental colitis and inflflammatory bowel diseases[J]. J Clin Invest,2007, 117 (10) :3097–3106 . |
| [10] | Kuai J, Gregory B, Hill A, et al. TREM-1 expression is increased in the synovium of rheumatoid arthritis patients and induces the expression of pro-inflflammatory cytokines[J]. Rheumatology (Oxford),2009, 48 (11) :1352–1358 . |
| [11] | Klesney-Tait J, Turnbull IR, Colonna M. The TREM receptor family and signal integration[J]. Nat Immunol,2006, 7 (12) :1266–1273 . |
| [12] | Fortin CF, Lesur O, Fulop T Jr. Effects of TREM-1 activation in human neutrophils: activation of signaling pathways, recruitment into lipid rafts and association with TLR4[J]. Int Immunol,2007, 19 (1) :41–50 . |
| [13] | Radsak MP, Salih HR, Rammensee HG, et al. Triggering receptor expressed on myeloid cells-1 in neutrophil inflam-matory responses: differential regulation of activation and survival[J]. J Immunol,2004, 172 (8) :4956–4963 . |
| [14] | Yasuda T, Takeyama Y, Ueda T, et al. Increased levels of soluble triggering receptor expressed on myeloid cells-1 in patients with acute pancreatitis[J]. Crit Care Med,2008, 36 (7) :2048–2053 . |
| [15] | Bisson C, Massin F, Lefevre PA, et al. Increased gingival crevicular fluid levels of soluble triggering receptor expressed on myeloid cells (sTREM)-1 in severe periodontitis[J]. J Clin Periodontol,2012, 39 (12) :1141–1148 . |
| [16] | Hamada H, Suzuki H, Abe J, et al. Inflammatory cytokine profiles during Cyclosporin treatment for immunoglobulin-resistant Kawasaki disease[J]. Cytokine,2012, 60 (3) :681–685 . |
 2016, Vol. 18
2016, Vol. 18