2. 澳门大学中华医药研究院, 澳门 氹仔 000853 ;
3. 广东医学院药学院, 广东 湛江 524023
静脉注射免疫球蛋白(IVIG)联合口服阿司匹林是川崎病(Kawasaki disease,KD)初始治疗的标准方案[1]。糖皮质激素(GCs)作为一类甾体激素,在临床上对血管炎性疾病和类风湿性疾病均有很好的疗效,但1979年Kato等[2]的研究以及1983年Kuaskawa[3]的研究显示,KD患儿应用GCs可能产生冠状动脉损害(coronary artery lesion,CAL),甚至形成冠状动脉瘤(coronary artery aneurysm,CAA)。2012年加拿大的一项回顾性报告也显示,KD患儿急性期使用GCs联合IVIG治疗可引起冠状动脉病变恶化[4],而同年日本的一项全国性研究却提示泼尼松龙联合IVIG作为初始治疗可减轻高危KD患儿CAL[5]。Okada等[6]研究表明GCs联合IVIG初始治疗KD可缩短患儿发热时间,降低C反应蛋白和细胞因子水平,减少治疗失败率。2005年Wooditch等[7]一项Meta分析显示GCs初始治疗KD可显著降低CAA的发生率,但纳入文献时间跨度大,KD治疗方案、文献间的CAA的评估方法存在差异性。GCs治疗KD虽始于上世纪70年代末,但至今仍存在明显分歧,特别是GCs在KD患儿初始治疗中的有效性及安全性问题。因此本研究通过制定严格的纳入和排除标准,对有关GCs联合IVIG在KD患儿初始治疗中的对照研究进行荟萃分析。
1 资料与方法 1.1 文献纳入标准(1)研究类型:前瞻性对照研究或回顾性对照研究。
(2)研究对象:符合明确的KD诊断标准(日本川崎病研究委员会[8]或美国心脏病学会的诊断标准[9]),年龄≤14岁,性别不限。
(3)干预措施:试验组采用GCs联合IVIG初始治疗,对照组单用IVIG初始治疗。其他干预措施在两组间一致。
(4)结局指标:主要指标包括CAL发生率;次要指标包括发热持续时间、不良反应事件发生率、首次治疗未反应率、复发率。
1.2 文献排除标准(1)存在研究设计缺陷;(2)数据不完整、结局效应不明确;(3)统计学分析方法错误,无法修正;(4)计量资料无法提供均数和标准差,没有准确的数据显示;(5)重复发表的系统评价。
1.3 文献检索策略计算机检索MEDLINE数据库、PubMed数据库、CNKI、万方数据库、维普电子期刊全文数据库等,收集GCs初始治疗KD的前瞻性对照研究或回顾性对照研究。检索时间为各数据库建库至2016年3月。中文检索词:川崎病、皮肤黏膜淋巴结综合征、激素、糖皮质激素、肾上腺皮质激素、强的松、甲基强的松龙、氢化可的松或地塞米松。英文检索词:Kawasaki disease,hormone,glucocorticoids,steroids,prednisone,methylprednisolone,hydrocortisone ordexamethasone。
1.4 文献筛选及资料提取由2位评价者按照统一的表格独立提取患者的一般资料、干预措施、疗效判定指标、试验结果等资料,并进行交叉核对。出现分歧时通过讨论,必要时由第3位研究人员协助解决。文献筛选时首先阅读文题和摘要,在排除明显不相关的文献后进一步阅读全文,以确定最终是否纳入。资料提取内容主要包括:(1)纳入研究的基本信息,包括作者、发表时间;(2)研究对象的基线情况和干预措施的具体细节;(3)质量评价的标准;(4)结局指标和结果测量数据。
1.5 纳入研究的质量评价标准文献质量评价根据研究类型的不同而采用各自相应的评价标准,入选的前瞻性研究参考改良Jadad量表[10]进行质量评价,总分为7分,1~3分为低质量,4~7分为高质量;主要评价指标包括随机分配、随机化隐藏、盲法、撤出与退出。回顾性研究质量评价标准参考Newcastle-Ottawa量表(NOS)[11],通过研究人群选择、组间可比性、暴露因素测量三大块对文献质量进行评价,总分9分。
1.6 统计学分析采用RevMan 5.2软件进行Meta分析,以森林图显示合并效应量的检验结果,以Z值和P值判断多项研究的合并效应统计量是否具有统计学意义,取P<0.05为差异有统计学意义,并按照异质性检验的结果来选择效应模型,如P≤0.10,I2>50%为研究间有统计学异质性,则需采用随机效应模型,并进行敏感性分析处理,如检验结果为P>0.10,I2≤50%为研究间无统计学异质性,则采用固定效应模型。
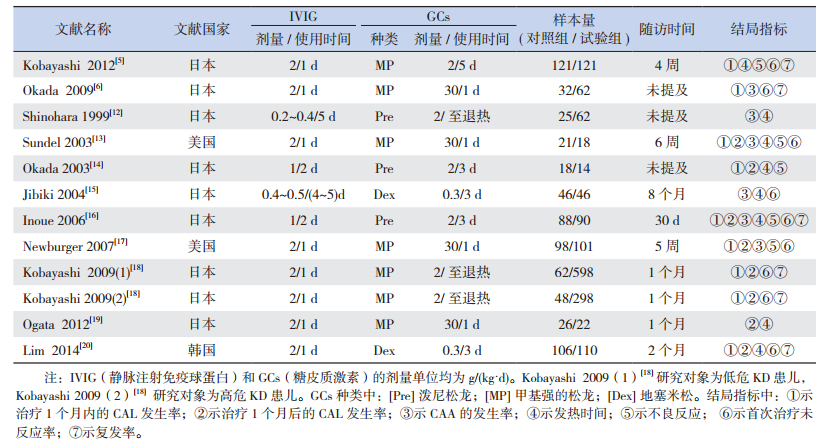
2 结果 2.1 文献检索结果根据设定的检索策略进行文献检索,最初检索到文献126篇,进一步检索、筛选文献,最终有11篇英文文献(表 1)纳入Meta分析,包括7项前瞻性研究[5, 13-17, 19]和4项回顾性研究[6, 12, 18, 20]。
| 表 1 纳入文献的基本特征 |
2.2 纳入研究的基本特征
纳入的11项研究中,3项研究[5-6, 19]的入选研究对象为高危KD患儿,高危的定义为血清C反应蛋白≥70 mg/L,总胆红素≥15.4 μmol/L或谷草转氨酶≥200 U/L。Kobayashi等[18]的研究采用危险评分标准将研究对象分为低危和高危两个亚组,分别评估各个结局指标。纳入研究的基本特征见表 1。
2.3 文献质量评价与发表偏倚入选的7篇前瞻性研究文献采用改良Jadad量表[10]进行方法学质量评定,其中高质量文献5篇:2篇[5, 19]6分,1篇[17]5分,2篇[14, 16]4分。低质量文献2篇(1篇3分[13],1篇[15]1分)。其中5篇文献随机分配方法恰当,4篇文献应用了合理的分配隐藏方案,但仅有2篇文献采用了盲法,2篇文献详细描述了撤出与退出情况。4篇回顾性研究文献中,参照NOS量表[11]得分7分的有1篇[6],6分的有2篇[12, 20],3分的有1篇[18]。
对11篇文献进行发表偏倚检验,各研究效应的散点图围绕中心线排列基本对称,主要结局指标Egger's检验结果:Bias一行中P>∣t∣指标为0.271、0.384、0.333,各检验结果均大于0.1,提示不存在明显的发表偏倚。
2.4 Meta分析结果 2.4.1 CAL发生率(l)以治疗1个月内CAL发生率为观察指标,纳入7项研究(1972例患儿),结果显示GCs联合IVIG组CAL发生率低于单用IVIG组,差异有统计学意义(OR=0.44,95%CI:0.23~0.86,P=0.02)。亚组分析:4项前瞻性研究结果显示,GCs联合IVIG组CAL发生率低于单用IVIG组,但差异无统计学意义(OR=0.45,95%CI:0.11~1.77,P=0.25);3项回顾性研究结果显示,GCs联合IVIG组CAL发生率低于单用IVIG组,差异有统计学意义(OR=0.44,95%CI:0.25~0.77,P=0.004)。见图 1。
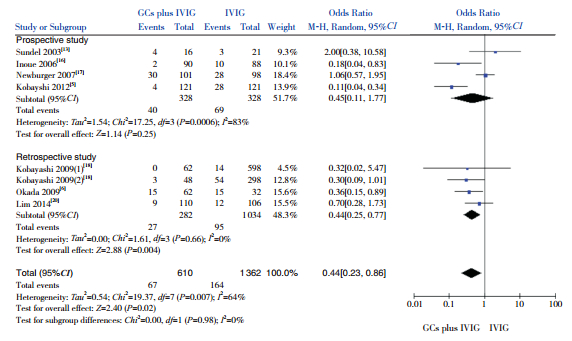
|
图 1 两组1个月内CAL发生率比较的Meta分析 |
(2)以治疗1个月后的CAL发生率为观察指标,纳入6项研究(1 664例患儿),结果显示,GCs联合IVIG组CAL发生率低于单用IVIG组,差异有统计学意义(OR=0.44,95%CI:0.25~0.77,P=0.004)。亚组分析:4项前瞻性研究结果显示,GCs联合IVIG组CAL发生率低于单用IVIG组,差异有统计学意义(OR=0.43,95%CI:0.23~0.81,P=0.009);2项回顾性研究结果显示,GCs联合IVIG组CAL发生率低于单用IVIG组,但差异无统计学意义(OR=0.47,95%CI:0.15~1.47,P=0.19)。见图 2。
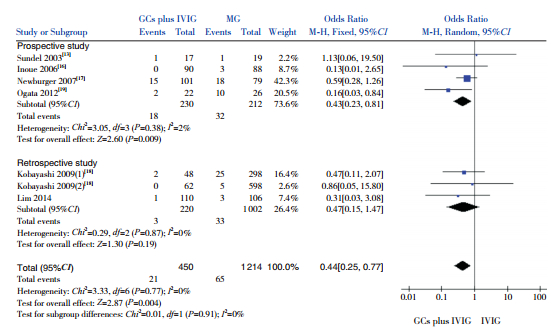
|
图 2 两组1个月后CAL发生率比较的Meta分析 |
(3)以治疗后CAA的发生率为观察指标,纳入6项研究(1 150例患儿),结果显示GCs联合IVIG组CAA的发生率低于单用IVIG组,差异有统计学意义(OR=0.24,95%CI:0.10~0.57,P=0.001)。亚组分析:4项前瞻性研究结果显示,两组CAA发生率相似,差异无统计学意义(OR=0.81,95%CI:0.23~2.91,P=0.75);2项回顾性研究结果显示,GCs联合IVIG组CAA发生率低于单用IVIG组,差异有统计学意义(OR=0.08,95%CI:0.02~0.29,P=0.0001)。见图 3。
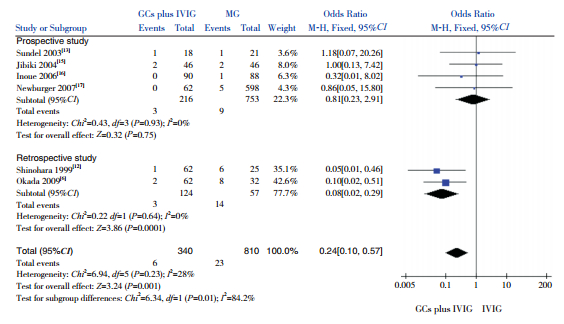
|
图 3 两组CAA发生率比较的Meta分析 |
2.4.2 发热持续时间
以治疗后两组发热持续时间为观察指标,纳入8项研究(934例患儿),结果显示GCs联合IVIG组发热持续时间短于单用IVIG组,差异有统计学意义(MD=-1.66,95%CI:-2.32~-1.01,P<0.00001)。亚组分析:6项前瞻性研究结果显示,GCs联合IVIG组发热持续时间短于单用IVIG组,差异有统计学意义(MD=-1.92,95%CI:-2.74~-1.09,P<0.00001);2项回顾性研究结果显示,GCs联合IVIG组治疗发热持续时间短于单用IVIG组,但差异无统计学意义(MD=-1.23,95%CI:-3.52~-1.06,P=0.29)。见图 4。
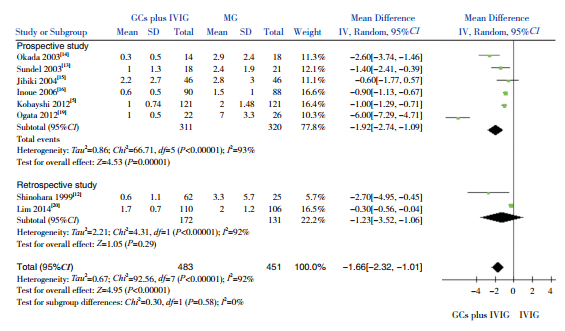
|
图 4 两组发热持续时间比较的Meta分析 |
2.4.3 不良反应发生率
以治疗后的不良反应发生率为观察指标,纳入4项前瞻性研究[13, 16-18](657例患儿),结果显示两组的不良反应发生率差异无统计学意义(OR=0.97,95%CI:0.57~1.64,P=0.92)。
2.4.4 首次治疗未反应率以两组首次治疗未反应率为观察指标,纳入8项研究(2065例患儿),结果显示GCs联合IVIG组首次治疗未反应率低于单用IVIG组,差异有统计学意义(OR=0.37,95%CI:0.27~0.51,P<0.00001)。亚组分析:5项前瞻性研究结果显示,GCs联合IVIG组首次治疗未反应率低于单用IVIG组,差异有统计学意义(OR=0.61,95%CI:0.38~0.98,P=0.04);3项回顾性研究结果显示,GCs联合IVIG组首次治疗未反应率低于单用IVIG组,差异有统计学意义(OR=0.25,95%CI:0.16~0.40,P<0.00001)。见图 5。
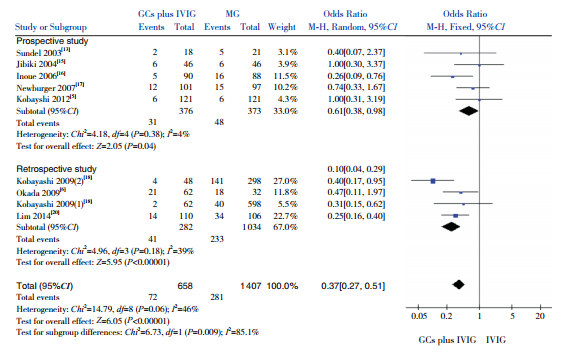
|
图 5 两组首次治疗未反应率比较的Meta分析 |
2.4.5 复发率
以复发率为观察指标,纳入5项研究[5-6, 16, 18, 20](1736例患儿),结果显示GCs联合IVIG组和单用IVIG组两组的复发率差异无统计学意义(OR=1.44,95%CI:0.69~3.00,P=0.33)。亚组分析:2项前瞻性研究[5, 16]结果显示,两组的复发率差异无统计学意义(OR=0.99,95%CI:0.48~2.02,P=0.97);3项回顾性研究[6, 18, 20]结果亦显示,两组复发率差异无统计学意义(OR=1.78,95%CI:0.56~5.61,P=0.33)。
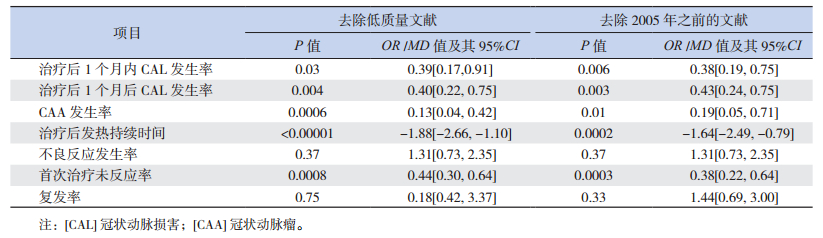
2.5 敏感性分析为解决文献质量高低及时间跨度大所带来的差异性,参照文献质量评价结果去除3篇低质量研究文献[13, 15, 18];另以2005年为界点,纳入近10年的研究文献进行两种敏感性分析。如表 2所示:敏感性分析与总体Meta森林图分析的结果趋向一致,提示纳入文献的差异性较小。
| 表 2 敏感性分析 |
3 讨论
KD的发病机制和病因至今尚不明确,目前认为KD是在一定遗传易感性基础上,由外源性抗原触发,引起机体免疫紊乱,将自身血管组织作为靶器官,引起血管的广泛性免疫损伤所致[21]。GCs具有快速、强大而非特异性的抗炎作用以及免疫抑制作用,对自身免疫源性炎症有很好的疗效,Kobayashi等[5]及Inoue等[16]多项研究也显示KD患儿联用GCs后能明显缩短患儿住院时间、发热天数,降低血清C-反应蛋白、血沉等炎症指标。但自从Kato等[2]及Kuaskawa等[3]提出应用GCs可能产生CAL甚至形成动脉瘤风险后,人们对于GCs治疗KD患儿的有效性及安全性产生了争议,有关GCs治疗KD的临床研究也不断涌现。
本Meta分析共纳入符合标准的研究文献11篇,均为英文文献。Meta分析结果显示:无论治疗1个月内还是1个月后,GCs联合IVIG组CAL及CAA的发生率均低于单用IVIG组,差异有统计学意义。通过亚组分析发现,治疗1个月后的CAL发生率降低主要源于前瞻性研究,结论相对可靠,而1个月内的CAL发生率及CAA的发生率降低主要源于回顾性研究,可能影响总体研究结果的可靠性。在发热持续时间和首次治疗未反应率方面,GCs联合IVIG组疗效优于单用IVIG组,不论总体还是前瞻性研究亚组的差异都有统计学意义。而两组不良反应发生率和复发率在总体及亚组分析中差异均无统计学意义。
本研究的局限性:(1)纳入研究11项,仅有7项是前瞻性对照研究,Meta分析的检验效能可能不足;(2)部分纳入研究未描述随机序列的产生方法和分配隐藏方法,且仅有5项研究采用盲法,因此所纳入研究可能存在选择性偏倚;(3)本Meta分析只纳入了中、英文文献,且最终纳入的均为英文文献,可能存在潜在的发表偏倚;(4)GCs、丙种免疫球蛋白等药物的具体用法(种类、剂型、剂量、持续时间)也存在差异,可能对文献的整体评价造成一定的偏倚。
综上所述,本研究显示,GCs联合IVIG初始治疗能够明显降低KD患儿首次治疗未反应率,缩短患儿发热时间,不增加患儿的不良反应发生率和复发率。在KD患儿CAL风险防治方面,总体研究显示GCs联合IVIG可有效降低CAL及CAA的发生率,但亚组分析显示证据力度较弱,尚需更多大样本、多中心、随机、双盲的前瞻性临床对照研究来进一步验证。
| [1] | 杨波, 罗军, 张颖, 等. 川崎病治疗新进展[J]. 中华实用儿科临床杂志,2014,29 (9) :707–709. |
| [2] | Kato H, Koike S, Yokoyama T. Kawasaki disease: effect of treatment on coronary artery involvement[J]. Pediatrics,1979, 63 (2) :175–179 . |
| [3] | Kuaskawa S. Long-term administrative care of Kawasaki disease[J/OL]. Acta Pediatr Jap, 1983, 25 (2): 205-209. |
| [4] | Millar K, Manlhiot C, Yeung RS, et al. Corticosteroid administration for patients with coronary artery aneurysms after Kawasaki disease may be associated with impaired regression[J]. Int J Cardiol,2012, 154 (1) :9–13 . |
| [5] | Kobayashi T, Saji T, Otani T, et al. Efficacy of immunoglobulin plus prednisolone for prevention of coronary artery abnormalities in severe Kawasaki disease (RAISE study): a randomised, open-label, blinded-endpoints trial[J]. Lancet,2012, 379 (9826) :1613–1620 . |
| [6] | Okada K, Hara J, Maki I, et al. Pulse methylprednisolone with gammaglobulin as an initial treatment for acute Kawasaki disease[J]. Eur J Pediatr,2009, 168 (2) :181–185 . |
| [7] | Wooditch AC, Aronoff SC. Effect of initial corticosteroid therapy on coronary artery aneurysm formation in Kawasaki disease: a meta-analysis of 862 children[J]. Pediatrics,2005, 116 (4) :989–995 . |
| [8] | Research Committee on Kawasaki Disease. Report of subcommittee on standardization of diagnostic criteria and reporting of coronary artery lesions in Kawasaki disease[R]. Tokyo: Ministry of Health and Welfare, 1984. |
| [9] | Council on Cardiovascular Disease in the Young, Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, American Heart Association. Diagnostic guidelines for Kawasaki disease[J]. Circulation,2001, 103 (2) :335–336 . |
| [10] | Banares R, Albillos A, Rincon D, et al. Endoscopic treatment versus endoscopic plus pharmacologic treatment for acute variceal bleeding: a meta-analysis[J]. Hepatology,2002, 35 (3) :609–615 . |
| [11] | Wells GA, Shea B, Connell DO, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomized studies in meta-analyses[J]. Appl Eng Agric,2002, 18 (6) :727–734 . |
| [12] | Shinohara M, Sone K, Tomomasa T, et al. Corticosteroids in the treatment of the acute phase of Kawasaki disease[J]. J Pediatr,1999, 135 (4) :465–469 . |
| [13] | Sundel RP, Baker AL, Fulton DR, et al. Corticosteroids in the initial treatment of Kawasaki disease: report of a randomized trial[J]. J Pediatr,2003, 142 (6) :611–616 . |
| [14] | Okada Y, Shinohara M, Kobayashi T, et al. Effect of corticosteroids in addition to intravenous gamma globulin therapy on serum cytokine levels in the acute phase of Kawasaki disease in children[J]. J Pediatr,2003, 143 (3) :363–367 . |
| [15] | Jibiki T, Terai M, Kurosaki T, et al. Efficacy of intravenous immune globulin therapy combined with dexamethasone for the initial treatment of acute Kawasaki disease[J]. Eur J Pediatr,2004, 163 (4-5) :229–233 . |
| [16] | Inoue Y, Okada Y, Shinohara M, et al. A multicenter prospective randomized trial of corticosteroids in primary therapy for Kawasaki disease: clinical course and coronary artery outcome[J]. J Pediatr,2006, 149 (3) :336–341 . |
| [17] | Newburger JW, Sleeper LA, McCrindle BW, et al. Randomized trial of pulsed corticosteroid therapy for primary treatment of Kawasaki disease[J]. N Engl J Med,2007, 356 (7) :663–675 . |
| [18] | Kobayashi T, Inoue Y, Otani T, et al. Risk stratification in the decision to include prednisolone with intravenous immunoglobulin in primary therapy of Kawasaki disease[J]. Pediatr Infect Dis J,2009, 28 (6) :498–502 . |
| [19] | Ogata S, Ogihara Y, Honda T, et al. Corticosteroid pulse combination therapy for refractory Kawasaki disease: a randomized trial[J]. Pediatrics,2012, 129 (1) :e17–e23 . |
| [20] | Lim YJ, Jung JW. Clinical outcomes of initial dexamethasone treatment combined with a single high dose of intravenous immunoglobulin for primary treatment of Kawasaki disease[J]. Yonsei Med J,2014, 55 (5) :1260–1266 . |
| [21] | Jia S, Li C, Wang G, et al. The T helper type 17/regulatory T cell imbalance in patients with acute Kawasaki disease[J]. Clin Exp Immunol,2010, 162 (1) :131–137 . |
 2016, Vol. 18
2016, Vol. 18