2. 陕西省安康市妇幼保健院新生儿科, 陕西 安康 725000
新生儿期细菌感染性疾病既缺乏特异性表现,又容易迅速加重。因此,为了防止严重感染延误治疗,预防性使用抗生素或抗生素过度使用现象在新生儿科普遍存在 [1]。然而,生后早期使用抗生素对新生儿带来的不良后果也不容忽视。抗生素对神经系统的损害已有大量临床和实验室的直接证据,如高浓度青霉素的神经毒作用,头孢菌素类和碳青霉烯类抗生素的致癎作用,氨基糖苷类抗生素的听神经损伤和前庭毒性反应等 [2],这些不良反应多为抗生素剂量过大或患者存在基础疾病(如神经精神疾病或肾脏疾病)时容易产生的神经毒作用。然而,近年来研究发现抗生素对中枢神经系统功能的影响除了神经毒作用的直接损伤,还与动物的行为异常和某些神经精神类疾病的发病有关。Bercik等的研究显示,抗生素制剂改变了小鼠的行为和中枢神经系统活动,比如增加了小鼠在明暗箱测试中的探索行为,减少了穿梭的潜伏期,提高了海马和杏仁核中脑源性神经营养因子水平等 [3]。House等的研究发现,自闭症儿童普遍在 3岁前过度使用抗生素 [4]。然而,目前较少有人关注新生儿期使用抗生素对发育脑的功能影响。本文首次研究了抗生素对幼鼠神经元近期和远期电生理功能的影响,目的是进一步明确新生儿期使用抗生素是否对发育脑产生不良影响。头孢呋辛钠(cefuroxime sodium ,CS)被认为是新生儿安全有效的一线抗生素,并在临床上广泛使用 [5],而小脑是参与躯体-内脏-认知等多种功能调节的重要脑区 [6],因此我们观察了头孢呋辛钠对幼鼠小脑主神经元浦肯野细胞(purkinje cells,PCs)兴奋性和突触可塑性的影响,报道如下。
1 材料与方法 1.1 试剂和仪器根据文献 [7]配制人工脑脊液(artificialcerebrospinal fluid,ACSF)和电极内液,试剂购自Sigma公司。
振动切片机(VT1000S,Leica),正置显微镜(Zeiss,Axopatch,Germen),微电极操纵仪(Model 285,Sutter Instrument,USA),放大器(Axon700A,Axon Instrument,USA),模拟-数字转换器(Digidata1322A,Axon Instruments,USA),玻璃微电极拉制仪(P-97,Sutter Instrument,USA),刺激器(PG4000A,CYGNUS),渗透压测定仪(Model210,FISKE ASSOCIATE,USA),恒流泵(HL-2,上海泸西仪器厂)。
1.2 实验动物及 CS剂量健康新生 7 d(postnatal day 7,P7)SD大鼠由第四军医大学动物实验中心提供。注射用头孢呋辛钠购自广州白云山天心制药股份有限公司。据人与大鼠体表面积换算公式 [8]确定 P7大鼠的 CS等效量约为每次 237 mg/kg、每 12 h一次(q12 h);P14幼鼠 CS的等效量约为每次 317 mg/kg、q8 h。均腹腔注射给药。
1.3 动物分组和处理将健康 P7 SD大鼠随机分为早期用药Ⅰ组、早期用药Ⅱ组、早期用药对照组、晚期用药组和晚期用药对照组。早期用药Ⅰ组:P7~P14给药,CS每次 237 mg/kg、q12 h,连续 7 d,于 P15处死;早期用药 Ⅱ组:P7~P14给药,CS每次 237 mg/kg、q12 h,连续 7 d,然后继续饲养至 P22处死;早期用药对照组:P7~P14腹腔注射与早期用药组等容积的生理盐水(normal saline,NS)、q12 h,连续7 d,于 P15处死。晚期用药组:P14~P21给药,CS每次 317 mg/kg、q8 h,连续 7 d,于 P22处死;晚期用药对照组:从 P14开始腹腔注射与晚期用药组等容积的 NS、q8 h,连续 7 d,P22处死。每组动物均为 10只。符合西京医院实验动物保护和使用委员会的规定。
1.4 脑片制备将大鼠断头取出小脑,迅速投入充有95%O2+5%CO2混合气的 0℃ ACSF中,约 1 min取出,修整小脑组织块后迅速移入切片槽固定,用振动切片机切出 300~400 μm厚矢状面小脑脑片,立即转移至 32℃的 ACSF中孵育约 30 min,移至室温下继续孵育,1 h后开始记录。整个过程均予以 95% O2+5% CO2通气。
1.5 全细胞膜片钳记录将脑片移至记录浴槽内,先在低倍镜下确定小脑皮层的细胞层,然后在高倍镜下选择表面光滑、轮廓清晰、立体感强的 PCs进行全细胞膜片钳记录。玻璃微电极充灌电极内液后电阻为5~8 MΩ。当电极尖端靠近 PC时,给予合适的负压,形成 1 GΩ以上高阻抗封接,继续施加负压吸破细胞膜,形成 PC全细胞记录模式。记录过程中使用恒流泵持续向记录浴槽内灌注充以 95% O2+5% CO2混合气体的 ACSF,流速为 2 mL/min。在电压钳模式下,钳制电压为-70 mV,给予细胞一系列去极化电压(10~80 mV),可记录到 PCs的内向电流。在电流钳模式下,给予细胞一系列去极化电流(50~500 pA,100 ms),诱发 PCs发放的动作电位。将充有 ACSF的玻璃微电极置于小脑脑片的分子层刺激平行纤维(parallel fiber,PF),可在 PCs上记录到兴奋性突触后电流(excitatory postsynapticcurrent,EPSC)。以一串频率为 1Hz的 300个脉冲组成的低频刺激(low-frequency stimulation,LFS)诱发出 PCs长时程抑制(long-term depression,LTD)。所有记录在室温(20~25℃)下进行。
1.6 统计学分析数据采集使用 P Clamp软件,数据测量使用Clampfit软件。应用 Origin 8.0进行数据处理,数据以均数 ±标准差(x±s)表示,采用 t检验或单因素方差分析进行组间差异比较。P<0.05为差异有统计学意义。
2 结果 2.1 头孢呋辛钠对幼鼠小脑 PCs兴奋性的影响在电流钳模式下,记录 PCs的膜电位和动作电位。各组均记录 20个 PCs。早期用药组和晚期用药组的 PCs膜电位、动作电位阈值和 200 pA诱发的动作电位频率与对照组相比,差异均无统计学意义(P>0.05),见表 1。
| 表 1 PCs 膜电位、动作电位阈值和 200 pA 诱发的动作电位频率(n=20,x±s) |
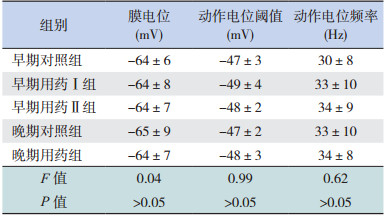
在电流钳模式下,给予细胞内微小的超极化电流维持膜电位-70 mV,记录去极化电流诱发的动作电位(图 1A)。各组均记录 18个 PCs,测量其峰值进行组间比较:早期用药Ⅰ组的动作电位峰值(62.5±2.4 mV)与早期对照组(60.4±1.8 mV)相比差异无统计学意义(P>0.05);晚期用药组(66.5±2.9 mV)与晚期对照组(60.7±2.1 mV)相比差异无统计学意义(P>0.05);早期用药Ⅱ组(65.7±2.8 mV)与晚期对照组和晚期用药组相比,差异均无统计学意义(P>0.05)。见图 1B。
|
图 1 头孢呋辛钠对幼鼠小脑 PCs 动作电位幅值的 影响(n=18) A:电流钳模式下膜电位 -70 mV 时 100 pA 和200 pA 去极化电流诱发 PCs 的典型动作电位;B:去极化电流诱发各组 PCs 动作电位峰值的比较。 |
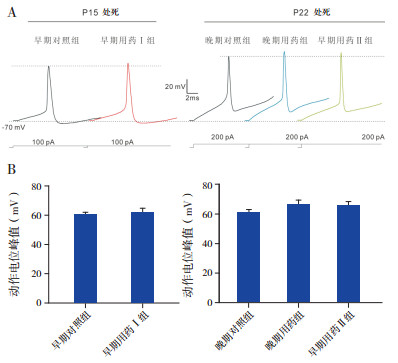
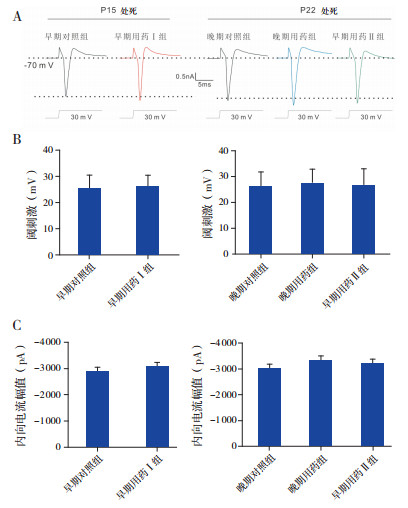
在电压钳模式下,膜电位被钳制在-70 mV,给予细胞一定的去极化电压可诱发出 PCs的内向电流(图 2A)。诱发内向电流的最小去极化电压值为阈刺激。各组均记录 25个 PCs。早期对照组、早期用药 I组和早期用药Ⅱ组的阈刺激分别为25±5 mV,26±4 mV和 27±6 mV;晚期对照组和晚期用药组分别为 26±5 mV和 28±5 mV。早期用药Ⅰ组与早期对照组相比,晚期用药组与晚期对照组相比,早期用药Ⅱ组与晚期对照组和晚期用药组相比,诱发内向电流的阈刺激差异均无统计学意义(P>0.05)。见图 2B。
|
图 2 头孢呋辛钠对幼鼠小脑 PCs 内向电流阈刺激和电流幅值的影响 A:电压钳模式下膜电位被钳制在 -70 mV时诱发各组 PCs 典型的内向电流(n=25);B:各组诱发内向电流阈刺激的比较(n=25);C:30 mV 去极化电压诱发各组 PCs 内向电流峰值的比较(n=10)。 |
测量各组(各组记录 10个 PCs)以 30 mV去极化电压诱发的内向电流幅值,并进行组间比较。早期用药Ⅰ组(3 063±175 pA)略高于早期对照组(2 847±177 pA),但差异无统计学意义(P>0.05);早期用药 Ⅱ组(3 216±166 pA)和晚期用药组(3 330±181 pA)均高于晚期对照组(3 010±157 pA),但差异无统计学意义(P>0.05);早期用药Ⅱ组略低于晚期用药组,差异也无统计学意义(P>0.05)。见图 2C。
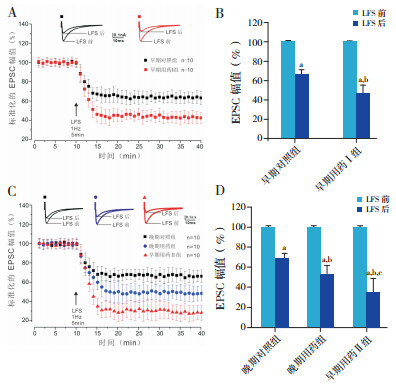
2.2 头孢呋辛钠对幼鼠小脑 PF-PC突触可塑性的影响将玻璃电极置于小脑脑片分子层,给予一定强度的方波(波宽 0.1 ms,强度 20~50 µA)刺激,可在 PC上记录到 PF兴奋引起的 EPSC。各组均记录 10个 PCs。以 1 Hz的频率刺激 PF 5 min,可使PCs EPSC幅值迅速抑制,并持续 30 min以上,此即 LTD现象。早期对照组 EPSC幅值在低频刺激后迅速降低到刺激前的(66±6)%,早期用药Ⅰ组降至刺激前的(47±9)%,比早期对照组的抑制程度更大(P<0.01),见图 3A~B。晚期用药组EPSC幅值抑制程度大于晚期对照组 [(53±9)%vs(69±5)%],P<0.01;早期用药Ⅱ组 EPSC幅值抑制程度最大,降低到刺激前的(35±14)%,与晚期对照组和晚期用药组相比,差异有统计学意义(P<0.01)。见图 3C~D。
|
图 3 头孢呋辛钠对幼鼠小脑平行纤维 PCs 兴奋性突触后电流的影响(n=10) A、C:低频刺激(1 Hz,5 min)PF-PC 的兴奋性突触后电流的长时程抑制。B、D:低频刺激前后兴奋性突触后电流抑制程度的比较。[PF] 平行纤维;[PC] 浦肯野细胞;[LFS] 低频刺激;[EPSC] 兴奋性突触后电流。a 示与刺激前比较, P<0.01;b 示与对照组刺激后比较, P<0.01;c 示与晚期用药组刺激后比较, P<0.01。 |
3 讨论
以往对抗生素不良影响的关注多集中于抗生素对各系统包括神经系统在内的毒副作用 [2, 9],而抗生素暴露对中枢神经系统神经元电生理功能有无影响尚未见报道,本研究首次发现抗生素处理的幼鼠小脑主神经元 PC电活动发生了改变。
本研究结果显示,生后早期使用头孢呋辛钠的 SD幼鼠,其小脑 PCs的膜电位、动作电位阈值和放电频率均无显著变化,但内向电流幅值和动作电位幅值均有轻微增大。所有用药组的 PCs动作电位幅值的变化趋势与内向电流的变化趋势一致,说明头孢呋辛钠对幼鼠 PCs内向电流和动作电位幅值的影响是真实存在的。虽然这种轻微的增加没有统计学意义,但却不能忽略这种微小改变对 PCs电生理功能的影响。小脑 PCs的内向电流是由钠离子和钙离子内流引起 [10-11],这种轻微增大虽无统计学差异,仍然提示头孢呋辛钠可能增强了钠通道和/或钙通道的活性,使钠离子和/或钙离子内流增加,从而使 PCs内向电流增大。而内向电流的变化会引起动作电位幅值的相应变化,神经元动作电位幅值的改变可能影响突触后神经递质的释放,进而影响神经元之间的突触传递和突触可塑性。
有研究发现氨基糖甙类和喹诺酮类抗生素可以加重重症肌无力小鼠业已存在的神经肌肉接头处的传递功能障碍,头孢呋辛和头孢他啶对此无明显影响 [12]。而本研究发现头孢呋辛钠对幼鼠小脑 PF-PC之间突触传递的可塑性有明显影响。突触可塑性是突触形态和功能上的改变,是发育中的大脑适应环境影响的最重要机制 [13-14]。大量文献显示,学习和记忆过程伴随着突触可塑现象 [15-16]。兴奋性突触的可塑性变化与记忆编码有关,主要表现为长时程增强(long-term potentiation,LTP)和LTD。LTD是指某种刺激使兴奋性突触的传递效率持续降低 [17]。小脑环路中最重要的兴奋性突触PF-PC突触 LTD(以下简称小脑 LTD)的形成与 γ-氨基-3-羟基-5-甲基恶唑-4-丙酸(AMPA)受体和 N-甲基-D-天门冬氨酸(NMDA)受体有关 [18-19]。简言之,PF释放的谷氨酸与 PCs膜上的AMPA受体结合,使 PCs膜上的 Na+通道开放,Na+内流使细胞去极化,激活电压依赖性的 NMDA受体,使 Ca2+内流,细胞内 Ca2+浓度增高激活了一系列复杂的级联反应,最终使 PCs膜上的 AMPA受体数量减少,对突触前释放的谷氨酸反应减弱,从而产生了 LTD[19-20]。
近年来研究发现小脑 LTD在动物的学习记忆和高级认知功能方面发挥关键作用,常常被作为动物行为学研究的分子模型 [17, 21]。与海马 LTP的储存式记忆不同,小脑 LTD主要与记忆纠错有关 [17]。本研究结果显示早期用药 I组(P7-P14)或晚期用药(P14-P21)均使幼鼠小脑 LTD显著增强,二者对 EPSC抑制的程度相似。值得注意的是,早期用药 II组 EPSC抑制的程度显著大于早期用药Ⅰ组和晚期用药组。这些结果表明,新生期使用头孢呋辛钠可显著影响幼鼠小脑 PF-PC的突触可塑性。无论早期用药还是晚期用药,头孢呋辛钠均增强了幼鼠小脑 LTD的抑制程度,而早期用药组在发育期(P22)的 LTD抑制程度较晚期用药组更为显著。由于 LTD现象是分子水平的记忆痕迹,LTD的异常表达有可能对运动学习和高级认知功能产生不良影响,因此,这种 LTD增强现象与抗生素处理动物的异常行为之间是否有关尚待更多研究证实。
以往抗生素处理动物的研究,多使用新霉素和杆菌肽,经口给药 [3]。由于新生儿期一般选择静脉给药途径,所以本研究采用了与大鼠静脉给药效应相同的腹腔注射给药方式 [22-23],更接近临床实际情况。以往的研究已证实连续使用抗生素(无论口服还是静脉给药)3~7 d可导致动物和人肠道菌群紊乱 [3, 24-27],本研究连续 7天给予新生幼鼠腹腔注射头孢呋辛钠,我们推测可能造成了肠道菌群紊乱。由于本研究的主要目的是探讨抗生素暴露和动物神经元电生理之间的关系,所以未同时测量幼鼠肠道菌群的变化。但是,因为头孢呋辛钠不能透过血脑屏障,我们观察到的神经元电生理变化不应是头孢呋辛钠的直接作用,推测肠道微生态变化是头孢呋辛钠影响神经元电生理功能的一种可能的机制,这种推测有待进一步研究证实。
综上所述,本研究首次在新生大鼠发现生后早期使用治疗剂量的头孢呋辛钠可轻微增大小脑PCs的内向电流和动作电位幅值,显著增强低频刺激诱导的小脑 LTD,并且这种影响在停药后仍持续存在,提示新生儿科医生要重视生后早期抗生素暴露对新生儿未来脑发育的影响,而对于生后早期使用抗生素的新生儿,在运动功能、认知功能、学习能力、情绪控制、心理问题和精神疾病等方面进行远期随访是十分必要的。
| [1] | Schulman J, Dimand RJ, Lee HC, et al. Neonatal intensive care unit antibiotic use[J]. Pediatrics,2015, 135 (5) :826–833 . |
| [2] | 贺瑞萍, 郭永英. 抗生素类药物对神经系统的毒性反应[J]. 中国药事,2004,18 (12) :774–775. |
| [3] | Bercik P, Denou E, Collins J, et al. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice[J]. Gastroenterology,2011, 141 (2) :599–609 . |
| [4] | House SA, Goodman DC, Weinstein SJ, et al. Prescription use among children with autism spectrum disorders in Northern New England: intensity and small area variation[J]. J Pediatr,2016, 169 :277–283.e2 . |
| [5] | de Louvois J, Mulhall A, Hurley R. Cefuroxime in the treatment of neonates[J]. Arch Dis Child,1982, 57 (1) :59–62 . |
| [6] | Riedel MC, Ray KL, Dick AS, et al. Meta-analytic connectivity and behavioral parcellation of the human cerebellum[J]. NeuroImage,2015, 117 :327–342 . |
| [7] | Zhang Y, Magnus G, Han VZ. Synaptic dynamics and long-time plasticity at synapses of Purkinje cells onto neighboring Purkinje cells of a mormyrid fish: A dual cell recording study[J]. Neuroscience,2012, 225 :199–212 . |
| [8] | 孙瑞元, 马越鸣, 洪宗元. 药理实验设计中的剂量问题[M]// 徐叔云, 卞如濂, 陈修. 药理实验方法学. 第3版. 北京: 人民卫生出版社, 2002: 202-204. |
| [9] | 李芳梅, 曹凤美, 晁兰芳. 抗生素对神经和心肺的副作用[J]. 医学理论与实践,2001,14 (12) :1228–1229. |
| [10] | Kim CH, Oh SH, Lee JH, et al. Lobule-specific membrane excitability of cerebellar Purkinje cells[J]. J Physiol,2012, 590 (Pt2) :273–288 . |
| [11] | Masoli S, Solinas S, D'Angelo E. Action potential processing in a detailed Purkinje cell model reveals a critical role for axonal compartmentalization[J]. Front Cell Neurosci,2015, 9 :1–22 . |
| [12] | 邓敏, 王云甫, 胡芳, 等. 不同种类抗生素影响重症肌无力小鼠神经肌肉接头处的传递功能[J]. 中国临床康复,2005,9 (17) :233–235. |
| [13] | Johnston MV, Ishida A, Ishida WN, et al. Plasticity and injury in the developing brain[J]. Brain Dev,2009, 31 (1) :1–10 . |
| [14] | Cohen-Cory S. The developing synapse: construction and modulation of synaptic structures and circuits[J]. Science,2002, 298 (5594) :770–776 . |
| [15] | Schonewille M, Gao Z, Boele HJ, et al. Reevaluating the role of LTD in cerebellar motor learning[J]. Neuron,2011, 70 (1) :43–50 . |
| [16] | Gao Z, van Beugen BJ, De Zeeuw CI, et al. Distributed synergistic plasticity and cerebellar learning[J]. Nat Rev Neurosci,2012, 13 (9) :619–635 . |
| [17] | Ito M, Yamaguchi K, Nagao S, et al. Long-term depression as a model of cerebellar plasticity[J]. Prog Brain Res,2014, 210 :1–30 . |
| [18] | Mapelli L, Pagani M, Garrido JA, et al. Integrated plasticity at inhibitory and excitatory synapses in the cerebellar circuit[J]. Front Cell Neursci,2015, 9 :169. |
| [19] | Linden DJ, Dickinson MH, Smeyne M, et al. A long-term depression of AMPA currents in cultured cerebellar Purkinje neurons[J]. Neuron,1991, 7 (1) :81–89 . |
| [20] | Kohda K, Kakegawa W, Yuzaki M. Unlocking the secrets of the δ2 glutamate receptor: A gatekeeper for synaptic plasticity in the cerebellum[J]. Commun Integr Biol,2013, 6 (6) :e26466. |
| [21] | D'Angelo E. The organization of plasticity in the cerebellar cortex: from synapses to control[M]//Ramnani N. Prog Brain Res(Vol.210). Amsterda: Elsevier Science BV, 2014: 31-58. |
| [22] | Zhao LS, Yin R, Wei BB, et al. Comparative pharmacokinetics of cefuroxime lysine after single intravenous, intraperitoneal, and intramuscular administration to rats[J]. Acta Pharmacol Sin,2012, 33 (11) :1348–1352 . |
| [23] | 安备, 杜湘珂, 霍天龙, 等. SD大鼠腹腔注射及尾静脉注射18F-FDG PET/CT成像对比研究[J]. 医学研究杂志,2013,42 (5) :48–52. |
| [24] | Soll RF, Edwards WH. Antibiotic use in neonatal intensive care[J]. Pediatrics,2015, 135 (5) :928–929 . |
| [25] | 关小萍, 梁春华, 陈延欢. 新生儿肺炎疗效及肠道微生态的研究[J]. 中国实用医药,2009,4 (21) :15–17. |
| [26] | 王凤科. 广谱抗生素对感染性疾病患者肠道微生态的影响[J]. 吉林医学,2010,31 (32) :5726–5728. |
| [27] | 栾娜, 孙运波, 段峰. 头孢曲松钠对菌血症小鼠肠道膜菌群的影响[J]. 齐鲁医学杂志,2007,22 (4) :326–328. |
 2016, Vol. 18
2016, Vol. 18