2. 江西省儿童医院消化科, 江西 南昌 330006 ;
3. 江西省儿童医院中心实验室,江西 南昌 330006
幽门螺杆菌(Helicobacter pylori,H.pylori)是引起儿童慢性胃炎和消化性溃疡的一种重要病原菌。目前,我国人群中H.pylori感染率高达42.0%~84.6%,平均感染率为54.8%,且大多数感染H.pylori的成人在儿童时期即已感染了H.pylori[1]。儿童感染H.pylori后未给予及时规范的根除治疗,H.pylori对胃黏膜损伤可持续数年甚至终身,这不仅可以引起儿童多种上消化道疾病,还可能与一些胃十二指肠外疾病相关,如儿童生长迟缓、缺铁性贫血、特发性血小板减少性紫癜和过敏性疾病等[2]。研究表明,H.pylori在胃黏膜内定植和对胃肠道黏膜的损害程度主要取决于细菌毒素因子、宿主遗传因素及环境因素,其中H.pylori毒素因子基因主要有细胞毒素相关基因A(cytotoxin-associated gene A,cagA)、空泡毒素基因(vacuolating cytotoxin gene A,vacA)以及H.pylori与胃上皮细胞接触后可诱导产生的基因(induced by contact with epithelium,iceA)[3-4]。不同的H.pylori毒素因子基因亚型可能对上消化道疾病的发展过程起到重要的作用[5]。本研究对江西地区患有胃十二指肠疾病的儿童胃窦黏膜进行分离培养H.pylori菌株,采用PCR方法检测H.pylori ureA、cagA、vacA和iceA基因亚型,分析江西地区胃十二指肠疾病儿童感染的H.pylori分离株基因型分布情况及优势基因型,并探讨H.pylori基因亚型与胃十二指肠疾病类型之间的关系。
1 资料与方法 1.1 研究对象2014年7月至2015年8月因患有胃十二指肠疾病、在江西省儿童医院进行胃镜检查的儿童为研究对象,患儿均来自江西地区。316例儿童中,内镜诊断慢性浅表性胃炎169例(53.5%),十二指肠球部溃疡108例(34.2%),十二指肠球炎29例(9.2%),胃溃疡10例(3.2%)。常规内镜检查后取胃黏膜进行分离培养,从316例患有胃十二指肠疾病儿童胃窦黏膜中,培养出107株H.pylori菌株,阳性率为33.9%。107株H.pylori菌株中,来自男性患儿81例,女性患儿26例,年龄1岁9个月至14岁。内镜下诊断消化性溃疡60例,慢性浅表性胃炎34例,十二指肠球炎13例。全部病例胃镜检查前4周内未服用过质子泵抑制剂、H2受体拮抗剂、非甾体类消炎药、铋剂或抗生素等。病变部位的统计学处理以单例统计,多发性病变以镜下病变表现最严重的那个所在部位进行统计。本研究通过了江西省儿童医院伦理委员会批准(JXSETYY-2016003)。
将获取的胃窦黏膜用匀浆器研磨,吸取匀浆液涂布于Karmali培养基上,在微需氧条件下(温度37℃,5% O2,10% CO2,85% N2)培养3~7 d,找出典型菌落进行传代和增菌培养获得H.pylori菌株,经革兰染色、快速尿素酶试验及显微镜下的形态进行鉴定,将H.pylori阳性菌株于保存液中-80℃保存。H.pylori标准菌株NCTC11639获赠于南昌大学第一附属医院消化研究所。
1.2 引物设计合成根据PubMed数据库和中国科学引文数据库公开发表文献中提供的检测H.pylori ureA、cagA、vacA和iceA基因的引物序列和扩增片段长度[6-9],由南京金斯瑞生物科技有限公司合成。
1.3 H.pylori模板DNA的制备将上述分离培养的H.pylori菌株,用QIAamp DNA mini kit(Qiagen,Germany)试剂盒抽提菌株H.pylori基因组,严格按照试剂盒说明步骤和注意事项操作,避免样本之间的交叉污染。提取的基因DNA保存于-20℃备用。
1.4 PCR反应扩增H.pylori ureA、cagA、vacA和iceA基因的引物序列及产物大小见表 1。采用天根生化科技(北京)有限公司2×Taq PCR MasterMix反应体系,总反应体积25 µL。2×Taq PCR MasterMix 12.5 µL(0.1 U/µL Taq Polymerase,500 µmol/L each of dNTP,20 mmol/L Tris-HCL(pH 8.3),100 mmol/L
| 表 1 H.pylori ureA、cagA、vacA 和iceA 的引物序列及产物大小 |
KCL,3 mmol/L MgCL2),正反引物混合物(5 µmol/L)2µL,模板2 µL及ddH2O 8.5 µL。反应条件:94℃预变性5 min,94℃变性30 s,退火30 s,72℃延伸30 s,其中H.pylori ureA、cagA、vacAs1、vacAs1a、vacAs1b、vacAm1、vacAm2、iceA1和iceA2退火温度为55℃,vacAs1c和vacAs2退火温度为59℃,共30个循环,所有循环结束后72℃延伸7 min。以100 bp DNA Ladder [天根生化科技(北京)有限公司]为Marker,2%琼脂糖凝胶电泳(含溴乙锭 0.5 µg/mL),最后取凝胶置于紫外光下曝光进行图像分析和摄像(Bio-Rad凝胶成像分析仪),观察基因扩增产物带。以H.pylori标准菌株NCTC11639作为阳性对照。
1.5 统计学分析采用SPSS 17.0统计软件进行统计学处理与分析。计数资料采用例数和百分率(%)表示,组间比较采用χ2检验,P<0.05为差异具有统计学意义。
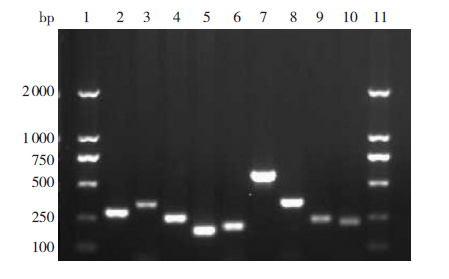
2 结果 2.1 H.pylori基因PCR扩增检测结果采用表 1中的H.pylori基因引物序列可扩增出ureA、cagA、vacAs1、vacAs1a、vacAs1c、vacAm1、
vacAm2、iceA1和iceA2基因亚型阳性产物(图 1),但在所有菌株中未扩增出vacAs1b和vacAs2基因的阳性产物。
|
图 1 H.pylori ureA、cagA、vacA 和iceA 基因 PCR扩增检测结果 2% 琼脂糖凝胶电泳(含溴乙锭 0.5 μg/mL)观 察H.pylori 基因扩增产物带,以100 bp 的DNA Ladder 为Marker, 1 和11 是Marker。2~10 泳道分别是ureA(294 bp)、cagA(349 bp)、 vacAs1(259 bp)、vacAs1a(190 bp)、vacAs1c(213 bp)、 vacAm1(570 bp)、vacAm2(352 bp)、iceA1(247 bp)和iceA2 (229 bp)。 |
2.2 H.pylori临床分离菌株ureA、cagA、vacA和iceA基因的检出结果
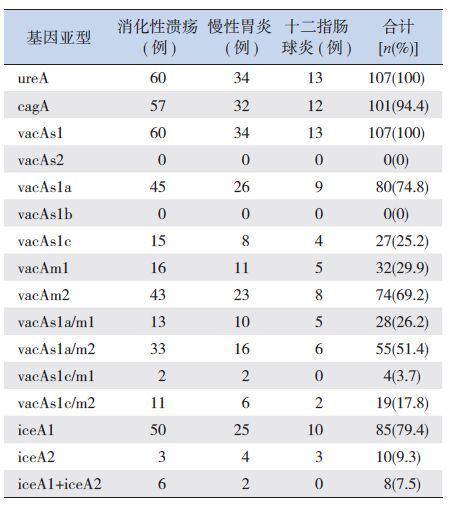
在107株H.pylori临床分离菌株中,H.pylori ureA基因阳性检出率为100%,cagA基因阳性检出率为94.4%。vacA基因总检出率为100%,其中vacAs1a、vacAs1c、vacAm1和vacAm2基因检出率分别为74.8%、25.2%、29.9%和69.2%,其中1株(0.9%)H.pylori菌株同时检测出vacAm1和vacAm2基因型;在vacA基因的嵌合体中,以vacAs1a/m2的检出率最高,占51.4%(χ2=69.283,P<0.001),其余组合检出率顺序为:vacAs1a/m1>vacAs1c/m2>vacAs1c/m1;但在所有菌株中未检测出vacAs1b和vacAs2基因亚型。iceA1和iceA2基因单独阳性检出率分别为79.4%和9.3%(χ2=113.822,P<0.001),其中8株 (7.5%)H.pylori菌株同时检出iceA1和iceA2基因阳性。见表 2。
| 表 2 107 株H.pylori ureA、cagA、vacA 和iceA 基因在胃十二指肠疾病患儿中的分布 |
2.3 H.pylori基因与胃十二指肠疾病之间的关系
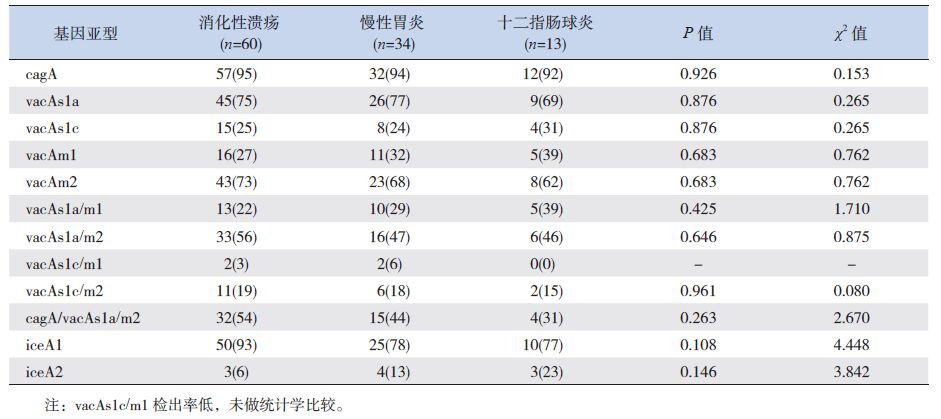
H.pylori各基因亚型在消化性溃疡、慢性胃炎和十二指肠球炎3组间的检出率比较,差异均无统计学意义(P>0.05);cagA/vacAs1a/m2基因组合型在消化性溃疡、慢性胃炎和十二指肠球炎3组间的检出率比较差异亦无统计学意义(χ2=2.670,P=0.263)。见表 3。
| 表 3 胃十二指肠疾病患儿H.pylori cagA、vacA 和iceA 基因亚型检出率的比较[n(%)] |
3 讨论
儿童H.pylori感染后机体产生的细胞毒素蛋白是损害胃黏膜屏障的重要因素之一,其中,cagA、vacA和iceA是其主要致病毒素相关基因。cagA基因编码的细胞毒素相关蛋白A(cytotoxin-associated A,CagA)通过Ⅳ型分泌系统进入胃上皮细胞内并发生磷酸化,干扰细胞信号通路,导致细胞产生肌动蛋白细胞骨架重排,形态呈蜂鸟样改变等严重的组织炎症损伤及免疫反应[10]。vacA基因存在于所有H.pylori菌株中,但仅有50%~60%的H.pylori菌株表达空泡毒素蛋白(vacuolating cytotoxin,VacA),它可以粘附到胃上皮细胞并结合进入细胞内,引起溶酶体及内质网损伤导致胃上皮细胞空泡变性和影响机体免疫功能,从而引起一系列病变。vacA基因结构中包括有信号序列区(s区) 和中间区(m区)。s区有两个等位基因:s1和s2,其中s1基因包括s1a、s1b和s1c 3种亚型;m区含有m1、m2两个等位基因[11]。iceA基因有iceA1和iceA2两个等位基因。iceA1与乳酸奈瑟菌限制性内切酶基因 nlaⅢR同源,编码一种CATG特异性限制性内切核酸酶,在H.pylori与胃上皮细胞接触后iceA1的表达上调,与消化性溃疡有显著相关性;iceA2基因的具体功能尚不明确[12]。
为了明确江西地区胃十二指肠疾病儿童感染H.pylori临床分离菌株cagA、vacA和iceA基因亚型的分布情况及H.pylori基因亚型与胃十二指肠疾病之间的关系,本研究将来自江西地区患有胃十二指肠疾病且接受了胃镜检查和胃窦黏膜活检的316例儿童纳入研究。由于胃镜检查和胃窦黏膜活检都是有创检查,尤其是对于那些上消化道症状较轻的患儿,家属不同意接受该项检查,因此,本研究中实际纳入的胃十二指肠疾病构成比可能与临床不完全一致。从316例患儿胃窦活检黏膜中,共分离培养出107株H.pylori菌株,其中来自慢性浅表性胃炎34例(H.pylori检出率20.1%),十二指肠球炎13例(H.pylori检出率44.8%),胃溃疡3例(H.pylori检出率30.0%),十二指肠球部溃疡57例(H.pylori检出率52.8%)。在儿童中,胃溃疡发病率低,因此,本研究将胃溃疡和十二指肠球部溃疡合并成消化性溃疡一起进行统计学分析。
本研究对从316例胃十二指肠疾病儿童中分离的107株H.pylori菌株采用PCR方法检测ureA基因,结果显示该基因检出率为100%,然后采用相同的方法检测cagA、vacA和iceA基因亚型。本研究结果显示,cagA基因检出率为94.4%,提示cagA基因是本组病例感染H.pylori的一种主要基因亚型。在韩国,胃十二指肠疾病儿童H.pylori菌株中cagA基因检出率为87.2%[13],本研究结果与之基本一致。在德国、土耳其和墨西哥等国家患有胃十二指肠疾病儿童感染的H.pylori菌株中,cagA基因检出率分别为71.4%、75.7%和91%[14-15]。本研究还显示,H.pylori cagA基因在消化性溃疡、慢性胃炎及十二指肠球炎中的检出率分别为95%、94%和 92%,它们之间比较差异无统计学意义,提示cagA基因不能作为本地区儿童感染H.pylori毒力强弱的一种标志。
H.pylori vacA基因分型及其嵌合体不同,其细胞毒性的大小不同,毒性大小依次为:vacAs1/m1>vacAs1/m2>vacAs2/m1>vacAs2/m2,而vacAs2/m2类型的菌株细胞毒性最小,vacAs2/m1型菌株很少有文献报道。本研究中,vacAs1a、vacAs1c、vacAm1和vacAm2基因检出率分别为74.8%、25.2%、29.9%和69.2%,其中0.9% H.pylori菌株同时检测出vacAm1和vacAm2基因。在vacA基因的嵌合体中,以vacAs1a/m2的检出率最高,占51.4%;其余组合检出率顺序为:vacAs1a/m1>vacAs1c/m2>vacAs1c/m1。在所有菌株中未检测出vacAs1b和vacAs2基因亚型。以上结果提示vacAs1a/m2基因是本组病例感染的H.pylori优势基因亚型。据文献报道,我国广州地区儿童分离的H.pylori菌株优势基因型为vacAs1/m2[16]。国外有关儿童H.pylori vacA基因的研究表明,巴基斯坦儿童优势基因型为vacAs1a/m1,波兰以vacAs1/m1型为主,巴西以vacAs1/m1最为常见[17-19]。
目前,有关儿童H.pylori iceA基因也进行了相应的临床研究。研究表明,我国广州地区儿童感染的H.pylori以iceA1 为主,iceA1检出率为78.8%[20]。韩国iceA1检出率76.0%[21],保加利亚iceA1检出率 69.3%[22],土耳其iceA2检出率57.1%[23]。本研究中,H.pylori iceA1和iceA2基因单独阳性检出率分别为79.4%和9.3%,两种基因检出率比较差异有统计学意义,提示iceA1基因是本组病例感染的H.pylori优势基因亚型。此外,在检测iceA基因时还发现,7.5% H.pylori菌株同时扩增出iceA1和iceA2基因亚型阳性产物,表明儿童H.pylori感染存在不同基因亚型菌株混合感染现象。Tanih等[24]报道有关成人H.pylori感染致胃十二指肠疾病的研究中,26%的H.pylori菌株同时检测出iceA1和iceA2基因。本研究中H.pylori不同基因型菌株混合感染率明显低于该报道,这可能与儿童H.pylori感染率与成人不同及环境因素不同有关。
H.pylori cagA、vacA和iceA作为主要的毒力基因,人们已进行大量有关H.pylori基因多态性以及与儿童胃十二指肠疾病关系的研究,但是这些结果都不能完全解释目前临床上各种类型胃十二指肠疾病有不同的转归的原因。有研究表明,随着儿童年龄的增长,H.pylori cagA与vacA基因在从正常胃黏膜发展为慢性胃炎过程中起到重要的作用;cagA与vacAs1/m1可能在胃黏膜炎症加重过程中起到协同作用,与消化性溃疡有关;iceA基因与慢性胃炎的炎症程度有关[25-27]。一项对有关vacA基因与H.pylori相关性疾病关系的Meta分析结果表明,H.pylori cagA与vacAs1/m1、iceA1基因型常同时存在,其中vacAs/m组成的不同嵌合体是胃十二指肠疾病发生的重要危险因素[28]。伊朗159例儿童胃黏膜分离培养H.pylori菌株基因亚型与临床结局的研究发现,H.pylori cagA基因的阳性率约60.0%,该基因与胃黏膜损害的程度明显相关[29]。但是,也有研究得到相反结果,认为H.pylori cagA、vacA和iceA1基因与疾病的临床结局无关[30-31]。本研究结果表明,H.pylori各基因亚型在消化性溃疡、慢性胃炎和十二指肠球炎3组间的检出率比较差异无统计学意义;cagA/vacAs1a/m2基因组合型在消化性溃疡、慢性胃炎和十二指肠球炎3组间的检出率比较差异亦无统计学意义,提示H.pylori cagA、vacA s1a/m2和iceA1基因亚型与儿童胃十二指肠疾病类型无相关性,cagA与vacAs1a/m2在儿童胃十二指肠疾病发生发展过程中没有协同作用。上述研究结果不尽相同,这可能是与不同地区儿童H.pylori菌株感染率和基因亚型的分布情况不同有关;另外,疾病的发生发展是多种因素共同作用的结果,与H.pylori毒力基因、宿主基因多态性、机体免疫状态和环境因素有关。
总之,本研究显示,来源于江西地区胃十二指肠疾病儿童感染的H.pylori优势基因是cagA、vacAs1a/m2和iceA1,H.pylori基因亚型与胃十二指肠疾病类型无相关性。由于胃镜检查和胃窦黏膜活检都是有创检查,尤其是对于那些上消化道症状较轻的患儿,家属不同意接受该项检查,从而导致本研究中的实际纳入胃十二指肠疾病疾病构成比可能与临床不完全一致,使H.pylori菌株的来源不能完全达到随机性,这是本研究的不足之处。此外,本研究中还发现0.9% H.pylori菌株同时检出vacAm1和vacAm2基因,7.5% H.pylori菌株同时检出iceA1和iceA2基因,提示胃十二指肠疾病儿童H.pylori感染存在不同基因型菌株混合感染现象,但是混合感染是否对儿童胃十二指肠疾病的发生发展存在影响,还有待进一步的研究。
| [1] | 张万岱, 胡伏莲, 萧树东, 等. 中国自然人群幽门螺杆菌感染的流行病学调查[J]. 现代消化及介入诊疗,2010,15 (5) :265–270. |
| [2] | Pacifico L, Osborn JF, Tromba V, et al. Helicobacter pylori infection and extragastric disorders in children: a critical update[J]. World J Gastroenterol,2014, 20 (6) :1379–1401 . |
| [3] | Hasosah M, Satti M, Shehzad A, et al. Prevalence and risk factors of Helicobacter pylori infection in Saudi children: a three-year prospective controlled study[J]. Helicobacter,2015, 20 (1) :56–63 . |
| [4] | Braga LL, Oliveira MA, Gonçalves MH, et al. CagA phosphorylation EPIYA-C motifs and the vacA i genotype in Helicobacter pylori strains of asymptomatic children from a high-risk gastric cancer area in northeastern Brazil[J]. Mem Inst Oswaldo Cruz,2014, 109 (8) :1045–1049 . |
| [5] | Iwanczak B, Laszewicz W, Iwanczak F, et al. Genotypic and clinical differences of seropositive Helicobacter pylori children and adults in the Polish population[J]. J Physiol Pharmacol,2014, 65 (6) :801–807 . |
| [6] | 周颖, 黄瑛, 邵彩虹, 等. 上海地区部分儿童幽门螺杆菌 cagA、vacA、iceA 基因型别分析[J]. 中国当代儿科杂志,2010,12 (4) :267–271. |
| [7] | De Gusmão VR, Nogueira Mendes E, De Magalhães Queiroz DM, et al. vacA genotypes in Helicobacter pylori strains isolated from children with and without duodenal ulcer in Brazil[J]. J Clin Microbiol,2000, 38 (8) :2853–2857 . |
| [8] | Yamaoka Y, Kodama T, Gutierrez O, et al. Relationship between Helicobacter pylori iceA, cagA, and vacA status and clinical outcome: studies in four different countries[J]. J Clin Microbiol,1999, 37 (7) :2274–2279 . |
| [9] | Ito Y, Azuma T, Ito S, et al. Analysis and typing of the vacA gene from cagA-positive strains of Helicobacter pylori isolated in Japan[J]. J Clin Microbiol,1997, 35 (7) :1710–1714 . |
| [10] | Reyes-Leon A, Atherton JC, Argent RH, et al. Heterogeneity in the activity of Mexican Helicobacter pylori strains in gastric epithelial cells and its association with diversity in the cagA gene[J]. Infect Immun,2007, 75 (7) :3445–3454 . |
| [11] | 石碧坚, 刘厚钰. 幽门螺杆菌的致病机理[M]// 胡伏莲, 周殿元. 幽门螺杆菌感染的基础与临床. 第3 版. 北京: 中国科学技术出版社, 2010: 63-81. |
| [12] | Shiota S, Suzuki R, Yamaoka Y. The significance of virulence factors in Helicobacter pylori[J]. J Dig Dis,2013, 14 (7) :341–349 . |
| [13] | Kim JY, Kim N, Nam RH, et al. Association of polymorphisms in virulence factor of Helicobacter pylori and gastroduodenal diseases in South Korea[J]. J Gastroenterol Hepatol,2014, 29 (5) :984–991 . |
| [14] | Kolaylı F, Karadenizli A, Bingöl R, et al. Differences of vacA alleles and cagA gene positivity of Helicobacter pylori strains isolated from two different countries: Turkey and Germany[J]. Mikrobiyol Bul,2012, 46 (2) :332–334 . |
| [15] | Mendoza-Elizalde S, Cortés-Márquez AC, Giono-Cerezo S, et al. Analysis of the genotypic diversity of strains of Helicobacter pylori isolated from pediatric patients in Mexico[J]. Infect Genet Evol,2015, 29 :68–74 . |
| [16] | 姚淑雯, 关锐梨, 龚四堂, 等. 广州地区幽门螺杆菌儿童分离株空泡毒素基因A 的分型[J]. 广东医学,2013,34 (20) :3117–3119. |
| [17] | Khan A, Farooqui A, Raza Y, et al. Prevalence, diversity and disease association of Helicobacter pylori in dyspeptic patients from Pakistan[J]. J Infect Dev Ctries,2013, 7 (3) :220–228 . |
| [18] | Biernat MM, Gościniak G, Iwańczak B. Prevalence of Helicobacter pylori cagA, vacA, iceA, babA2 genotypes in Polish children and adolescents with gastroduodenal disease[J]. Postepy Hig Med Dosw (Online),2014, 68 :1015–1021 . |
| [19] | Goncalves MH, Silva CI, Braga-Neto MB, et al. Helicobacter pylori virulence genes detected by string PCR in children from an urban community in northeastern Brazil[J]. J Clin Microbiol,2013, 51 (3) :988–989 . |
| [20] | 林燕芬, 龚四堂, 区文玑, 等. 广州地区患儿感染幽门螺杆菌vacA、cagA 及iceA 基因研究[J]. 中华儿科杂志,2007,45 (9) :703–707. |
| [21] | Ko JS, Kim KM, Oh YL, et al. cagA, vacA, and iceA genotypes of Helicobacter pylori in Korean children[J]. Pediatr Int,2008, 50 (5) :628–631 . |
| [22] | Boyanova L, Yordanov D, Gergova G, et al. Association of iceA and babA genotypes in Helicobacter pylori strains with patient and strain characteristics[J]. Antonie Van Leeuwenhoek,2010, 98 (3) :343–350 . |
| [23] | Ozbey G, Dogan Y, Demiroren K. Prevalence of Helicobacter pylori virulence genotypes among children in Eastern Turkey[J]. World J Gastroenterol,2013, 19 (39) :6585–6589 . |
| [24] | Tanih NF, McMillan M, Naidoo N, et al. Prevalence of Helicobacter pylori vacA, cagA and iceA genotypes in South African patients with upper gastrointestinal diseases[J]. Acta Trop,2010, 116 (1) :68–73 . |
| [25] | Homan M, Šterbenc A, Kocjan BJ, et al. Prevalence of the Helicobacter pylori babA2 gene and correlation with the degree of gastritis in infected Slovenian children[J]. Antonie Van Leeuwenhoek,2014, 106 (4) :637–645 . |
| [26] | Almeida N, Donato MM, Romãozinho JM, et al. Correlation of Helicobacter pylori genotypes with gastric histopathology in the central region of a South-European country[J]. Dig Dis Sc,2015, 60 (1) :74–85 . |
| [27] | Vaziri F, Najar Peerayeh S, Alebouyeh M, et al. Diversity of Helicobacter pylori genotypes in Iranian patients with different gastroduodenal disorders[J]. World J Gastroenterol,2013, 19 (34) :5685–5692 . |
| [28] | Sugimoto M, Zali MR, Yamaoka Y. The association of vacA genotypes and Helicobacter pylori-related gastroduodenal diseases in the Middle East[J]. Eur J Clin Microbiol Infect Dis,2009, 28 (10) :1227–1236 . |
| [29] | Falsafi T, Khani A, Mahjoub F, et al. Analysis of vacA/cagA genotypes/status in Helicobacter pylori isolates from Iranian children and their association with clinical outcome[J]. Turk J Med Sci,2015, 45 (1) :170–177 . |
| [30] | Homan M, Luzar B, Kocjan BJ, et al. Prevalence and clinical relevance of cagA, vacA, and iceA genotypes of Helicobacter pylori isolated from Slovenian children[J]. J Pediatr Gastroenterol Nutr,2009, 49 (3) :289–296 . |
| [31] | Sedaghat H, Moniri R, Jamali R, et al. Prevalence of Helicobacter pylori vacA, cagA, cagE, iceA, babA2, and oipA genotypes in patients with upper gastrointestinal diseases[J]. Iran J Microbiol,2014, 6 (1) :14–21 . |
 2016, Vol. 18
2016, Vol. 18