过敏性紫癜(Henoch-Schönlein purpura,HSP)为儿童时期常见的小血管炎[1]。然而,目前关于HSP的发病机理仍不清楚。最近几年的研究表明IgA1分子铰链区β1,3半乳糖基的缺失才是HSP发病的关键[2-3]。
IgA1铰链区的O-糖基化是在高尔基体中完成的。β1,3半乳糖基转移酶 (β1,3-galactosyltransferase,C1GALT1)作为O-糖基化的关键酶,可催化半乳糖Gal从UDP-Gal转移到Tn抗原上从而形成T抗原[4]。在哺乳动物细胞中,有活性的C1GALT1的形成需要其特异性分子伴侣Cosmc(亦称为C1GALT1C1)的共表达[5]。Cosmc通过直接识别并结合C1GALT1 N端的一个疏水性多肽从而促进C1GALT1的折叠并形成有活性的C1GALT1[6]。Cosmc基因的功能性突变可导致C1GALT1的失活,继而引起糖蛋白的糖基化降低[4]。
IgA肾病(IgA nephropathy,IgAN)与过敏性紫癜性肾炎(Henoch-Schönlein purpura nephritis,HSPN)被认为是一种疾病的两种不同表现形式,可能拥有相同的发病机理[7]。然而,关于IgAN的研究显示IgAN患者中存在Cosmc表达降低,而C1GALT1的表达则正常[8]。此外,同样涉及β1,3半乳糖基化缺失的Tn综合征,是由Cosmc基因突变所致,而非C1GALT1表达降低所致[9]。这些结果均表明Cosmc才是导致IgA1分子铰链区半乳糖基化异常的关键。因此,我们推测Cosmc可能通过其基因突变影响IgA1分子铰链区GalNAc α1-R的半乳糖基化而导致疾病的易感。目前为止,关于HSP患儿中是否存在Cosmc基因的突变还未有研究报道。
为了解HSP患儿中Cosmc基因突变可能产生的影响,我们应用降落聚合酶链反应(touch down polymerase chain reaction,Touch-down PCR)技术,对2014年3月至2015年12月就诊于我院风湿科门诊的HSP患儿的DNA标本进行Cosmc基因全外显子的检测,并分析基因突变与HSP发病的关联性,从而从基因角度探讨HSP患儿血清中IgA1铰链区O-糖基化异常的原因,并为HSP的发病机理研究提供可能。
1 资料与方法 1.1 研究对象选取2014年3月至2015年12月在上海儿童医学中心风湿科专科门诊就诊的84例HSP患儿为研究对象,其中男45例,女39例;年龄2~15岁,平均年龄8.0±2.9岁。研究对象入选标准:
(1) 年龄<18岁。(2)符合中华医学会儿科学分会免疫学组儿童过敏性紫癜循证诊治建议(2013)[10]中的HSP诊断标准,即可触性皮疹(必要条件)伴如下任何1条:①弥漫性腹痛;②任何部位活检显示IgA沉积;③关节炎/关节痛;④肾脏受损表现(血尿和/或蛋白尿)。(3)排除合并其他血管炎的患儿。依据HSPN的诊断标准,将84例HSP患儿分为HSPN组(n=14),男8例,女6例,平均年龄10.1±2.0岁;非HSPN组(n=70),男37例,女33例,平均年龄7.6±2.9岁。HSPN的诊断依据参照中华医学会儿科学分会肾脏病学组儿童常见肾脏疾病诊治指南中紫癜性肾炎诊断标准[11]。
另选取同期在我院接受体检的健康儿童58例作为对照组,其中男38例,女20例,平均年龄7.6±4.5岁。对照组儿童的入选标准:(1)年龄2~17岁;(2)在我院接受健康体检,且无异常发现;(3)排除曾有严重疾病或免疫性疾病史者。HSP组与对照组儿童年龄、性别差异均无统计学意义,具有可比性。
本研究通过上海交通大学医学院附属上海儿童医学中心医学伦理委员会批准并获得入组儿童家长的知情同意。
1.2 试剂TRIzol 试剂、 Pfx DNA polymerase、 10×Pfx Amplication Buffer、10×Enhancer Buffer、MgSO4购自美国Invitrogen公司,dNTP、ddH2O购自日本Takara公司,无水乙醇、柠檬酸钠、异丙醇、氯仿、乙醇等均购自上海生工生物有限公司,Lymphoprep™(人淋巴细胞分离液)购自加拿大Stem Cell Technologies公司。
1.3 引物设计与合成Cosmc基因位于X染色体上,其参考序列见于国家生物技术信息中心(National Center of Biotechnology Information,NCBI)。使用 Primer Premier 5.0软件设计2对引物,由上海生工生物工程有限公司合成,引物序列见表 1。
| 表 1 Touch-down PCR 引物序列 |
1.4 标本采集及处理
采集两组儿童清晨空腹静脉血5 mL,置于含有EDTA的抗凝管中摇匀、编号并登记,然后将5 mL EDTA抗凝的血标本,经900转/min离心15 min,最上层为富含血小板的血浆(platelet rich plasma,PRP)。将PRP溶液在室温下经4 000转/min离心5 min去血小板,得上清,分装至冻存管内,于-80℃冻存直至使用。下层的细胞加淋巴细胞分离液分离得外周血单个核细胞(PBMC),加1 mL冻存液冻存于-80℃直至使用。
1.5 基因组DNA的提取TRIzol法提取PBMC中的基因组DNA。取一管上述冻存的PBMC细胞,于37℃水浴锅快速融化,经900转/min离心去上清。每5~10×106个细胞加1 mL TRIzol试剂,反复吸打,按照TRIzol试剂的说明书进行操作。提取的DNA用NanoDrop 2000C测其浓度和纯度(A260/280和A260/230)。DNA产物置于-20℃冰箱保存。
1.6 Touch-down PCR扩增反应PCR扩增反应的总体系为25 μL,含模板2 μL、10×amplication buffer 5 μL、10×enhancer buffer 2.5 μL、dNTP 3 μL、ddH2O 10 μL、上下游引物各0.75 μL、Pfx DNA polymerase 0.5 μL、MgMgSO4 0.5 μL。
Cosmc外显子区域分两段进行PCR。第一段PCR产物大小为816 bp,第二段PCR产物大小为680 bp。第一片段的PCR反应条件为:94℃预变性3 min;94℃ 变性30 s,65℃ 退火30 s(每个循环降1℃),72℃延伸1 min,共16个循环;94℃变性 30 s,50℃ 退火30 s,72℃ 延伸1 min,共20个循环;最后72℃再延伸10 min。第2片段的PCR反应条件为:94℃预变性3 min;94℃变性30 s,62℃退火30 s(每个循环降1℃),72℃延伸45 s,共13个循环;94℃变性30 s,50℃退火30 s,72℃延伸45 s,共20个循环;最后72℃再延伸10 min。
将PCR扩增产物5 μL加入预先加有GelRed染料的1%琼脂糖凝胶中电泳30 min(电压120 V),在紫外投射自动成像分析仪上成像。将有条带的PCR电泳产物送华大基因有限公司进行测序分析,并使用Chromas软件对测序结果进行分析。
1.7 统计学分析采用SPSS 19.0统计软件对数据做统计学分析,计数资料采用百分率(%)表示,两组间比较用χ2检验;并对女性基因型进行群体遗传学Hardy-Weinberg平衡检验。P<0.05为差异有统计学意义。
2 结果 2.1 Cosmc基因外显子突变位点检测结果测序结果显示HSP患儿Cosmc基因存在两个位点的突变,分别为c.393T>A和c.72A>G。
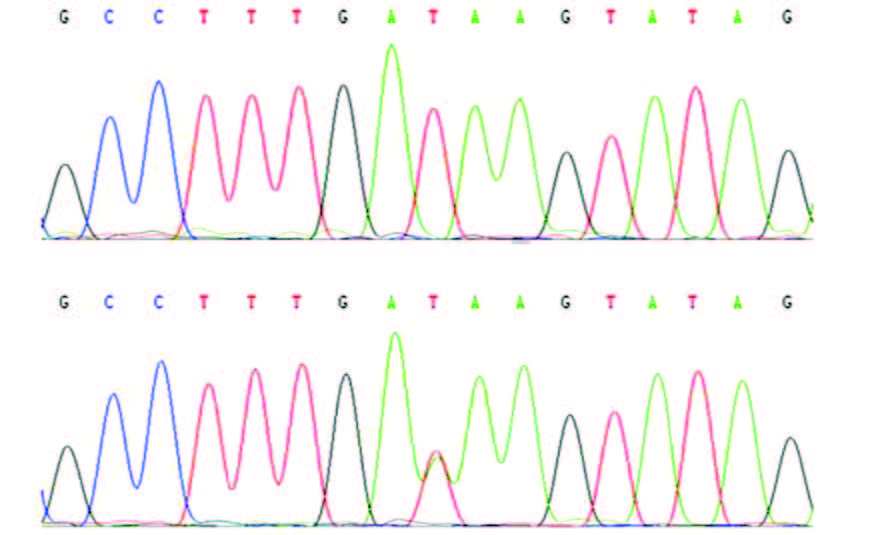
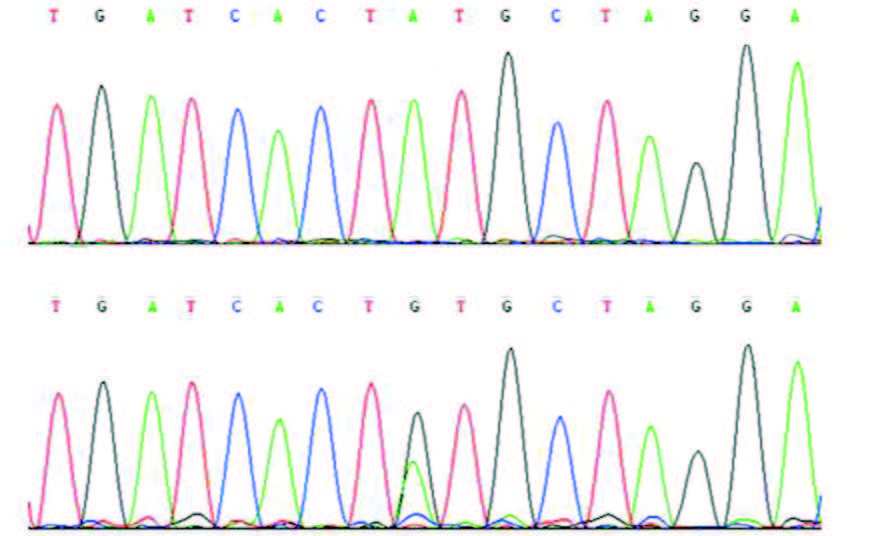
2.2 Cosmc基因突变位点测序分型Hardy-Weinberg平衡检验Cosmc基因c.393T>A位点具有T、A双态性,测序分型显示该位点有2种基因型,即TT型、TA型(图 1)。c.72G>A位点具有G、A双态性,测序分型显示该位点也有2种基因型,即为GG型、GA型(图 2)。Hardy-Weinberg平衡检验显示,实验组和对照组TT、TA基因型和GG、GA基因型分布均符合遗传平衡(P>0.05),表示所测位点的基因频率、基因型频率达到传递平衡,样本具有群体代表性。
|
图 1 Cosmc 基因c.393T>A 位点测序 上图为TT基因型(野生型);下图为TA 基因型(杂合型)。箭头表示检测到的突变位点。 |
|
图 2 Cosmc 基因c.72A>G 位点测序 上图为AA 基因型(野生型);下图为AG 基因型(杂合型)。箭头表示检测到的突变位点。 |
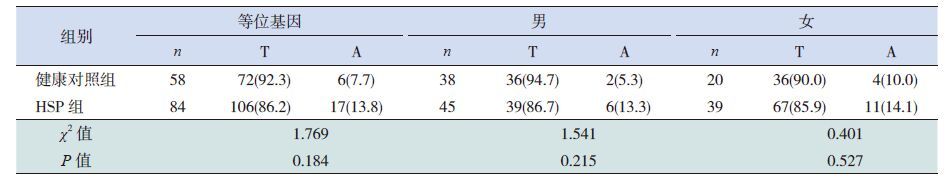
2.3 Cosmc基因c.393T>A突变位点的等位基因频率与HSP的易感关联性分析
该位点等位基因频率在健康对照组和HSP组间差异无统计学意义,且不受性别影响(P>0.05)(表 2)。HSP患儿存在c.393T>A位点突变,男性患儿均为纯合突变;女性患儿均为杂合突变,无纯合突变,且该位点不同基因型(TT/TA)在HPS组(28/11)及健康对照组(16/4)之间比较差异亦无统计学意义(χ2=0.469,P=0.493)。
| 表 2 c. 393T>A 等位基因频率的分布 [ 例(%)] |
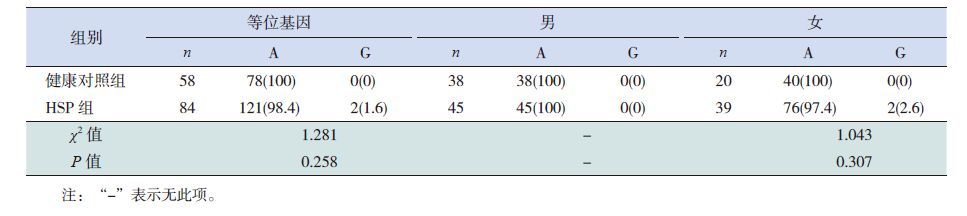
2.4 Cosmc基因c.72A>G突变位点的等位基因频率与HSP的易感关联性分析
由表 3可知,健康对照组无c.72A>G的突变,HSP组则存在2例突变,且均为女性患者,为杂合突变。表 3显示该位点等位基因频率在健康对照组与HSP组间差异无统计学意义,且不受性别影响(P>0.05)。女性患儿不同基因型(AA/AG)在非HSPN组(32/1)与HSPN组(5/1)之间比较差异无统计学意义(χ2=1.94,P=0.164)。
| 表 3 c.72 A>G 等位基因频率的分布 [ 例(%)] |
3 讨论
HSP是儿童时期常见的小血管炎,其发病机制目前尚未完全阐明。C1GALT1为O-糖基化的关键酶,而Cosmc作为C1GALT1的特异性分子伴侣,为IgA1铰链区β1,3半乳糖基化所必不可少。当Cosmc发生异常时,可导致IgA1糖基化异常,从而可能导致HSP的发生。因此,我们进行该项病例对照研究验证上述假设是否成立。本研究中,我们对84例HSP患儿和58例健康儿童进行Cosmc基因的全外显子测序。结果显示,其中的一个突变位点为c.393T>A。对该突变位点与HSP的关联性进行分析显示不同等位基因在健康对照组与HSP组之间的差异无统计学意义。考虑到Cosmc基因位于X染色体上,性别可能会导致结果的不同,我们比较了女性患者不同基因型在健康对照组与非HSPN组、HSPN组之间的差异,但结果显示差异无统计学意义。而之前的一个研究显示IgAN患者Cosmc基因的整个编码区仅存在一个位点的突变,即c.393T>A,c.393T>A的最小等位基因频率(MAF)仅为0.069,且该基因突变与IgAN的易感性无关[12]。这一结果与本研究结果相一致。可能的原因是Cosmc基因位于X染色体上,因此基因多态性对疾病的影响可能会受到非活化的性染色体的限制。即使是阳性的关联结果,也不能代表HSP组和对照组之间真正的关联性。此外,在关于Tn综合征[9]的研究中显示c.393T>A的突变并未引起C1GALT1活性的改变,也就是说该位点可能并非是引起疾病发生的关键位点。
本研究中检测到的另一个突变位点为c.72A>G,而且仅存在于2名女性HSP患者中,关联性分析显示不同等位基因在HSP组与健康对照组之间的差异无统计学意义,且女性患者中不同基因型在非HSPN组和HSPN组中分布的差异亦无统计学意义。由于该位点在之前的研究中并未发现过,而我们的实验数据呈阴性结果,可能与实验样本数量较少有关,也可能是非活性的性染色体抑制其对疾病的影响所致。因此,以上结果均表明Cosmc外显子区域内基因多态性可能与HSP的易感性并无关联。如果Cosmc基因可影响自身免疫性疾病的发生,则必然是通过除外显子区域突变外的其他途径而实现的。最新的一项研究认为Cosmc基因启动子区域的DNA高甲基化才是IgAN中Cosmc mRNA表达降低的关键[13]。我们推测Cosmc基因启动子区域或非编码区的基因突变可能与疾病的发生有关。
因此,在扩大样本量的同时,检测HSP患者Cosmc基因启动子区域或非编码区内是否存在突变将成为我们下一步的工作重点,从而为HSP及涉及到O-糖基化的其他疾病的发病机制研究提供基础。
| [1] | Chen JY, Mao JH. Henoch-Schönlein purpura nephritis in children: incidence, pathogenesis and management[J]. World J Pediatr,2015, 11 (1) :29–34 . |
| [2] | Lau KK, Wyatt RJ, Moldoveanu Z, et al. Serum levels of galactose-deficient IgA in children with IgA nephropathy and Henoch-Schönlein purpura[J]. Pediatr Nephrol,2007, 22 (12) :2067–2072 . |
| [3] | Trnka P. Henoch-Schönlein purpura in children[J]. J Paediatr Child Health,2013, 49 (12) :995–1003 . |
| [4] | Ju T, Wang Y, Aryal RP, et al. Tn and sialyl-Tn antigens, aberrant O-glycomics as human disease markers[J]. Proteomics Clin Appl,2013, 7 (9-10) :618–631 . |
| [5] | Ju T, Cummings RD. A unique molecular chaperone Cosmc required for activity of the mammalian core 1 beta 3-galactosyltransferase[J]. Proc Natl Acad Sci U S A,2002, 99 (26) :16613–16618 . |
| [6] | Aryal RP, Ju T, Cummings RD. Identification of a novel protein binding motif within the T-synthase for the molecular chaperone Cosmc[J]. J Biol Chem,2014, 289 (17) :11630–11641 . |
| [7] | Kamei K, Ogura M, Sato M, et al. Evolution of IgA nephropathy into anaphylactoid purpura in six cases-further evidence that IgA nephropathy and Henoch-Sch?nlein purpura nephritis share common pathogenesis[J]. Pediatr Nephrol,2016, 31 (5) :779–785 . |
| [8] | Qin W, Zhou Q, Yang LC, et al. Peripheral B lymphocyte beta1,3-galactosyltransferase and chaperone expression in immunoglobulin A nephropathy[J]. J Intern Med,2005, 258 (5) :467–477 . |
| [9] | Ju T, Cummings RD. Protein glycosylation: chaperone mutation in Tn syndrome[J]. Nature,2005, 437 (7063) :1252. |
| [10] | 中华医学会儿科学分会免疫学组, 《中华儿科杂志》编辑委员会. 儿童过敏性紫癜循证诊治建议[J]. 中华儿科杂志,2013,51 (7) :502–506. |
| [11] | 中华医学会儿科学分会肾脏病学组. 儿童常见肾脏疾病诊治 循证指南( 二): 紫癜性肾炎的诊治循证指南( 试行)[J]. 中华 儿科杂志,2009,47 (12) :911–913. |
| [12] | Li GS, Zhang H, Lv JC, et al. Variants of C1GALT1 gene are associated with the genetic susceptibility to IgA nephropathy[J]. Kidney Int,2007, 71 (5) :448–453 . |
| [13] | Sun Q, Zhang J, Zhou N, et al. DNA methylation in Cosmc promoter region and aberrantly glycosylated IgA1 associated with pediatric IgA nephropathy[J]. PLoS One,2015, 10 (2) :e0112305. |
 2016, Vol. 18
2016, Vol. 18