2. 重庆医科大学附属深圳市儿童医院儿科研究所, 广东 深圳 518038 ;
3. 重庆医科大学附属深圳市儿童医院检验科, 广东 深圳 518038 ;
4. 重庆医科大学附属儿童医院血液肿瘤科,重庆 400014
葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)缺乏症是最常见的一种遗传性溶血性红细胞酶缺陷病,全球约4亿人受累[1]。已发现近200种基因突变[2],绝大多数为编码区单个碱基突变,个别研究报道存在内含子剪切位点突变,中国人群也已发现30余种[3-5],均未见其功能影响的研究[6]。文献报道的多种基因突变检测方法对于部分G6PD缺乏症患者均存在未能检出任何突变的情况[4-8]。推测其原因主要为G6PD基因组DNA长(共18 kb)、突变点多且散在分布于10余个外显子上,常见突变检测方法难以兼顾各突变位点,而全基因分析成本昂贵。基于G6PD全基因DNA测序成本高、操作难度大,本研究在国内外首次尝试利用RT-PCR结合第一代Sanger测序法对G6PD缺乏症患者基因全编码区进行检测分析,现报告如下。
1 资料与方法 1.1 研究对象收集2013年8月至2014年7月期间,深圳市儿童医院血液专科门诊及儿保科就诊的贫血查因或体检儿童195例,根据其外周静脉血测定的四氮唑蓝G6PD/6GPD 比值(改良G6PD 定量比值法试剂盒,广州市米基医疗器械有限公司生产),分为G6PD 缺乏组(比值<1.00)和对照组(比值≥ 1.00)。缺乏组130 例,男117 例、女13 例,年龄32 d 至193个月,中位年龄26个月;对照组65 例,男28 例、女37 例,年龄2个月至192个月,中位年龄28个月。本研究获得到医院医学伦理委员会批准和研究对象监护人的知情同意。
1.2 DNA、总RNA提取,cDNA获取应用QIAamp RNA Blood Mini Kit和FlexiGene DNA Kit(QIAGEN,德国)分别提取样本总RNA和DNA。1 μg总RNA采用逆转录试剂盒(TaKaRa,大连)获取cDNA,操作如下:70℃ 10 min,再冰上孵育10 min,加入Random primer 1 μL、PrimeScript Buffer 4 μL、PrimeScript Reverse Transcriptase 1 μL、Ribonuclease Inhibitor 0.5 μL、dNTP Mixture 1 μL,RNase-Free Water补至 20 μL,42℃ 60 min,90℃ 2 min。RNA冻存于-80℃,DNA、cDNA冻存于-20℃备用。
1.3 引物设计根据G6PD基因mRNA序列(NCBI号:BC000337)和DNA序列(NCBI号:L44140.1),采用软件Prime Premier 5.0设计以cDNA为模板可扩增基因全编码区的引物(上游引物:AGCGCAG-ACAGCGTCATG,下游引物:GTAGTAGCAGCAGC-GAGGG,扩增长度为1 715 bp)、测序引物(AG-GGAGGAGAT GTGGTTGGA,GCTGGAA-CCGCATCATCG,CCACCACCGCCACTTTTG);针对需验证的特定位点设计以基因组DNA为模板的PCR扩增引物(引物未列出)。
1.4 PCR直接测序以cDNA为模板,采用高GC含量扩增体系进行PCR扩增,扩增体系如下: Ex-Taq聚合酶0.4 μL,2×GC bufferⅠ25 μL,dNTP 8 μL,RNase-Free Water 13.6 μL,上、下游引物各1 μL,cDNA样本1 μL。扩增参数:初始变性94℃ 2 min,30循环(94℃ 30 s,59℃ 30 s,72℃ 2 min),延伸72℃ 8 min。逆转录及PCR扩增均在Tprofessional Std Gradient 96 扩增仪(Biometra,德国)上进行。扩增产物以10 g/L 琼脂糖凝胶进行电泳,电泳25 min 后,于凝胶成像系统进行分析。特异性产物送英潍捷基(上海)有限公司测序。对女性样本中RT-PCR测序为纯合突变样本者,设计相应引物对其基因组DNA扩增并测序验证。
1.5 统计学分析采用SPSS 17.0软件进行数据处理。计数资料用百分率表示。
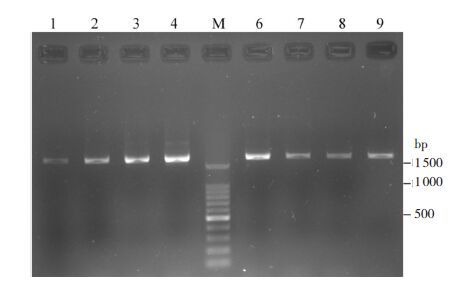
2 结果 2.1 RT-PCR及琼脂糖电泳检测采用本实验优选引物及针对GC含量较高的PCR扩增体系,可通过一次PCR对G6PD基因cDNA全编码序列进行高效扩增,扩增片段长度约1 700 bp,与设计长度1 715 bp相符,见图 1。
|
图 1 G6PD 基因cDNA 扩增琼脂糖电泳图 泳道1~9:G6PD 缺乏患儿的代表性样本;泳道M:DNA 分子标准。 |
2.2 扩增产物测序结果
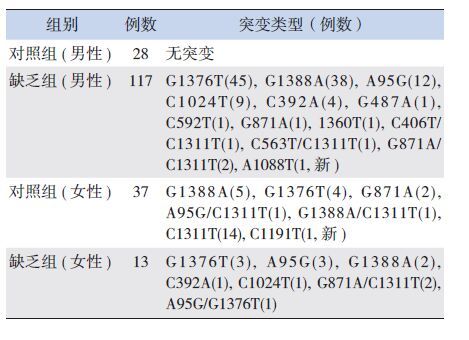
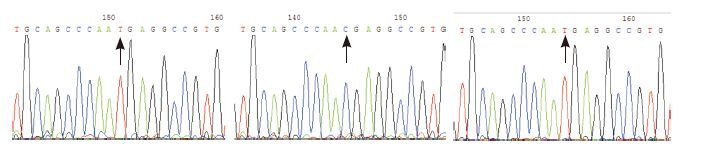
G6PD缺乏组的130例样本均检出错义突变(见表 1),共13种错义突变,其中1例男性样本检出新发现错义突变A1088T(测序结果见图 2),其G6PD/6GPD 比值(0.37)是所有标本中活性最低的。1例女性样本为少见的G1388A纯合突变,其G6PD/6GPD 比值为0.5;另1例证实为A95G/G1376T,G6PD/6GPD 比值0.58。65例对照组标本中,28例男性样本未检出任何突变;37例女性标本中除有14例为单纯C1311T多态性,1例为国内外尚未报道的纯合型同义突变C1191T(测序结果见图 3)外,另有13例存在杂合型错义突变,显示女性标本在比值法筛查中存在一定的G6PD缺乏症(携带者)的漏检(13/37,35%)。
| 表 1 G6PD 缺乏组和对照组检出的突变类型 |

|
图 2 DNA 测序图 左图箭头所示为A1088T 位点,右图箭头所示为正常野生型1088A 位点。 |
|
图 3 DNA 测序图 左图箭头所示为C1191T 同义突变(RT-PCR 测序),中间图箭头所示为对照样本1191 位点,右图箭头所示C1191T 位点为纯合突变(DNA 扩增测序)。 |
3 讨论
G6PD缺乏症是最常见的X连锁不完全显性遗传性酶缺陷病,该病主要为编码区单个碱基突变导致酶活性改变。关于G6PD缺乏症分子诊断的研究,国内外有不少报道[4-8]。由于G6PD缺乏症具有高度遗传异质性,迄今已报道186种突变类型[2],且这些突变位点覆盖基因全长,除第3和13外显子外皆可见到。G6PD基因组DNA全长18 kb,含13个外显子,因此针对全G6PD基因组DNA的测序成本太高,而且要进行多次PCR扩增。由于G6PD基因结构及其突变特点,使得针对特定位点的等位基因特异性扩增、错配引物限制性酶切、Mass-array基因芯片技术,或者针对全基因区域分段进行分析的PCR-变性梯度凝胶电泳、变性高效液相色谱、高分辨率熔解曲线分析等方法[4-10],由于灵敏度以及实验繁琐、同时需兼顾成本等原因,其基因突变检出率均难以达到100%。
本研究通过优化引物和扩增条件,通过一次普通RT-PCR成功扩增出G6PD基因全编码序列,结合测序可检测全编码区上所有已知和未知突变。研究结果也证实,对于G6PD/6GPD比值法诊断出的G6PD缺乏患儿用本方法均检出到编码区的有效错义突变,检出率达100%。本方法共检出13种错义突变(不包括双杂合突变等),其中包括1例新的错义突变,另外还有1例新的纯合型同义突变(对照组),充分证明了本方法的有效性。RT-PCR扩增分析是一项发展已久的分子生物学技术,而基因测序则是基因突变检测的金标准。RT-PCR结合基因测序法进行基因诊断国内外早已有报道[11-12],但应用于G6PD基因突变检测分析尚未见报道。本课题组虽尝试过采用本方法对G6PD基因突变进行检测分析,但没有高效率地扩增出全长片段,无法保证大多数样本能直接测序。本研究通过对G6PD基因的mRNA全长序列复杂度的全面分析,发现该序列存在多个高GC含量区域,为此我们采用针对高GC含量的PCR扩增体系,对设计的多对引物进行尝试,最后优选出采用高GC含量PCR扩增体系,高效扩增出全长cDNA片段的引物对。
本研究还在37例女性对照组标本中检出13例样本有杂合型错义突变,且突变类型与缺乏组女性类似,这也意味着常规G6PD/6GPD比值法的漏检率高达35%(13/37)。与胡淑芬等采用的从G6PD缺乏男婴追溯其母亲酶缺陷报道的漏检率33.3%基本一致[13]。这么高的漏检率,究其原因,一是本研究收集的样本主要来自血液专科门诊及儿保科就诊的贫血查因或体检儿童,对照组可能包含较大比例的携带者(突变杂合子),同一种杂合突变在个体中表达的相对量不同,对活性的影响也不同,而根据酶学检测将活性比值<1的归属于G6PD缺乏,>1的归属于G6PD活性正常,因此有可能将G6PD缺乏症携带者判断为G6PD活性正常;二是根据酶学检测的G6PD/6GPD比值受贫血、感染等因素的影响,可能存在误诊;三是本方法的突变检出率较高,从而携带者的检出率得到提高。
G6PD缺乏症在广东、广西、四川、贵州、云南、海南等地区的发病率高达4%~11%[6-7],而临床中杂合子检测一直是G6PD缺乏症诊断的一大难题。因此,我们认为本方法对于常规方法可能漏检的弥补及携带者的检出具有重要的参考意义。尤其是携带者的检出对于优生优育具有重要意义,因为其男性子代可能存在G6PD严重缺乏的风险,而携带者与G6PD缺乏症男性的男女子代均有患G6PD严重缺乏的风险。
本方法由于只针对cDNA编码区突变进行分析,不能对涉及内含子的剪切突变等进行检出,理论检出率应该不足100%。但可能由于剪切突变发生频率低,而且这些位点也没有被证实能导致G6PD缺乏,导致本研究没有此类标本或者有但没有检出,如果是后者则更为支持本方法的应用价值。当然,如果遇到存在酶降低而未发现基因突变的样本,必要时可通过检测外显子内含子连接区以及内含子区域进行排除[14]。另外,由于表现度的原因,本方法检测到的纯合突变理论上需结合DNA-PCR测序以排除由于表现度的原因导致正常等位基因型被漏检,但这不影响该标本作为G6PD缺乏症的检出。本研究的基因组DNA测序确证结果也与本方法基本一致,比如少见的G1388A纯合突变的检出及确证。另外,本研究以mRNA逆录的cDNA为模板,比提取DNA相对复杂,但现阶段提取RNA已非难事,而且考虑到G6PD作为X连锁基因,由于女性存在X染色体随机失活导致表现度不一的原因,G6PD基因的mRNA更能体现突变基因与临床症状的对应关系。
综上所述,本研究发展的RT-PCR测序法,通过1次普通RT-PCR扩增全编码序列、3个普通第一代Sanger测序反应,就可检出G6PD基因几乎全部突变位点(现已达近200种),性价比高,具有较大的临床应用价值。特别是对于常规G6PD/G6PD比值法检测为临界值(比值为1.0左右)而临床可疑的患者,本方法将为其提供简单、快捷、相对可靠的诊断依据。因此,该方法值得进一步扩大样本数量以推广研究应用,从而为G6PD缺乏症的临床诊断提供新参考。
| [1] | Cappellini MD, Fiorelli G. Glucose-6-phosphate dehydrogenase deficiency[J]. Lancet,2008, 371 (9606) :64–74 . |
| [2] | Minucci A, Moradkhani K, Hwang MJ, et al. Glucose-6- phosphate dehydrogenase(G6PD) mutations database: review of the "old" and update of the new mutations[J]. Blood Cells MolDis,2012, 48 (3) :154–165 . |
| [3] | 陈瑶, 苏跃青, 周进福, 等. Mass-array 芯片技术在葡萄糖-6- 磷酸脱氢酶基因突变位点检测中的应用[J]. 中华检验医学杂志,2015,38 (12) :822–826. |
| [4] | 严提珍, 钟青燕, 唐宁, 等. 多色探针荧光PCR 熔解曲线法在G6PD 基因突变检测中的临床应用评价[J]. 中华医学遗传学杂志,2014,31 (2) :156–162. |
| [5] | 林芬, 杨辉, 杨立业. 我国葡萄糖-6- 磷酸脱氢酶缺乏症的分布特征和基因突变[J]. 分子诊断与治疗杂志,2016,8 (2) :73–77. |
| [6] | Liu WL, Li F, He ZX, et al. Glucose-6-phosphate dehydrogenase qingzhen: Identification of a novel splice mutation (IVS5-1 G>A)[J]. Pediatr Blood Cancer,2012, 58 (5) :825–826 . |
| [7] | Jiang W, Yu G, Liu P, et al. Structure and function of glucose- 6-phosphate dehydrogenase-deficient variants in Chinese population[J]. Hum Genet,2006, 119 (5) :463–478 . |
| [8] | Yan JB, Xu HP, Xiong C, et al. Rapid and reliable detection of glucose-6-phosphate dehydrogenase (G6PD) gene mutations in Han Chinese using high-resolution melting analysis[J]. J Mol Diagn,2010, 12 (3) :305–311 . |
| [9] | Tseng CP, Huang CL, Chong KY, et al. Rapid detection of glucose-6-phosphate dehydrogenase gene mutations by denaturing high-performance liquid chromatography[J]. Clin Biochem,2005, 38 (11) :973–980 . |
| [10] | 陈小文, 岳丽杰, 李长钢, 等. 逆转录-PCR- 变性梯度凝胶电泳法检测葡萄糖-6- 磷酸脱氢酶缺乏症[J]. 中华检验医学杂志,2007,30 (9) :1048–1051. |
| [11] | Myeroff LL, He H, Fink SP, et al. Mutation detection in the TGF-beta receptors and smad genes: RT-PCR and sequencing[J]. Methods Mol Biol,2000, 142 :139–147 . |
| [12] | Liu TC, Yen JS, Shen JS. Rapid molecular diagnosis of hemoglobin variants by RT-PCR of reticulocyte mRNA and direct sequencing[J]. Hemoglobin,1992, 16 (5) :379–388 . |
| [13] | 胡淑芬, 罗韬. 从G6PD缺乏男婴追溯其母亲酶缺陷的漏检情况[J]. 中国优生与遗传杂志,2013,21 (5) :78–79. |
| [14] | Amini F, Ismail E. 3’-UTR variations and G6PD deficiency[J]. J Hum Genet,2013, 58 (4) :189–194 . |
 2016, Vol. 18
2016, Vol. 18