随着新生儿重症监护技术的进步,尤其是新生儿复苏、呼吸支持的发展,极低出生体重儿(出生体重<1 500 g)和超早早产儿(出生胎龄<28周)的存活率得以提高;然而,他们的神经系统预后并未明显改善[1]。大脑的主要发育阶段是胎儿期23~32周,这一阶段也正是少突细胞发育的关键时期[2]。有报导表明,约40%的超早早产儿可能有神经系统缺陷,影响运动及感知功能。不仅缺氧可能引起早产儿脑损伤,高氧也可导致脑损伤。一些报道表明高氧是导致神经细胞发育阶段凋亡的重要原因[3]。已经有证据表明,支气管肺发育不良或视网膜病的早产儿有较高的神经系统损伤风险[4]。
配对免疫球蛋白样受体B(paired immunoglobin like receptor B,PirB)是髓鞘抑制因子的另一个功能性受体。已有动物实验表明,抑制PirB可以促进损伤脊髓的再生[5]。我们最近的动物实验也证明缺氧脑损伤中PirB的表达增加,并且PirB的增加可能会抑制神经再生[6]。
母孕期17-β雌二醇(E2)水平几乎增加了100倍,导致胎儿体内的雌激素水平也增加。E2是神经保护剂,一些缺氧缺血和毒性实验模型已经证实了E2的神经保护作用。E2在神经系统发育和功能上,尤其是在脑室周围前体细胞分化过程中发挥着重要的作用,在发育的不同阶段影响细胞凋亡[7-10]。但出生后24 h内,新生儿体内的E2水平迅速下降,早产儿的下降则出现得更早,这可能使E2的神经保护作用不足[11-12]。
凋亡是高氧所致脑损伤的重要机制[12],脑室周围白质软化(periventricular leukomalacia,PVL)是早产儿脑损伤的主要形式,而少突前体细胞(oligodendrocyte precursor cells,OPCs)是PVL的主要靶细胞。Riddle等[13]在胎羊脑损伤模型的研究发现,白质损伤的严重程度与OPCs数目密切相关。但高氧是否导致OPCs凋亡,高氧时OPCs的PirB表达情况,以及E2与OPCs凋亡之间的相互关系尚未阐明。
1 材料与方法 1.1 动物20只2 d龄SD大鼠,购自四川大学实验动物中心。动物的喂养、保存及手术均遵守国际动物保护法和四川大学伦理委员会规定,符合动物伦理学标准。
1.2 少突前体细胞的原代培养参考Chen等[14]的方法分离原代OPCs。SD大鼠在乙醚(Sigma-Aldrich,USA)深度麻醉下断头处死,剪开颅骨、剥除脑膜、分离出皮质,冰预冷的Hank's(Gibco,USA)缓冲液漂洗两次,37℃、0.01% 胰蛋白酶(碧云天,中国南通) 和 DNase(碧云天,中国南通)孵化15 min,将组织磨碎、40 μm无菌过滤器过滤细胞,将细胞置于含有DMEM 和20% FBS(Gibco,USA)的多D赖氨酸包被的T75培养瓶中培养。第10天见胶质细胞长出,其表面覆盖一层OPCs。将培养瓶置于摇床,200转/min振荡1 h,分离出死亡细胞和小神经胶质细胞;换液,200转/min振荡过夜,分离OPCs。收集OPCs并将其植于不含血浆的DMEM中培养(多D赖氨酸包被培养皿),同时加入E2及生长因子(PDGF-AA和bFGF)。诱导分化后移除生长因子,加入神经营养因子(CNTF)。
1.3 药物处理在OPCs培养基中加入 E2(终浓度为10-6、10-7、10-8、10-9 、10-10 mol/L),0 h、8 h、16 h、24 h、48 h后收集细胞,使用逆转录定量酶联反应(RT-qPCR)检测PirB mRNA表达。E2以PirB mRNA 水平最低时作为最佳浓度。
1.4 PirB小分子干扰RNA(siRNA)和转染PirB siRNA(5'-GTGTTCAGTTGTTCCCTTGACATGA-3')和阴性对照siRNA购于上海吉马生物有限公司(上海,中国)。根据说明书,用脂质体2 000(Invitrogen,USA)融合50%细胞并转染100 nmol/L siRNA。
1.5 实验分组实验分为8组:(1)常氧加阴性siRNA组:细胞在常氧情况下转染阴性对照siRNA,培养24 h,然后继续常氧下培养24 h;(2)高氧加阴性siRNA组:细胞首先在常氧下转染阴性siRNA,培养24 h,继而在高氧下培养24 h;(3)常氧加PirB siRNA组:常氧下PirB siRNA转染细胞并培养24 h,然后常氧下继续培养24 h;(4)高氧加PirB siRNA组:常氧下PirB siRNA转染细胞并培养24 h,然后高氧下培养24 h;(5)常氧加E2组:细胞中加入E2,常氧培养48 h;(6)高氧加E2组:细胞在常氧下加入E2,培养24 h,然后高氧下继续培养24 h;(7)常氧加生理盐水组:细胞在常氧下加入与E2等体积的生理盐水,培养48 h;(8)高氧加生理盐水组:细胞在常氧情况下加入与E2等体积的生理盐水,培养24 h后改为高氧培养24 h。每组均 5 个复孔。
高氧培养是指细胞在37℃,80% O2,5% CO2和 15% N2中孵化;常氧培养即细胞在37℃,<21% O2和 5% CO2中孵化。E2组的E2终浓度为10-7 mol/L。
1.6 RT-qPCR检测PirB mRNA水平每组取6×105个细胞,离心,PBS洗两次,冰Trizol(Invitrogen,USA)裂解细胞,提取RNA,使用PrimeScript RT逆转录试剂盒(Takara生物公司,中国大连)将RNA逆转录为cDNA。使用Mx3000P实时PCR系统(Stratagene,USA)和SYBR Premix Ex TaqII PCR试剂盒(Takara Bio,Inc.)将相同量的cDNA作为RT-qPCR的模板检测PirB mRNA表达。基因表达的褶皱感应使用2-ΔΔCt 方法计算。
1.7 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法分析OPCs活性各组OPCs细胞孵化48 h后,每个孔内加入20 μL(5 mg/mL)MTT,继续孵化4 h,继而200 μL DMSO加入每孔,4 h后读取器(multiscan MK3,USA)读取570 nm波长的OD值,并计算细胞存活率。
1.8 流式细胞仪分析OPCs的凋亡OPCs种于6孔板(106 /孔),冰PBS洗两次,缓冲液(南京凯基公司)重新调整细胞浓度至104 /孔,加入10 μL荧光标记的膜联蛋白-V和10 μL 3 mmol/L的碘化丙啶(PI),15 min室温孵化,暗室内洗涤后行流式细胞仪(BD Accuri™ C6,USA)分析。
1.9 Western blot检测PirB蛋白表达在RIPA分析缓冲液中对细胞进行溶解,并且加入酶抑制剂处理5 s,12 000转/min、4℃离心20 min,取上清-80℃保存待用。溶菌产物蛋白(50~60 μg总蛋白)在10% SDS-PAGE(碧云天,中国南通)上进行电泳分离,转膜(Pall,USA),用5%脱脂干奶粉在TBS-T中37℃封闭膜1 h,再加入兔抗PirB多克隆抗体(1 : 1 000)4oC孵化过夜。TBS-T洗膜3次,用辣根过氧化物酶标记的羊抗兔IgG(1 : 20 000)(博士得生物公司,中国武汉)37℃孵化1 h,TBS-T洗膜3次。使用信号底物(Thermo Fisher Scientific,USA)观察蛋白条带,用Pro-Plus 6.0 软件对膜照相后的胶片进行扫描和密度定量分析。蛋白表达结果用目标蛋白/参考蛋白比值表示。
1.10 统计学分析使用SPSS 16.0统计软件进行数据处理。计量资料用均数±标准差表示,各组间的比较采用t检验。P<0.05 为差异有统计学意义。
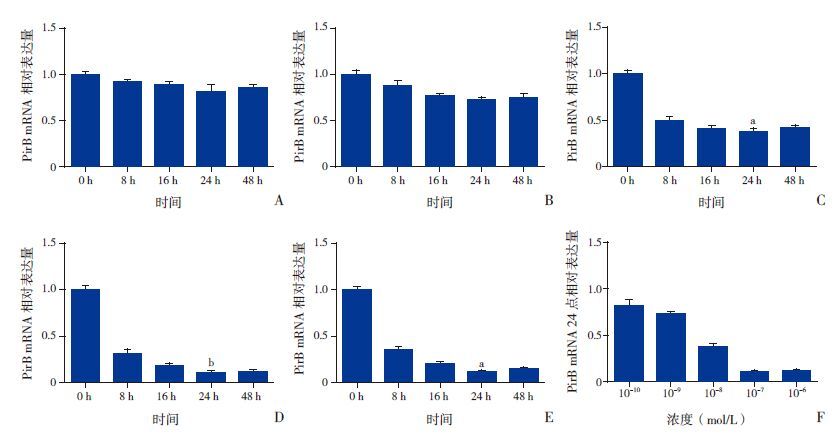
2 结果 2.1 17β-雌二醇对少突前体细胞的抑制作用E2浓度为10-7 mol/L、孵化24 h的 PirB mRNA表达最低,见图 1。因此,以10-7 mol/L作为E2的最佳浓度,24 h作为最佳处理时间。
|
图 1 少突前体细胞在雌二醇(E2)不同浓度、不同时间作用下的配对免疫球蛋白(PirB mRNA)相对表达(n=5) A~E:不同浓度E2(10-10,10-9,10-8,10-7,10-6 mol/L)处理后的PirB mRNA表达。a示与0 h、8 h、16 h、48 h比,P<0.05;b示与0 h、8 h、16 h、48 h比,P<0.01。F:不同浓度E2作用24 h后的PirB mRNA相对表达量。a示与10-10,10-9 mol/L比,P<0.05;b示与10-10,10-9,10-8,10-6 mol/L比,P<0.01。 |
2.2 RT-PCR和 Western blot检测PirB siRNA转染后的PirB表达
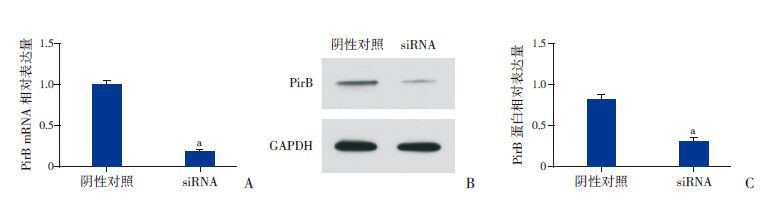
PirB siRNA 组的PirB mRNA 明显低于阴性对照组(P<0.05),见图 2A;PirB 蛋白表达量(165±5)明显低于阴性对照组(661±13),差异有统计学意义(P<0.05),见图 2B、C。
|
图 2 RT-PCR和Western blot检测PirB siRNA转染后的PirB表达(n=5) A:PirB mRNA 相对表达量。B、C:PirB 蛋白表达。a示与阴性对照相比,P<0.05。 |
2.3 各组少突前体细胞活性比较
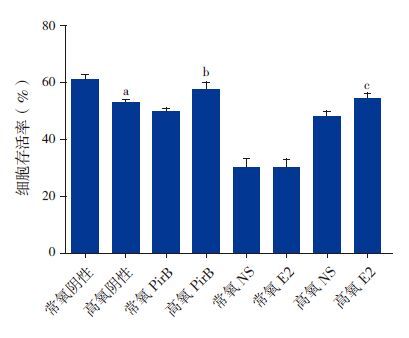
高氧阴性组的细胞存活率低于常氧阴性组(P<0.05),高氧E2组细胞存活率高于高氧生理盐水组(P<0.05);高氧PirB siRNA 组的细胞存活率高于高氧阴性siRNA组(P<0.05)。见图 3。
|
图 3 各组少突前体细胞存活率(n=5) a示与常氧阴性组比,P<0.05;b示与高氧阴性组比,P<0.05;c示与高氧生理盐水组比,P<0.05。 |
2.4 流式细胞术检测细胞凋亡率
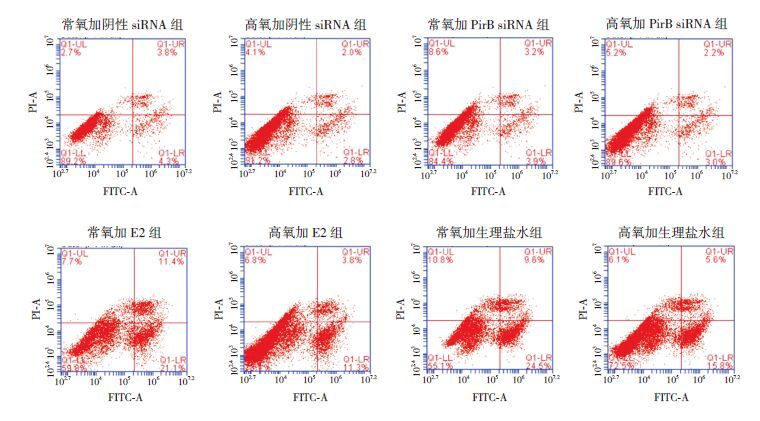
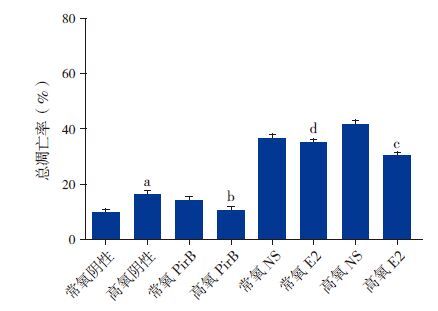
高氧阴性siRNA组的总凋亡率比常氧阴性siRNA组增加(P<0.05),高氧PirB siRNA组的总凋亡率低于高氧阴性siRNA组(P<0.05);高氧加E2组的总凋亡率低于高氧加生理盐水组(P<0.05)。见图 4~5。
|
图 4 流式细胞术检测各组少突前体细胞凋亡 存活细胞:阴性染色,左下区;早期凋亡细胞:膜联蛋白-V阳性和碘化丙啶阴性,右下区间;细胞凋亡晚期阶段:膜联蛋白-V和碘化丙啶阳性,右上区间。 |
|
图 5 各组少突前体细胞凋亡率比较 a示与常氧阴性组比,P<0.05;b示与高氧阴性组比,P<0.05;c示与高氧NS组比,P<0.05;d示与常氧NS组比,P<0.05。 |
3 讨论
随着新生儿重症监护技术的提高,早产儿存活率逐渐增高,但是极低出生体重儿和超早早产儿在学龄期发生神经发育损伤仍然较为普遍[15]。目前对于早产儿如此高的神经发育损伤(neurodevelopmental impairment,NDI)发生率原因尚不十分清楚,但是早产儿在NICU常常高浓度吸氧,这对于肺和视网膜的损伤已经十分明确了[16, 17, 18],而肺发育损伤(支气管肺发育不良,bronchopulmonary dysplasia,BPD)或视网膜发育异常(早产儿视网膜病,retinopathy of prematurity,ROP)的早产儿发生NDI的危险率也常常增高[17]。近期有文献报道新生鼠高氧暴露后在成年阶段有NDI表现[19, 20]。而且临床随访同时发现很多早期高浓度吸氧的极低出生体重儿远期均有运动或行为方面的异常[21]。
研究表明高氧是导致发育期脑组织神经细胞广泛凋亡的重要原因。实验显示,高氧导致7 d龄Wistar 大鼠和C57/BL6小鼠脑组织不同区域死亡退化细胞增加,这些区域包括尾状核、前额II 和 IV层、顶部、前扣带回皮层、脑室周围白质[22]。
围生期脑损伤的神经病理学变化十分复杂,根据患儿不同胎龄和不同发育阶段,会涉及到不同部位脑灰质或白质结构的病理变化[23],脑室周围白质软化是早产儿脑损伤的主要表现形式,在脑发育的高峰期神经细胞最容易受到损伤,而人类的这一高峰期从孕中期一直延续到生后第三年,PVL损伤在人类发生的高峰期是胎龄23~32周,这一期间恰好是少突前体细胞逐渐分化成熟的阶段[24]。因此我们拟通过实验证明高氧是否会导致OPCs的凋亡以及可能的机制。本课题组前期已证实PirB这种表达于髓鞘细胞上的受体有抑制神经再生的作用[6],另外一些研究表明神经活性激素包括E2,能够保护神经元免于多种危险因素的伤害[18]。因此本研究力图探讨高氧、PirB和E2治疗与OPCs凋亡之间的关系。
本研究首先证明了高氧增加OPCs凋亡,减少其存活率,这与Miller等[22]、Sosa等[23]的实验一致。第二,PirB的表达增加了OPCs的凋亡,这也同样与本课题组之前的实验结果一致[6],表明PirB蛋白在损伤新生鼠脑组织中明显增加;第三,E2能够帮助保护高氧所致的细胞损伤。已有实验证实E2似乎特别能够保护皮层和海马神经元的缺氧损伤[10],而本研究结果进一步表明E2同时能够对高氧产生的神经细胞损伤加以保护,而且沉默PirB能够保护高氧所致的OPCs细胞损伤。
从试验结果我们推测在高氧应激损伤脑白质后,PirB水平增加可促进OPCs凋亡,根据E2能够保护高氧所致的细胞损伤,假设E2治疗可能是通过沉默PirB基因致PirB表达下调,进而减少高氧所致的OPCs凋亡,但是由于试验中没有涉及到E2治疗与PirB基因沉默之间的关系研究,因此E2治疗减少高氧所致OPCs凋亡与PirB表达之间是否有这样的关系,尚需我们进一步探讨。
| [1] | Pitcher JB, Schneider LA, Burns NR, et al. Reduced corticomotor excitability and motor skills development in children born preterm[J]. J Physiol,2012, 590 :5827–5844 . |
| [2] | Londhe VA, Sundar IK, Lopez B, et al. Hyperoxia impairs alveolar formation and induces senescence through decreased histone deacetylase activity and up-regulation of p21 in neonatal mouse lung[J]. Pediatr Res,2011, 69 (5 Pt 1) :371–377 . |
| [3] | Sifringer M, Bendix I, Börner C, et al. Prevention of neonatal oxygen-induced brain damage by reduction of intrinsic apoptosis[J]. Cell Death Dis,2012, 3 (1) :e250. |
| [4] | Teberg AJ, Pena I, Finel lo K, et al. Predict ion of neurodevelopmental outcome in infants with and without bronchopulmonary dysplasia[J]. Am J Med Sci,1991, 301 (6) :369–374 . |
| [5] | Huebner EA, Kim BG, Dufly PJ, et al. A multi-domain fragment of nogo-a protein is a potent inhibitor of cortical axon regeneration via nogo receptor-1[J]. J Biol Chem,2011, 286 (20) :18026–18036 . |
| [6] | Wang H, Xiong Y, Mu D. PirB restricts neuronal regeneration in developing rat brain following hypoxia-ischemia[J]. Mol Med Rep,2012, 6 (2) :339–344 . |
| [7] | Karki P, Smith K, Johnson J, et al. Astrocyte-derived growth factors and estrogen neuroprotection: role of transforming growth factor- α in estrogen-induced upregulation of glutamate transporters in astrocytes[J]. Mol Cell Endocrinol,2014, 389 (0) :58–64 . |
| [8] | Wang S, Wei H, Cai M, et al. Genistein attenuates brain damage induced by transcient cerebral ischemia through up-regulation of ERK activity in ovariectomized mice[J]. Int J Biol Sci,2014, 10 (4) :457–465 . |
| [9] | Merchenthaler I, Dellovade TL, Shughrue PJ. Neuroprotection by estrogen in animal models of global and focal ischemia[J]. Ann N Y Acad Sci,2003, 1007 (1) :89–100 . |
| [10] | Wang L, Andersson S, Warner M, et al. Estrogen receptor (ER) beta knockout mice reveal a role for ERβ in migration of cortical neurons in the developing brain[J]. Proc Natl Acad Sci USA,2003, 100 (2) :703–708 . |
| [11] | Ishihara Y, Fujitani N, Kawami T, et al. Suppressive effects of 17β-estradiol on tributyltin-induced neuronal injury via Akt activation and subsequent attenuation of oxidative stress[J]. Life Sci,2014, 99 (1-2) :24–30 . |
| [12] | Sifringer M, Bendix I, Börner C, et al. Prevention of neonatal oxygen-induced brain damage by reduction of intrinsic apoptosis[J]. Cell Death Dis,2012, 3 (1) :e250. |
| [13] | Riddle A, Luo NL, Manese M, et al. Spatial beterogeneity in oligodendrocyte lineage maturation and not cerebral blood flow predicts fetal ovine periventricular white matter injury[J]. J Neurosci,2006, 26 (11) :3045–3055 . |
| [14] | Chen Y, Balasubramaniyan V, Peng J, et al. Isolation and culture of rat and mouse oligodendrocyte precursor cells[J]. Nat Protoc,2007, 2 (5) :1044–1051 . |
| [15] | Vohr BR, Stephens BE, Higgins RD, et al. Are outcomes of extremely preterm infants improving? Impact of baylay assessment on outcomes[J]. J Pediatr,2012, 161 (2) :222–228 . |
| [16] | Auten RL, Mason SN, Auten KM, et al. Hyperoxia impairs postnatal alveolar epithelial development via NADPH oxidase in newborn mice[J]. Am J Physiol Lung Cell Mol Physiol,2009, 297 (1) :L134–L142 . |
| [17] | Dorfman A, Dembinska O, Chemtobet S, et al. Early manifestations of postnatal hyperoxia on the retinal structure and function of the neonatal rat[J]. Invest Ophthalmol Vis Sci,2008, 49 (1) :458–466 . |
| [18] | Londhe VA, Sundar IK, Lopez B, et al. Hyperoxia impairs alveolar formation and induces senescence through decreased histone deacetylase activity and up-regulation of p21 in neonatal mouse lung[J]. Pediatr Res,2011, 69 (5 Pt 1) :371–377 . |
| [19] | Ramani M, van Groen T, Kadish I, et al. Neurodevelopmental impairment following neonatal hyperoxia in the mouse[J]. Neurobiol Dis,2013, 50 :69–75 . |
| [20] | Vottier G, Pham H, Pansioot J, et al. Deleterious effect of hyperoxia at birth on white matter damage in the newborn rat[J]. Dev Neurosci,2011, 33 (3-4) :261–269 . |
| [21] | Prins SA, von Lindern JS, van Dijks, et al. Motor development of premature infants Born between 32 and 34 weeks[J]. Int J Pediatr, 2010; 2010. pii: 462048. |
| [22] | Miller SL, Yawno T, Alers NO, et al. Antenatal antioxidant treatment with melatonia to decrease newborn neurodevelopmental deficits and brain injury caused by fetal growth restriction[J]. J Pineal Res,2014, 56 (3) :283–294 . |
| [23] | Sosa MA, De Gasperi R, Paulino AJ, et al. Blast overpressure induces shear-related injuries in the brain of rats exposed to a mild traumatic brain injury[J]. Acta Neuropathol Commun,2013, 1 (1) :51. |
| [24] | Osterholt HC, Dannevig I, Wyckoff MH, et al. Antioxidant protects against increases in low molecular weight hyaluronan and inflammation in asphyxiated newborn pigs resuscitated with 100% oxygen[J]. PLos One,2012, 7 (6) :e38839. |
 2016, Vol. 18
2016, Vol. 18


