2. 解放军第306 医院儿科, 北京 100101
食物变态反应即食物过敏,是由食物或食物添加剂引起的免疫反应,具有异质性,仅见于过敏体质人群。近几年来,食物过敏的发病呈上升趋势,正威胁着人类的健康与正常生活。儿童期是食物过敏的易感年龄,我国一项研究发现3~12岁儿童自报过敏发病率可高达8.4%[1],其症状轻重不一,随着年龄增长,部分患儿可以自然免疫耐受,少部分高敏体质的儿童持续过敏,可出现营养和生长发育问题,甚至突发急性哮喘、喉梗阻以及过敏性休克等危及生命的严重反应。广东一调查显示食物过敏是儿童出现过敏性哮喘的一项独立危险因素[2]。因此,食物过敏的防治针对这一部分特殊人群显得尤为重要。
脂肪间充质干细胞(adipose derived stem cells,ADSC)是来源于脂肪的具有多向分化潜能的成体干细胞,在体外可向多种细胞分化,2001年最先由Zuk等[3]分离获得,近年研究提示间充质干细胞具有独特的免疫调节作用和低免疫原性,可以改善多种免疫相关性疾病的病情[4-5],而既往在过敏性疾病的研究主要集中在哮喘,在食物过敏当中的研究甚少。本实验体外分离培养ADSC,腹腔注射移植到过敏小鼠模型体内,利用液相芯片技术检测血清中多种过敏相关性细胞因子的变化,探讨ADSC移植是否对食物过敏有免疫调节作用。
1 材料与方法 1.1 实验动物SPF级6周龄Balb/c雄性小鼠10只,体重16~18 g,用于ADSC的分离培养;SPF级3周龄雌性Balb/c小鼠32只,体重9~11 g,用于建立食物过敏模型及ADSC移植。以上小鼠均由北京中国科学院动物研究所提供,并饲养于该研究所SPF级动物房内,以不含卵清蛋白(OVA)的饲料喂养。
1.2 主要试剂及仪器DMEM/F12培养基(美国Hyclone),胎牛血清(德国Biochrom AG),0.25%胰蛋白酶(中国Leagene),CD44、CD29抗体(美国eBisoscience),Ⅰ型胶原酶粉末(美国Sigma),鸡OVA V级(美国Sigma),Mouse ProcartaPlex多因子试剂盒(美国eBisoscience)。
1.3 ADSC的分离和培养参照李冠雪[6]的文献,并作适当改良。10只Balb/c雄性小鼠,颈椎脱臼,酒精浸泡5 min,取附睾部位脂肪,PBS冲洗2遍,将脂肪剪成小碎块,然后加入等体积的0.1%Ⅰ型胶原酶,培养箱内消化,每隔10 min震荡1次。消化完成后加入等量培养基,100目细胞筛过滤,离心,培养基重悬,接种。48 h后首次换液,以后每2~3 d换液1次,细胞长满90%进行传代,显微镜下观察细胞形态。
1.4 ADSC的诱导分化鉴定成脂肪诱导:取3~4代ADSC接种到6孔板,调整细胞数为1×104个/孔,普通DMEM/F12培养基培养,待细胞长满80%时,更换成脂诱导培养基(包括90% DMEM/F12、10%胎牛血清、地塞米松1 μmol/L、3-异丁基-1-甲基黄嘌呤500 μmol/L、胰岛素10 μg/mL、吲哚美辛0.2 mmol/L),进行成脂诱导分化,2~3 d换液1次。诱导2周左右,油红O染色鉴定。
成骨诱导:取3~4代ADSC接种到6孔板,调整细胞数为1×104个/孔,普通DMEM/F12培养基培养,待细胞长满70%~80%时,更换成骨诱导培养基(包括90% DMEM/F12、10%胎牛血清、地塞米松0.1 μmol/L、β-甘油二磷酸钠10 mmol/L、抗坏血酸50 μmol/L),进行成骨诱导分化,2~3 d换液1次。诱导3周左右,茜素红染色鉴定。
1.5 ADSC的表面抗体鉴定取第5代ADSC,PBS洗涤3次,调整细胞数为5×105个/管,加入荧光标记的单抗CD44、CD29,设置阴性对照,流式细胞仪检测。
1.6 食物过敏模型的制备及干细胞移植32只3周龄Balb/c雌性小鼠随机分为空白对照组、过敏模型组、ADSC治疗组和ADSC预防组,每组8只。食物过敏模型的制作参照王本贞等[7]和Shin等[8]的方法,每只小鼠于第1天腹腔注射基础致敏剂0.2 mL(含OVA 50 μg、氢氧化铝佐剂0.75 mg);第14天腹腔注射强化致敏剂0.2 mL(含OVA 50 μg);自第17天开始,每隔2 d给予小鼠灌胃0.3 mL激发致敏剂(OVA浓度为2 mg/mL)进行激发,直至第29天;空白对照组小鼠在各致敏阶段给予等量的生理盐水作为替代。
ADSC治疗组于造模第15天腹腔注射ADSC细胞悬液0.2 mL(细胞数为1×106个),ADSC预防组于造模第1天腹腔注射0.2 mL细胞悬液(细胞数为1×106个),空白对照组和过敏模型组注射0.2 mL PBS作为替代。
1.7 食物过敏的症状评分标准观察致敏操作及细胞移植对小鼠过敏症状的影响,并记录末次激发致敏后小鼠的过敏症状评分,评分标准参照文献[7]。0分:小鼠无明显症状;1分:小鼠挠耳、鼻子或者躯干等部位;2分:小鼠出现腹泻、呼吸急促、易激惹的症状;3分:小鼠出现眼睛、嘴巴浮肿,尾巴紫绀等症状;4分:小鼠呼吸减慢、活力低下或者无活力;5分:小鼠死亡。该评分作为评价模型制备成功与否及干细胞治疗效果的辅助标准。
1.8 血清中细胞因子的检测小鼠末次激发后4 h摘眼球取血,采用Luminex液相芯片技术检测血清中细胞因子IFN-γ、IL-4、IL-5、IL-6、IL-10、IL-13、IL-17A、IL-22、IL-23及单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)的含量,具体操作参照说明书。
1.9 小鼠空肠组织学观察小鼠取血后固定,取空肠0.5 cm进行甲醛固定,石蜡包埋、切片,常规苏木精-伊红染色,镜下观察小鼠空肠绒毛及炎性细胞浸润情况。
1.10 统计学分析采用SPSS 13.0统计学软件对数据进行统计学分析,正态分布计量资料采用均数±标准差((x±s))表示,多组间均数的比较采用单因素方差分析,组间两两比较采用SNK-q检验;非正态分布计量资料采用中位数(四分位间距)[M(P25,P75)]表示,多组间比较采用Kruskal-Wallis H检验,组间两两比较采用Nemenyi检验。P<0.05为差异有统计学意义。
2 结果 2.1 小鼠ADSC的分离培养接种后观察培养瓶内细胞主要是圆形,24 h后有较多细胞贴壁,胞体成短梭形,折光性差。48 h后,贴壁细胞数量增多,形态比较均一,多为细长梭形,细胞融合达80%~90%时首次传代,随着传代换液,混杂细胞和杂质明显减少,一般选第3~6代细胞进行实验。
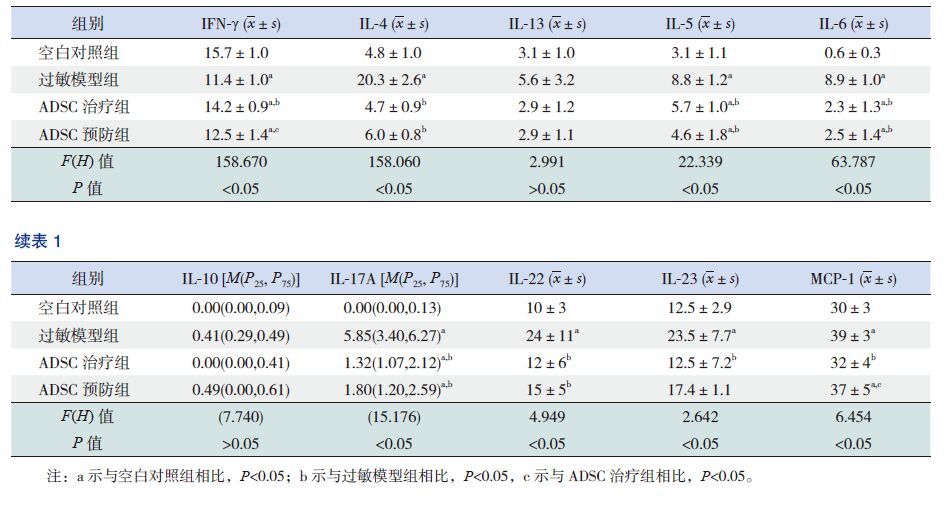
2.2 ADSC的诱导分化鉴定ADSC成脂诱导5 d左右,细胞内出现较小脂滴,继续诱导细胞逐渐变成圆形或多边形,脂滴开始增大并融合,2周后油红O染色可见大量脂质沉淀(图 1左)。
|
图 1 ADSC的诱导分化鉴定 左图为ADSC经成脂肪诱导2周鉴定结果(油红O染色,×400),脂肪被染成红色;右图为ADSC经成骨诱导3周鉴定结果(茜素红染色,×200),钙结节被染成红色。 |
ADSC成骨诱导1周左右,细胞呈多角形,胞质内出现少量细胞颗粒,2周左右细胞成集落样生长,可见钙质沉积,3周细胞融合,出现明显的钙结节,茜素红染色呈红色(图 1右)。
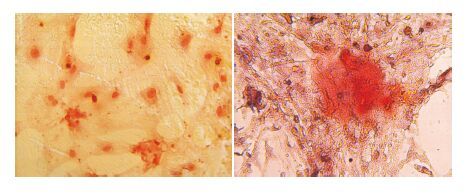
2.3 ADSC的表面抗体鉴定流式细胞表面鉴定结果可见ADSC阳性表达CD44(98.92%)和CD29(99.78%),见图 2。
|
图 2 ADSC表型鉴定 A为CD44阴性对照;B为ADSC阳性表达CD44抗体;C为CD29阴性对照;D为ADSC阳性表达CD29抗体。 |
2.4 食物过敏症状评分
末次激发致敏后,各组食物过敏症状评分比较差异有统计学意义(H=20.96,P<0.001)。空白对照组食物过敏症状评分[0.0(0.0,1.0)]明显低于过敏模型组[3.0(2.5,3.5)]、ADSC治疗组[2.0 (1.2,2.8)]和ADSC预防组[2.0(1.2,3.0)](P<0.05)。与过敏模型组相比,ADSC治疗组和ADSC预防组食物过敏症状评分降低(P<0.05)。ADSC治疗组与ADSC预防组间食物过敏症状评分比较差异无统计学意义(P>0.05)。
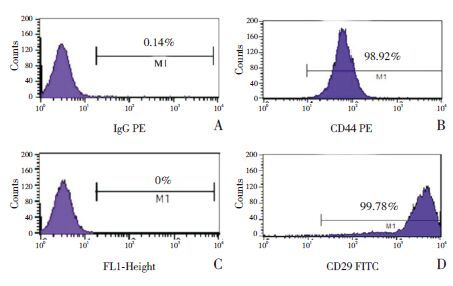
2.5 小鼠空肠组织学观察小鼠空肠组织经苏木精-伊红染色,在显微镜下观察肠绒毛及炎性细胞浸润情况(图 3)。空白对照组小鼠肠绒毛结构完整,肠上皮完好,无明显炎性细胞浸润,固有层无水肿、充血;过敏模型组小鼠空肠黏膜破坏明显,部分小肠绒毛结构紊乱甚至剥落,绒毛上皮细胞脱落、坏死,固有层有大量淋巴细胞及嗜酸性粒细胞浸润、水肿,这些改变符合肠黏膜过敏反应的改变;ADSC治疗组小鼠肠绒毛结构相对完整,少量炎性细胞浸润;ADSC预防组小鼠肠绒毛水肿较轻,黏膜有破坏,上皮细胞坏死轻微,炎性细胞浸润稍多。
|
图 3 空肠病理切片(苏木精-伊红染色,×400) A:空白对照组小鼠绒毛结构完整,无明显炎性细胞浸润;B:过敏模型组小鼠部分小肠绒毛结构紊乱甚至剥落,固有层有大量淋巴细胞(黄色箭头示)及嗜酸性粒细胞(红色箭头示)浸润,血管扩张、充血(黑色箭头示);C:ADSC治疗组小鼠绒毛结构相对完整,少量炎性细胞浸润;D:ADSC预防组小鼠绒毛水肿较轻,上皮细胞坏死轻微,炎性细胞浸润稍多。 |
2.6 血清中细胞因子的检测
与空白对照组相比,过敏模型组小鼠血清中IFN-γ含量降低,IL-4、IL-5、IL-6、IL-17A、IL-22、IL-23、MCP-1含量均升高(P<0.05),IL-10、IL-13含量在两组间比较差异无统计学意义(P>0.05),见表 1。
| 表 1 不同分组小鼠血清中多种细胞因子的变化(n=8,pg/mL) |
与过敏模型组相比,ADSC治疗组IFN-γ升高,IL-4、IL-5、IL-6、IL-17A、IL-22、IL-23、MCP-1含量均降低(P<0.05),IL-10、IL-13含量在两组间比较差异无统计学意义(P>0.05),见表 1。
与过敏模型组相比,ADSC预防组IL-4、IL-5、IL-6、IL-17A、IL-22含量降低(P<0.05),IFN-γ、IL-10、IL-13、MCP-1含量在两组间比较差异无统计学意义(P>0.05),见表 1。
结合各组小鼠过敏症状评分、空肠病理改变及血清细胞因子改变的情况综合分析,ADSC治疗组与ADSC预防组都对食物过敏有免疫干预作用,并且ADSC治疗组在改善小鼠食物过敏上效果更好。
3 讨论食物过敏时自身免疫调节功能紊乱,引起失控和过度的自身免疫反应,造成机体的器质性损害和功能障碍,辅助T淋巴细胞在食物过敏的发生发展过程中有重要的调节作用。Mossman等[9]于1986年首次报道Th1、Th2细胞亚群,经典的免疫学理论认为辅助性CD4+T细胞由这两个亚群组成,食物过敏是由于Th1/Th2免疫反应失衡而引起,Th1细胞能合成IFN-γ、IL-2、IL-12等,其中IFN-γ是Th1亚群的特征性代表因子,通过促进NK细胞、巨噬细胞活化增殖,促进Th0细胞向Th1细胞分化,减少炎症细胞的浸润,对过敏的发生起保护作用;Th2细胞可以分泌IL-4、IL-5、IL-6、IL-9、IL-10、IL-13等多种细胞因子,代表因子是IL-4,通过辅助B细胞增殖,诱导IgE及多种炎性趋化因子生成,引起过敏反应的发生。本实验设计使用3周龄Balb/c幼鼠为研究对象以便模拟儿童的食物过敏及ADSC移植治疗。用OVA成功制备食物过敏模型的标志主要为:Th1、Th2的特征性代表因子IFN-γ、IL-4含量改变有统计学意义,模型小鼠过敏症状评分高于对照组,空肠病理出现明显的过敏改变。从结果来看,模型组小鼠过敏症状评分明显增高;过敏模型组小鼠空肠黏膜出现典型的伴有嗜酸细胞聚集增多的I型变态反应炎症改变;其血清中IFN-γ含量比对照组降低,IL-4含量升高,其他细胞因子IL-5、IL-6与对照组相比含量均升高。ADSC治疗组与过敏模型组相比IL-5、IL-6水平降低,而IL-10、IL-13也有相应改变,但差异无统计学意义。IL-5、IL-6、IL-10、IL-13均是Th2分泌的细胞因子,本研究提示,仅有前两项指标变化有统计学意义,这可能与致敏剂的剂量有关,Th2细胞因子的分泌在一定的OVA浓度范围内呈剂量依赖性[10]。
随着研究的深入,Th17、Th22等新型辅助性T细胞亚群陆续被发现[11, 12, 13]。IL-17是Th17细胞分泌的促炎性细胞因子,能促进趋化因子分泌,国外一篇研究提示Th17细胞或许可以作为儿童食物过敏免疫耐受的潜在标志因子[14]。IL-23是IL-12异源二聚体细胞因子家族的新成员,有研究证实,IL-23可以引发CD4+效应T细胞表达致炎细胞因子IL-17[15]。IL-23/IL-17细胞因子网络作为免疫致病机制的关键作用因素,通过表达相应的细胞因子导致炎症的发生,在各种变态反应中发挥重要作用。实验中IL-17A、IL-23在过敏模型组比空白对照组升高,而在ADSC治疗组较过敏模型组降低,也验证了Th17亚群在食物过敏中的作用及ADSC对食物过敏的免疫调节作用。IL-22主要由Th22细胞分泌,少量由Th17细胞分泌。近年IL-22在哮喘的研究颇多,有研究者证实在过敏模型小鼠和哮喘患者外周血中均有IL-22的高表达[16, 17],但外源性重组IL-22或IL-22抗体中和掉IL-22之后,又对过敏起到了缓解作用[18, 19],说明IL-22的作用机制复杂,可能在过敏性疾病中起到了双向调节作用。实验中过敏模型组小鼠血清IL-22高于空白对照组,ADSC治疗组小鼠血清IL-22又低于过敏模型组,趋化因子由炎性反应部位的细胞分泌,在过敏反应、机体免疫调节、炎性反应等过程中发挥重要作用。MCP-1是肥大细胞脱颗粒释放的活性物质,实验中模型组出现明显升高,参与了过敏反应,这与文献[7]结果一致,而ADSC治疗组比过敏模型组降低,可以说明ADSC对过敏反应有一定的治疗作用,说明MCP-1或许可以作为反映食物过敏及治疗情况的一个指标。
本研究根据移植干细胞的时间点不同,设置了ADSC治疗组和ADSC预防组,结果显示ADSC移植对两组均有免疫干预效果,产生部分免疫耐受现象,无论是从改变的细胞因子数量、幅度,还是从过敏症状评分的降低,以及病理组织学炎性改变来看,ADSC治疗组的变化更为明显,ADSC治疗组比预防组免疫干预效果更好。该实验显示,ADSC干细胞移植防治小鼠食物过敏,多种细胞因子参与了体内的免疫调节过程,作用机制复杂,其机制可能与ADSC对Th1、Th2、Th17、Th22的免疫调节有关,ADSC可能通过增强Th1细胞的保护作用,抑制Th2、Th17、Th22细胞的致炎作用来维持免疫再平衡,其中在ADSC治疗组IFN-γ增加,IL-4、IL-5、IL-6、IL-17A、IL-22、IL-23、MCP-1减少,这对判断免疫调节效果是有帮助的,或许可以作为评价干细胞移植对食物过敏的免疫调节效果的候选标志因子。预防性和治疗性腹腔移植ADSC均可减轻OVA诱导的幼鼠食物过敏症状、病理改变,但是ADSC移植后详细免疫机制需要进一步深入研究。
对于一般的食物过敏可以采用回避食物(忌食)的方法解决,但是,高度敏感的患者极微量的过敏原(食物)即可引发严重过敏性休克,甚至死亡,有些患者多种食物过敏,如果完全忌食会出现生长发育和营养问题,这些是当今面临的最大难题,诱导免疫耐受可能是有效解决的途径。ADSC作为间充质干细胞中的重要成员,来源丰富,易于获取,不仅可以抑制移植物抗宿主反应,不易发生免疫排斥,还可以调节受体的免疫系统,通过细胞间相互作用及产生细胞因子影响T细胞的增殖及其免疫反应,从而免疫重建。ADSC的低免疫原性及强大的免疫调节功能使得ADSC移植在过敏性疾病这一领域可能有广泛的应用前景。本研究采用ADSC移植对食物过敏动物模型的免疫防治治疗做了初步探索,为进一步在人类食物过敏防治中诱导免疫耐受提供一种研究思路。
| [1] | 张雅蓉, 陈云, 赵艾, 等. 中国3~12 岁儿童自报食物过敏与食物不耐受的相关因素分析[J]. 卫生研究,2015,44 (2) :226–231. |
| [2] | 黄娟, 黄东明, 肖晓雄, 等. 2010 年中山市城区0~14 岁儿童哮喘流行病学调查[J]. 中国当代儿科杂志,2015,17 (2) :149–154. |
| [3] | Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies[J]. Tissue Eng,2001, 7 (2) :211–228 . |
| [4] | Abreu SC, Antunes MA, Maron-Gutierrez T, et al. Bone marrow mononuclear cell therapy in experimental allergic asthma: Intratracheal versus intravenous administration[J]. Respir Physiol Neurobiol,2013, 185 (3) :615–624 . |
| [5] | Cho KS, Park HK, Park HY, et al. IFATS collection: Immunomodulatory effects of adipose tissue-derived stem cells in an allergic rhinitis mouse model[J]. Stem Cells,2009, 27 (1) :259–265 . |
| [6] | 李冠雪. 脂肪来源间充质干细胞(ADSC) 调控变应性鼻炎模型鼠T 细胞免疫状态的研究[D]. 广州: 南方医科大学, 2013. |
| [7] | 王本贞, 郑成中. CPG 寡核苷酸对卵清蛋白致敏幼鼠血清 Th1/Th2 细胞因子及肥大细胞趋化蛋白1 的影响[J]. 解放军医学院学报,2015,36 (5) :505–509. |
| [8] | Shin HS, Bae MJ, Jung SY, et al. Preventive effects of skullcap (Scutellaria baicalensis) extract in a mouse model of food allergy[J]. J Ethnopharmacol,2014, 153 (3) :667–673 . |
| [9] | Mosmann TR, Cherwinski H, Bond MW, et al. Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. 1986[J]. J Immunol,2005, 175 (1) :5–14 . |
| [10] | 宋云熙, 曾雪峰, 夏俊波, 等. 大剂量过敏原诱导哮喘小鼠T 细胞不反应性及机制研究[J]. 免疫学杂志,2007,23 (3) :274–276. |
| [11] | van de Veerdonk FL, Netea MG. T-cell subsets and antifungal host defenses[J]. Curr Fungal Infect Rep,2010, 4 (4) :238–243 . |
| [12] | Bi Y, Liu G, Yang R. Reciprocal modulation between TH17 and other helper T cell lineages[J]. J Cell Physiol,2011, 226 (1) :8–13 . |
| [13] | 赵令. Th22 细胞及其功能分子IL-22 在系统性自身免疫病中作用的研究[D]. 长春: 吉林大学, 2013. |
| [14] | Dhuban KB, d'Hennezel E, Ben-Shoshan M, et al. Altered T helper 17 responses in children with food allergy[J]. Int Arch Allergy Immunol,2013, 162 (4) :318–322 . |
| [15] | 曹茵茵, 冯学斌, 王跃嗣, 等. 哮喘大鼠淋巴液和血液中 Th17 细胞百分率升高及IL-23、IL-17 的表达增加[J]. 细胞与分子免疫学杂志,2013,29 (12) :1281–1287. |
| [16] | Pawankar R, Hayashi M, Yamanishi S, et al. The paradigm of cytokine networks in allergic airway inflammation[J]. Curr Opin Allergy Clin Immunol,2015, 15 (1) :41–48 . |
| [17] | Zhu J, Cao Y, Li K, et al. Increased expression of aryl hydrocarbon receptor and interleukin 22 in patients with allergic asthma[J]. Asian Pac J Allergy Immunol,2011, 29 (3) :266–272 . |
| [18] | Besnard AG, Sabat R, Dumoutier L, et al. Dual role of IL-22 in allergic airway inflammation and its cross-talk with IL-17A[J]. Am J Respir Crit Care Med,2011, 183 (9) :1153–1163 . |
| [19] | Taube C, Tertilt C, Gyülveszi G, et al. IL-22 is produced by innate lymphoid cells and limits inflammation in allergic airway disease[J]. PLoS One,2011, 6 (7) :e21799. |
 2016, Vol. 18
2016, Vol. 18