2. 孝感市妇幼保健院儿科, 湖北 孝感 432000
肥胖(obesity)和哮喘(asthma)是儿童人群中的常见病,二者之间的关联性早已受到广泛关注。流行病学资料显示,我国目前学龄儿童的肥胖率约为8.9%[1-2]。儿童哮喘患病率在不同的调查中略有不同,较为权威的数据是1.97%和3.3%[3, 4]。值得注意的是随着肥胖人群的增加,哮喘发病率也随之攀升。在一项关于中国16城市儿童哮喘患病率20年对比研究的报道中,0~14岁儿童哮喘总的患病率较10年和20年前分别上升了43.4% 和147.9%[5]。如同早年欧美的状况类似,北美儿童肥胖人数从1980到1994年翻了1倍,而哮喘发病率在1980年为3.6%,2003年为5.8%[6],2013年为8.3%[7]。据WHO预测,随着世界范围内肥胖人群的不断增加,哮喘人群将从现在的3亿患者,增加到2025年的4亿[8-9]。儿童肥胖人群的迅速庞大形成哮喘患病率继续增高的势头在我国已经形成,并将成为公共卫生和医学研究中更为关注的一个难题。
哮喘病的典型生理特征即是气道高反应性(airway hyper-responsiveness),即对正常不能引起或仅引起轻度应答反应的刺激,出现气道过度的收缩或痉挛。它贯穿于哮喘的全过程,包括起因、变化、发展、转归和再反复。伴随气道高反应性的主要病理现象有多种炎症细胞和炎症介质及细胞因子浸润、气道上皮和上皮内神经受损、黏液分泌亢进、组织水肿、支气管平滑肌痉挛[10-11]。
肥胖对支气管哮喘的影响可简而言之为体重指数(BMI) 越大,越容易出现气道高反应 [12, 13]。关于肥胖导致哮喘的病理生理机制早有论述,其基本特征是围绕气道高反应性的因果关系和变化,归纳起来主要有:(1)脂肪组织对气道的机械物理效应,这是因为过多的软组织占据了胸腔的空间,胸壁的脂肪浸润及肺动脉血容量增加均可导致机械效应肺顺应性下降,肺容量减少,末梢呼吸道的直径缩小,从而增加呼吸道的高反应性。(2)胸腔中脂肪组织衍生的激素和细胞因子对T细胞、单核细胞、巨噬细胞和嗜酸性粒细胞等有聚集于气管的作用并加强增殖和活化。(3)肥胖与哮喘存有相同基因的控制表达[14],例如染色体5q、6p、11q13和 12q,都有诸如β2肾上腺素能受体基因(ADRB2)[15]、糖皮质激素受体基因(NR3C1)[16]和TNF-α基因[17]等,它们都直接作用于哮喘、肥胖和炎症[18]。不难看出,肥胖导致哮喘有着完整的物质和代谢基础,有着直接和共同的信号途径。在研究哮喘外界刺激因素和机体内在反应系统中的病理机制的同时,近年来人们注意到神经和神经因子在气道高反应形成过程中的作用。有关背根感觉神经节(dorsal root ganglion)伤感器(nociceptor)学说的提出[19-21],就是在终端反应机制上揭示出气道高反应性是肥胖导致哮喘的关键环节,为哮喘病的临床转化医学提出了一个新的研究课题和治疗靶向路径。本文介绍了肥胖引起哮喘在病理生理机制研究方面的进展,并特别介绍以背根感觉神经元伤感器为靶点进而阻断伤感器的信号途径抑制过敏性哮喘的最新研究。
1 瘦素在肥胖和哮喘中的关联作用瘦素(leptin)在肥胖状态下明显增高并成为炎症介质中的一个环节。瘦素的作用原本是对肥胖有负反馈即减肥作用,而且还促成肺表面活性物质磷脂的合成[22],帮助调节副交干神经和气道口径[23]。由于肥胖形成,组织细胞对瘦素产生抵抗。长期肥胖导致机体对瘦素不敏感,而激发过多的瘦素。瘦素则与长链螺旋细胞因子如IL-6有着结构上的同源性,对T细胞有极强的增殖和活化作用,并激活单核细胞和巨噬细胞 [24]。在瑞典的一项研究中,超重儿童与正常体重儿童的瘦素血清中位数均值为18.1 ng/mL vs 2.8 ng/mL(P<0.01),炎症指标IFN-γ比例为61% vs 12%(P<0.001);超重儿童中伴有哮喘发作与无哮喘发作的血清瘦素的中位数均值为30.8 ng/mL vs 14.3 ng/mL(P=0.14)[25]。我国最近的一项研究显示,在感染呼吸道合胞病毒时,支气管上皮细胞分泌大量瘦素以增加Th17淋巴细胞的分化和增强细胞外调节激酶的活性,从而参与哮喘起病和加重哮喘病程及严重程度[26]。另一篇报道也详细阐述了瘦素在哮喘小鼠模型肺组织中呈高表达[27]。由此可见,临床观察和基础实验均已表明肥胖中高表达的瘦素其本身就是哮喘中气道高反应性的相关因子。
2 纤溶酶原激活物抑制剂-1与肥胖和哮喘的相关性纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor,PAI-1)在肥胖或炎症状态下,因组织间隙缺氧而刺激肥大细胞和巨噬细胞分泌大量PAI-1,并与缺氧所致纤维蛋白原、纤维蛋白及其降解产物一起沉积于肺组织[28, 29]。PAI-1有促进气道高反应慢性病变过程中的纤维变作用。通常PAI-1越低,纤维变越低,纤溶越强;反之,PAI-1越高,纤维变越重,气道高反应性越强。有资料表明肥胖人群中其血清PAI-1水平显著高于非肥胖组[30],而PAI-1基因敲除小鼠与野生型小鼠相比,高脂饮食喂养导致肥胖和胰岛素抵抗仅发生于野生鼠,PAI-1基因敲除完全防止肥胖和胰岛素抵抗[31]。在临床研究和动物模型中,都发现肥胖体内PAI-1水平高,并且PAI-1引起嗜酸细胞活化趋化因子增高,它是趋化因子家族成员中唯一与CCR3受体特异性结合的趋化因子,可以促进嗜酸性粒细胞在呼吸道的积聚与活化,促进支气管平滑肌收缩或激惹神经兴奋进而引起气道高反应性。于是,PAI-1的抑制剂TM5275可以通过抑制PAI-1嗜酸性粒细胞变应性反应和改善气道重塑而被试用于治疗哮喘[32]。
3 脂联素和白细胞介素与肥胖和哮喘的相关性肥胖导致某些激素和代谢变化,如低血浆脂联素和高白细胞介素(interleukin)IL-5、IL-6、IL-17和IL-25。脂联素(adiponectin)是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,它对炎性细胞因子如TNF-α和IL-6具有抵抗作用。实验鼠输入脂联素可导致血浆脂联素增加50%,经哮喘过敏原激发后,其肺部嗜酸性细胞和Th2淋巴细胞的表达与其对照相比均被抑制,从而抑制或控制了哮喘。因此,脂联素的高低被视作为哮喘治疗效果和预测病程的一项指标[33-36]。有关肥胖导致机体系统或局部白介素升高,已经在IL-6、IL-17、IL-25及TNF-α等指标方面在实验研究和临床研究中均获得了正相关之公认[37-40]。而IL-5与肥胖有关的直接证据则是来自另一个角度,在转基因鼠中敲除IL-5,结果嗜酸性细胞被抑制,而脂肪组织也减少;在ΔdblGATA 转基因鼠(缺乏嗜酸性细胞)无论是肥胖组还是对照组,其老鼠体重均低于野型鼠。即IL-5低则嗜酸性细胞低,体重也低[41-42]。IL-5是哮喘中关键细胞炎症因子,它既可直接刺激气道平滑肌产生痉挛,也能激惹脊髓背根感觉神经元的伤感器[43],从而导致血管活性肠肽(VIP)释放,VIP再作用于CD4+和淋巴Ⅱ型细胞,进而释放组胺、5羟色胺、缓激肽等以构成支气管平滑肌痉挛。另外的一个实验还发现敲除IL-5,经哮喘过敏物卵白蛋白的刺激,支气管和肺泡上皮所表达的整联蛋白(integrin)和转化生长因子(TGFβ)以及嗜酸性细胞与野生鼠相比明显降低,哮喘明显受到抑制[44]。
4 神经介质对哮喘的影响作用肥胖导致机体呈系统性炎症倾向,除上述各种免疫细胞和脂肪细胞等释放的细胞因子对神经细胞致敏而导致兴奋失调外,神经作用也介导其中。一方面,内脏伤感器被脂肪组织激活,感觉神经元分泌释放神经生长因子(NGF)、P物质、速激肽(NKA)、降钙素基因相关肽(CGRP),这些物质可分别或共同作用于支气管平滑肌,形成支气管气道高反应性;同时,通过神经自分泌系统可进一步激活肥大细胞、巨噬细胞及淋巴细胞。Bonini等[45]发现哮喘患者血清NGF蛋白异常增高,NGF可以诱导嗜酸粒细胞的形成和肥大细胞增殖分化,促进组胺等炎性介质释放[46]。Olgart等[47]用变应原反复刺激哮喘患者后,发现肥大细胞和嗜酸性粒细胞的数量随着NGF的增加而不断增加,这印证了NGF除提高神经兴奋性外,还具有聚集炎症细胞和炎性因子浸润等作用。Aloe等[48]发现,NGF可促进白细胞的迁移和聚集。他们在小鼠腹膜肥大细胞和成纤维细胞的共同培养基中加入NGF,肥大细胞和成纤维细胞发生定向迁移,若加入抗NGF抗体,肥大细胞的定向迁移受到抑制。
5 脊髓背根感觉神经元和气道平滑肌的关系内脏神经的传入神经可分为交感神经和副交感神经,它们属于自主神经系统。交感神经即脊神经出锥孔分出前后支,后支即为背根感觉神经节,它包含了感觉神经元细胞体,其中部分神经元为伤感器神经元。脊神经第1~4胸段背根感觉神经元支配着支气管平滑肌和腺体的活动如分泌和收缩等。这种直接联系的解剖关系,已经过多个实验室的论证而得以确立。Dinh等[49]在气管第4~5环状软骨处注入快蓝染料,7 d后观察到脊髓第1~5胸段背根感觉神经节其TRPV和trkA神经元上均有来自于肺部的快蓝染料,这种利用染料跟踪神经纤维的分布和联系是了解体内器官间联系的主要技术方法之一,精准可靠,被广泛应用和认可。围绕神经在呼吸道组织中的分布和对呼吸的调节,交感神经和副交感神经在支气管组织上的分布已被公认 [19, 49-50] (图 1)。

|
图 1 脊髓胸段背根感觉神经元与气道平滑肌联系示意图 交感神经(背根神经节)和副交感神经(迷走神经)均与呼吸道有着直接的接触。交感神经自脊髓胸椎1~4节段分出前支即运动神经和后支即感觉神经,并直接联系气管和支气管。迷走神经自颈静脉孔出颅腔后分出颈支和节支,下行经胸廓上口入胸腔分布于胸部器官如心血管、呼吸道和食管。 |
在脊髓胸段背根感觉神经元中,约有62%的神经元具有伤感器。它是外周神经对痛性或伤害性刺激具有感受并传递信息至上级神经中枢的末梢结构,最常见的代表有瞬时感受器电位阳离子通道(TRPV)和神经生长因子受体家族A(trkA)。TRPV和trkA都是受体膜蛋白,它们对神经生长因子和多种炎性因子有着极高的亲和力,一旦激活便导致感觉神经元出现高频率、集束式、节律性放电,进而导致平滑肌细胞兴奋性收缩并痉挛。在过敏状态或肥胖所致激素变化状态下,背根感觉神经元一方面通过TRPV和trkA等对呼吸道局部产生感应和反应,另一方面并将其信息上传至中枢,进而调整呼吸和循环等一系列反应 [50, 51]。
鉴于脊髓背根感觉神经元和气道平滑肌信号路径的直接联系,研究者通过刺激背根感觉神经来观察和调节呼吸运动[52-55]。其中,最具突破意义的研究是敲除背根“伤感器神经元中TRPV1”,抑制和防止了尘螨卵所导致的哮喘[19, 56]。值得注意的是,这一动物模型是在迷走神经或其他各种哮喘通路包括局部神经介质体液激素均为正常生理状态下所建立的,说明背根感觉神经元“伤感器”在哮喘发病机制中的主导作用。鉴于“伤感器”的变化对哮喘的决定性作用,我们近来对肥胖大鼠脊髓胸段背根传人感觉神经元其兴奋性或高敏性进行了评估。结果发现大鼠饲养6周后,高脂饮食导致大鼠肥胖,其体重平均增加183%,对照组正常饮食,其体重平均增加112%。背根感觉神经元静息膜电位在肥胖鼠出现明显除极化。并且,在电流刺激下,肥胖鼠可引发多个激发动作电位和持续性自发性动作电位释放,对照组则仅出现单个动作电位。在测定背根神经节伤感器TRPV1的表达率中观察到肥胖组比对照组高12%。这一结果首次展示了肥胖可以导致脊髓胸段背根传人感觉神经元即支气管外周感觉神经元在静息状态下,细胞膜电位超极化失活、自发性节律性除极化形成,周期性神经兴奋性超高反应可出现在单个神经元并具有时钟样自发重复[57]。这恰是气道平滑肌形成气道高反应与临床体征相吻合的一个内在机制,也是控制肥胖和哮喘的一个途径[58],从而更进一步确立了支配支气管的脊髓背根感觉神经元在哮喘中的角色和作用(图 2)。
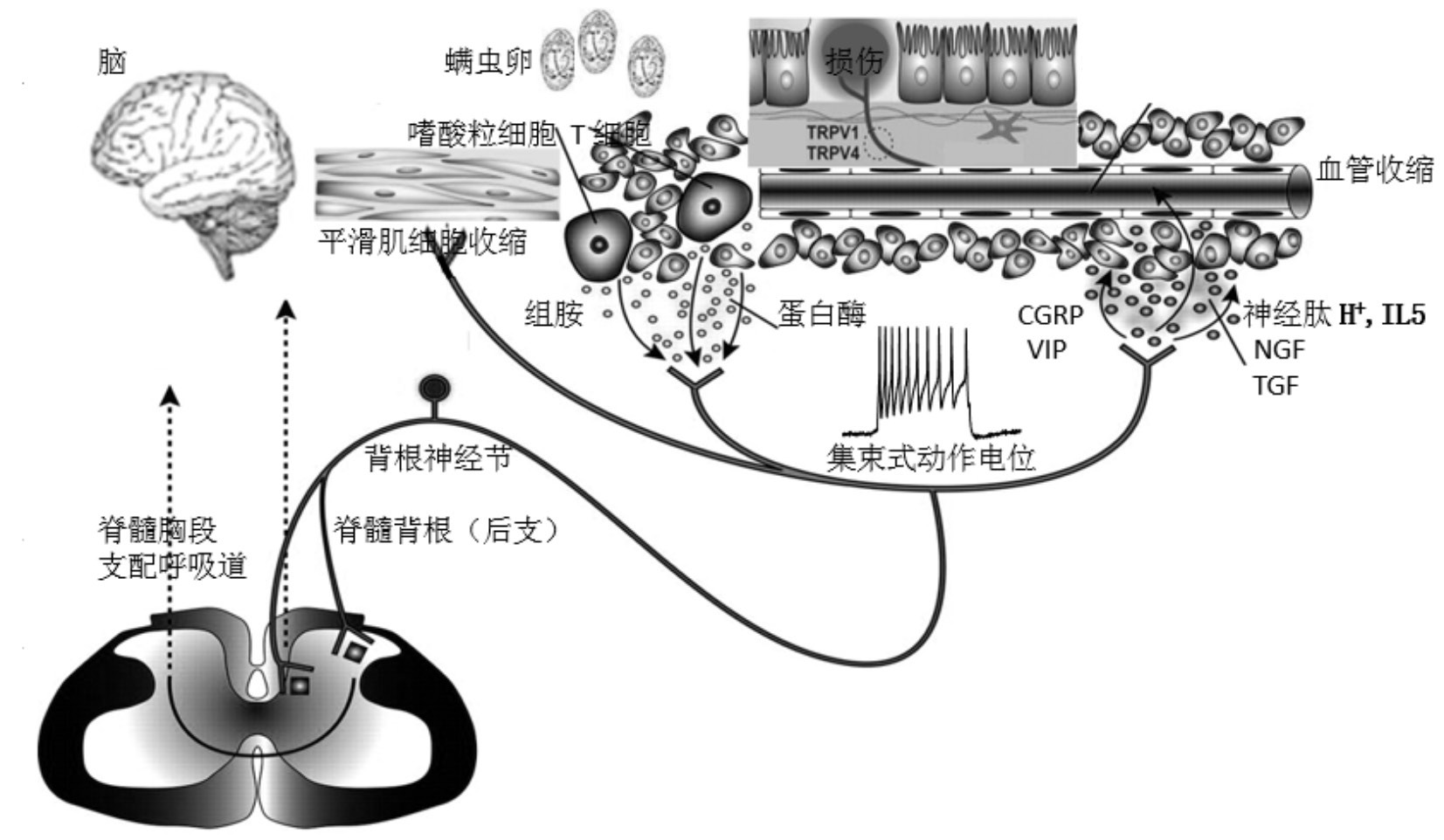
|
图 2 脊髓胸段背根感觉神经元在肥胖和哮喘关联机制中的作用示意图 肥胖所致代谢变化和由呼吸道感染或过敏所致呼吸道局部变化(如抗原性蛋白或组胺等),均能直接作用于背根感觉神经元中瞬时感受器电位阳离子通道1、4(TRPV1、TRPV4)和 神经生长因子受体家族A(trkA)等感受器并瞬时激动,感觉神经元快速大量释放神经肽类物质如血管活性肠肽(VIP)、神经生长因子(NGF)、P物质、速激肽(NKA)、降钙素基因相关肽(CGRP)等,导致呼吸道血管平滑肌收缩增强。伤感器神经元发生病理性改变后,在没有外来伤害性刺激的状态下,也可自发放电而产生阵发性或连续性、集束动作电位,从而导致呼吸道平滑肌超高反应并导致中枢对呼吸循环作出的系统反应。 |
6 儿童肥胖与哮喘关联性研究成果和临床意义
近年来,有关儿童哮喘病因和治疗方面的研究取得了许多进展,但由于诸多未知的机制尚不清楚,儿童哮喘的预防和治疗至今仍然没有根本的有效措施和方法。早在30年前,肥胖导致哮喘的因果关系就已从宏观流行病学和临床医学上得到了证实。经过近20年的实验医学研究,有关哮喘的病理生理机制从基因、细胞因子、激素等方面都证实了肥胖导致哮喘的具体依据。如本综述所说,脂肪细胞在肥胖状态下通过代谢如增加瘦素、纤溶酶原激活物抑制剂-1和白细胞炎症因子,以及降低脂联素等,这些都对哮喘的发生发展起到了一定的作用。它们对机体的影响特征既有信号传递般的连锁反应,也有环节式的正负反馈,起落同在、消长并存。这些都使得儿童肥胖与哮喘的病理生理机制显得虽然关联,却无从在临床上进行转化和应用。近年来有关脊髓胸段背根感觉神经元伤感器其兴奋性或高敏性在哮喘发病机制中的研究,发现了肥胖对背根感觉神经元兴奋性的独立作用,以及背根感觉神经元对哮喘的直接控制和调节,从而建立了肥胖-背根感觉神经元-哮喘的直接关联信号通路。这一研究已经成为了解哮喘、预防和控制哮喘的一个根本性突破。在哮喘动物模型上敲除支气管背根传入感觉神经元伤感器已成功地阻止和防止哮喘的发生,这不仅进一步明确了支气管背根传入感觉神经元对呼吸道平滑肌超高反应的作用更加突出,也使得哮喘病程中的组织结构和分子靶点更加清晰,无疑将是当前肥胖与哮喘关联中的最新认识和最新突破,这一新的进展必将成为临床转化医学领域中的热点,而受到进一步的关注和开发。
| [1] | 陈芳芳, 米杰. 儿童肥胖的评价标准及流行现状[J]. 实用儿科临床杂志,2007,22 (23) :1837–1840. |
| [2] | 聂晓娟. 儿童青少年超重肥胖现状及成因研究[J]. 中国保健营养,2013,23 (5) :568–570. |
| [3] | 全国儿科哮喘协作组;中国疾病预防控制中心环境与健康相关产品安全所. 第三次中国城市儿童哮喘流行病学调查[J]. 中华儿科杂志,2013,51 (10) :729–735. |
| [4] | Chen ZH, Wang PL, Shen HH. Asthma research in China: a fiveyear review[J]. Respirology,2013, 18 (Suppl 3) :10–19 . |
| [5] | 刘传合, 洪建国, 尚云晓, 等. 中国16 城市儿童哮喘患病率 20 年对比研究[J]. 中国实用儿科杂志,2015,30 (8) :596–600. |
| [6] | Delgado J, Barranco P, Quirce S. Obesity and asthma[J]. J Investig Allergol Clin Immunol,2008, 18 (6) :420–425 . |
| [7] | Centers for Disease Control and Prevention. Asthma Surveillance Data[EB/OL]. [February 1st , 2016]. http://www.cdc.gov/asthma/ asthmadata.htm. |
| [8] | 世界卫生组织( 慢性呼吸道疾病中心). 哮喘的影响范围[EB/ OL]. [2016-01-02]. http://www.who.int/respiratory/asthma/scope/zh/. |
| [9] | Baruwa P, Sarmah KR. Obesity and asthma[J]. Lung India,2013, 30 (1) :38–46 . |
| [10] | Johnston RA, Zhu M, Rivera-Sanchez YM, et al. Allergic airway responses in obese mice[J]. Am J Respir Crit Care Med,2007, 176 (7) :650–658 . |
| [11] | 卢洪华, 李艳春, 华树成. 支气管哮喘临床蛋白质组学研究进展[J]. 中国实验诊断学,2013,17 (7) :1352–1354. |
| [12] | Shore SA, Fredberg JJ. Obesity, smooth muscle, and airway hyperresponsiveness[J]. J Allergy Clin Immunol,2005, 115 (5) :925–927 . |
| [13] | 谢海玲, 彭佳丽, 张觉昂, 等. 机动车尾气对大鼠气道高反应性的影响[J]. 湖南师范大学学报 ( 医学版),2015,12 (2) :10–13. |
| [14] | Hobgood DK. Personality and illness: genetic connections?[J]. Med Hypotheses,2011, 76 (1) :89–93 . |
| [15] | Dandona P, Ghanim H, Monte SV, et al. Increase in the mediators of asthma in obesity and obesity with type 2 diabetes: reduction with weight loss[J]. Obesity (Silver Spring),2014, 22 (2) :356–362 . |
| [16] | Leite N, Lazarotto L, Milano GE, et al. Beta 2-adrenergic receptor gene association with overweight and asthma in children and adolescents and its relationship with physical fitness[J]. Rev Paul Pediatr,2015, 33 (4) :381–386 . |
| [17] | Yang YH, Liu YQ, Zhang L. Genetic polymorphisms of the TNF- α-308G/A are associated with metabolic syndrome in asthmatic patients from Hebei province, China[J]. Int J Clin Exp Pathol,2015, 8 (10) :13739–13746 . |
| [18] | Beuther DA, Weiss ST, Sutherland ER. Obesity and asthma[J]. Am J Respir Crit Care Med,2006, 174 (2) :112–119 . |
| [19] | Talbot S, Abdulnour RE, Burkett PR, et al. Silencing nociceptor neurons reduces allergic airway inflammation[J]. Neuron,2015, 87 (2) :341–354 . |
| [20] | Hox V, Vanoirbeek JA, Alpizar YA, et al. Crucial role of transient receptor potential ankyrin 1 and mast cells in induction of nonallergic airway hyperreactivity in mice[J]. Am J Respir Crit Care Med,2013, 187 (5) :486–493 . |
| [21] | Baraniuk JN. Rise of the sensors: nociception and pruritus[J]. Curr Allergy Asthma Rep,2012, 12 (2) :104–114 . |
| [22] | Torday JS, Rehan VK. On the evolution of the pulmonary alveolar lipofibroblast[J]. Exp Cell Res,2016, 340 (2) :215–219 . |
| [23] | Emilio AS, Tiffany Z, Charles W, et al. Inhibition of leptin regulation of parasympathetic signaling as a cause of extreme body weight-associated asthma[J]. Cell Metab,2013, 17 (1) :35–48 . |
| [24] | Sierra-Honigmann MR, Nath AK, Murakami C, et al. Biological action of leptin as an angiogenic factor[J]. Science,1998, 281 (5383) :1683–1686 . |
| [25] | Mai XM, Bottcher MF, Leijon I. Leptin and asthma in overweight children at 12 years of age[J]. Pediatr Allergy Immunol,2004, 15 (6) :523–530 . |
| [26] | Qin L, Tan YR, Hu CP, et al. Leptin is oversecreted by respiratory syncytial virus-infected bronchial epithelial cells and regulates Th2 and Th17 cell differentiation[J]. Int Arch Allergy Immunol,2015, 167 (1) :65–71 . |
| [27] | 张超, 尚云晓, 魏兵, 等. 瘦素及其受体在哮喘BALB/c小鼠肺组织中的表达及布地奈德的干预作用[J]. 中国当代儿科杂志,2015,17 (6) :623–628. |
| [28] | De Taeye B, Smith LH, Vaughan DE. Plasminogen activator inhibitor-1: a common denominator in obesity, diabetes and cardiovascular disease[J]. Curr Opin Pharmacol,2005, 5 (2) :149–154 . |
| [29] | Bora E, Soylar R, Arıkan-Ayyıldız Z, et al. Plasminogen activator inhibitor-1 and angiotensin converting enzyme gene polymorphisms in Turkish asthmatic children[J]. Allergol Immunopathol (Madr),2013, 41 (1) :11–16 . |
| [30] | 蒙绪标, 符兰芳, 刘婷婷, 等. 2型糖尿病患者血清PAI-1表达与肥胖的相关性[J]. 医学临床研究,2015,32 (9) :53–55. |
| [31] | Ma LJ, Mao SL, Taylor KL, et al. Prevention of obesity and insulin resistance in mice lacking plasminogen activator inhibitor-1[J]. Diabetes,2004, 53 (2) :336–346 . |
| [32] | Delgado J, Barranco P, Quirce S. Obesity and asthma[J]. J Investig Allergol Clin Immunol,2008, 18 (6) :420–425 . |
| [33] | Ballantyne D, Scott H, MacDonald-Wicks L, et al. Resistin is a predictor of asthma risk and resistin: adiponectin ratio is a negative predictor of lung function in asthma[J/OL]. Clin Exp Allergy, 2016 Apr 15. [Epub ahead of print]. |
| [34] | Sood A, Shore SA. Adiponectin, adiponectin, leptin, and resistin in asthma: basic mechanisms through population studies[J]. J Allergy (Cairo),2013, 2013 :785835. |
| [35] | Garcia P, Sood A. Adiponectin in pulmonary disease and critically ill patients[J]. Curr Med Chem,2012, 19 (32) :5493–5500 . |
| [36] | Holguin F, Rojas M, Brown L, et al. Airway and plasma leptin and adiponectin in lean and obese asthmatics and controls[J]. J Asthma,2011, 48 (3) :217–223 . |
| [37] | Lee SJ, Lee EJ, Kim SK, et al. Identification of pro-inflammatory cytokines associated with muscle invasive bladder cancer; the roles of IL-5, IL-20, and IL-28A[J]. PLoS One,2012, 7 (9) :e40267. |
| [38] | Esnault S, Kelly EA, Johansson MW, et al. Semaphorin 7A is expressed on airway eosinophils and upregulated by IL-5 family cytokines[J]. Clin Immunol,2014, 150 (1) :90–100 . |
| [39] | Cho JY, Miller M, Baek KJ, et al. Inhibition of airway remodeling in IL-5-deficient mice[J]. J Clin Invest,2004, 113 (4) :551–560 . |
| [40] | Marijsse GS, Seys SF, Schelpe AS, et al. Obese Individuals with asthma preferentially have a high IL-5/IL-17A/IL-25 sputum inflammatory pattern[J]. Am J Respir Crit Care Med,2014, 189 (10) :1284–1285 . |
| [41] | Wu D, Molofsky AB, Liang HE, et al. Eosinophils sustain adipose alternatively activated macrophages associated with glucose homeostasis[J]. Science,2011, 332 (6026) :243–247 . |
| [42] | Wensveen FM, Valentić S, Šestan M, et al. The "Big Bang" in obese fat: events initiating obesity-induced adipose tissue inflammation[J]. Eur J Immunol,2015, 45 (9) :2446–2456 . |
| [43] | Chen CL, Li X, Xing XH, et al. Effect of TRPV1 gene mutation on bronchial asthma in children before and after treatment[J]. Allergy Asthma Proc,2015, 36 (2) :e29–e36 . |
| [44] | Manuyakorn W, Howarth PH, Holgate ST. Airway remodelling in asthma and novel therapy[J]. Asian Pac J Allergy Immunol,2013, 31 (1) :3–10 . |
| [45] | Bonini1 S, Lambiase A, Properzi F, et al. Nerve growth factor and asthma[J]. Allergy,2002, 57 :13–15 . |
| [46] | Quarcoo D, Schulte-Herbrüggen O, Lommatzsch M, et al. Nerve growth factor induces increased airway inflammation via a neuropeptide-dependent mechanism in a transgenic animal model of allergic airway inflammation[J]. Clin Exp Allergy,2004, 34 (7) :1146–1151 . |
| [47] | Olgart C, Glund H, Blay FD, et al. Nerve growth factor levels and localisation in human asthmatic Bronchi[J]. Eur Respir J,2002, 20 (5) :1110–1116 . |
| [48] | Aloe L, Rocco ML, Bianchi P, et al. Nerve growth factor: from the early discoveries to the potential clinical use[JL]. J Transl Med, 2012, 10: 239. |
| [49] | Dinh QT, Groneberg DA, Peiser C, et al. Substance P expression in TRPV1 and trkA-positive dorsal root ganglion neurons innervating the mouse lung[J]. Respir Physiol Neurobiol,2004, 144 (1) :15–24 . |
| [50] | Nassenstein C, Dawbarn D, Pollock K, et al. Pulmonary distribution, regulation, and functional role of Trk receptors in a murine model of asthma[J]. J Allergy Clin Immunol,2006, 118 (3) :597–605 . |
| [51] | Anand U, Otto WR, Casula MA, et al. The effect of neurotrophic factors on morphology, TRPV1 expression and capsaicin responses of cultured human DRG sensory neurons[J]. Neurosci Lett,2006, 399 (1-2) :51–56 . |
| [52] | Groth M, Helbig T, Grau V, et al. Spinal afferent neurons projecting to the rat lung and pleura express acid sensitive channels[J]. Respir Res,2006, 7 (1) :96–106 . |
| [53] | Tränkner D, Hahne N, Sugino K, et al. Population of sensory neurons essential for asthmatic hyperreactivity of inflamed airways[J]. Proc Natl Acad Sci U S A,2014, 111 (31) :11515–11520 . |
| [54] | Zhu L, Oh JH, Zhu Y. Upregulation of nav1.7 through high salt loading[J]. J Neurogastroenterol Motil,2014, 20 (2) :273–275 . |
| [55] | Hox V, Vanoirbeek JA, Alpizar YA, et al. Crucial role of transient receptor potential ankyrin 1 and mast cells in induction of nonallergic airway hyperreactivity in mice[J]. Am J Respir Crit Care Med,2013, 187 (5) :486–493 . |
| [56] | Tränkner D, Hahne N, Sugino K. Population of sensory neurons essential for asthmatic hyperreactivity of inflamed airways[J]. Proc Natl Acad Sci U S A,2014, 111 (31) :11515–11520 . |
| [57] | Zhu L, Guan QW, Xu S, et al. Diet-induced obesity causes peripheral sensory nerves hypersensitivity in rats[J]. Gastroenterology,2016, 150 (4) :344. |
| [58] | Zsombok A. Vanilloid receptors-do they have a role in whole body metabolism? Evidence from TRPV1[J]. J Diabetes Complications,2013, 27 (3) :287–292 . |
 2016, Vol. 18
2016, Vol. 18
