新生儿坏死性小肠结肠炎(necrotizingenterocolitis,NEC)是新生儿时期常见的危重急症之一[1],预后不良,病死率高达20%~30%[2-3]。研究表明NEC 患儿存活者常伴发多种疾病,败血症为常见伴发症[2, 4-5],发生率在20%~40%[6-8]。而且NEC 伴发败血症是造成NEC 患儿病情加重和预后不良的重要危险因素[9],因此分析NEC 伴发败血症的危险因素显得尤为重要。本研究旨在分析NEC 伴发败血症的相关因素,为临床优化治疗策略提供参考。
1 资料与方法 1.1 研究对象2005 年7 月至2015 年2 月重庆医科大学附属儿童医院确诊为Ⅱ期或Ⅲ期的NEC 新生儿375 例,最终273 例纳入本研究,并根据是否伴发败血症分为伴发组(88 例)和无伴发组(185 例)。NEC诊断符合NEC 诊断标准[10]。
排除标准:(1)住院时间小于72 h,信息不全者;(2)NEC 诊断当天未行血常规检查者;(3)存在先天性消化道畸形者;(4)NEC 诊断前即有败血症者。本研究获得重庆医科大学附属儿童医院医学伦理委员会批准。
败血症的诊断符合[11]:(1)确定诊断:血培养或无菌体腔培养出致病菌,如果培养结果为条件致病菌,需满足再次培养出同种细菌的条件。(2)临床诊断:具有发热或体温不升、少吃、少哭、少动、反应差等临床表现并至少具备以下任意二条: ① 日龄≤ 3 d 者: 白细胞计数<5×109/L 或>25×109/L;日龄>3 d 者:白细胞计数<5×109/L或>20×109/L;②血小板计数<100×109/L;③未成熟中性粒细胞/ 成熟中性粒细胞>0.16;④ C- 反应蛋白>8 mg/L。
1.2 临床资料收集收集患儿的临床资料,包括其母产前及产时资料,如是否合并妊娠期高血压、胎膜早破、羊水污染、宫内窘迫等;患儿基本信息:性别、出生方式、出生胎龄和体重、是否多胎,有无窒息,以及NEC 发病日龄、诊断日龄、住院结局;NEC诊断前有无合并症,如低血糖、呼吸暂停、硬肿症、室间隔缺损、凝血功能障碍、代谢性酸中毒、肝肾功能损害、低钾血症、低钠血症、贫血;治疗方案:NEC 诊断前处理措施,如禁食、胃肠减压、喂养方式、侵入性操作(深静脉置管及气管插管)、输注血液制品(白蛋白、红细胞、血浆、冷沉淀)、补充益生菌;NEC 诊断后处理措施,如是否胃肠减压、首次胃肠减压时间、首次禁食时间、是否手术等。
本研究将NEC 发病日龄定义为出现呕吐、腹胀、血便等临床表现及体征时的日龄。NEC 诊断日龄定义为腹部平片或腹部超声提示门静脉积气、肠壁积气时的日龄。
1.3 统计学分析采用SPSS 13.0 统计学软件对数据进行处理。正态分布的计量资料以均数± 标准差((x±s))表示,组间比较采用t 检验;偏态分布的计量资料以中位数(四分位间距)[P50(P25,P75)] 表示,组间比较采用Mann-Whitney U 检验;计数资料比较则采取卡方检验或Fisher's 精确概率计算法。P<0.05 认为有统计学意义。
2 结果 2.1 研究对象纳入情况375 例NEC 患儿中Ⅱ期(246 例)、Ⅲ期(129例),其中102 例被排除(Ⅱ期57 例,Ⅲ期45 例),原因如下:32 例住院时间<72 h;16 例NEC 诊断前患败血症;54 例NEC 诊断当天未行血常规检查。最终273 例(Ⅱ期189 例、Ⅲ期84 例,Ⅲ期NEC中肠穿孔者54 例)纳入研究,按照是否伴发败血症分为伴发组(88 例)和无伴发组(185 例)。
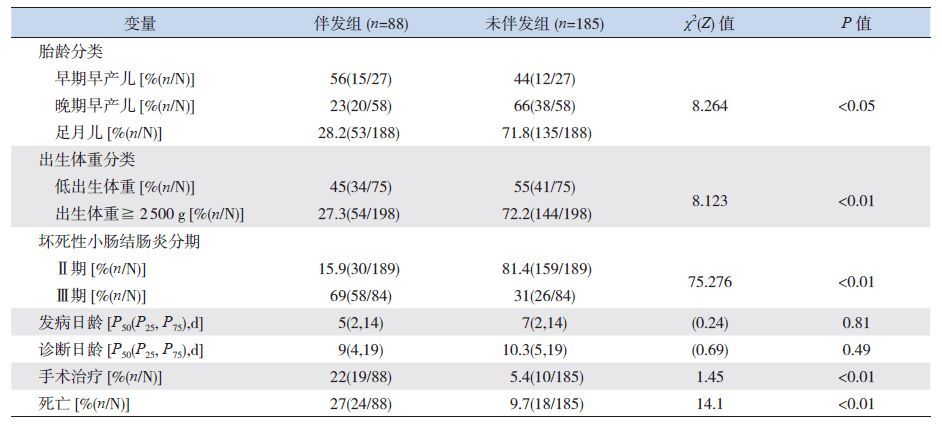
2.2 NEC 伴发败血症的基本情况273 例NEC 患儿中88 例发生败血症,败血症总发生率为32.2%。其中55 例(62.5%)在诊断NEC 后的72 h 内发生,33 例(37.5%)发生 在72 h 之后。伴发组与未伴发组患儿NEC 发病日龄、诊断日龄的差异无统计学意义(P0.05)。早期早产儿、晚期早产儿、足月儿的NEC 伴发败血症的发生率以早期早产儿最高,差异有统计学意义(P<0.05)。低出生体重儿伴发败血症的发生率高于出生体重≥ 2 500 g 患儿,差异有统计学意义(P<0.01)。Ⅱ期NEC 伴发败血症的几率低于Ⅲ期NEC(P<0.01)。伴发败血症的NEC 患儿手术几率、病死率均高于无伴发组,差异有统计学意义(P<0.01)。见表 1。
| 表 1 坏死性小肠结肠炎伴发败血症患儿的基本情况 |
88 例NEC 伴发败血症的患儿中血培养阳性者16 例:肺炎克雷伯菌亚种4 株,表皮葡萄球菌3 株,大肠埃希氏菌、屎肠球菌各2 株,山羊葡萄球菌、聚团肠杆菌、鲍曼不动杆菌、近平滑假丝酵母菌、无名假丝酵母菌各1 株。由于病原菌株少,本研究未进一步分析其药敏情况。
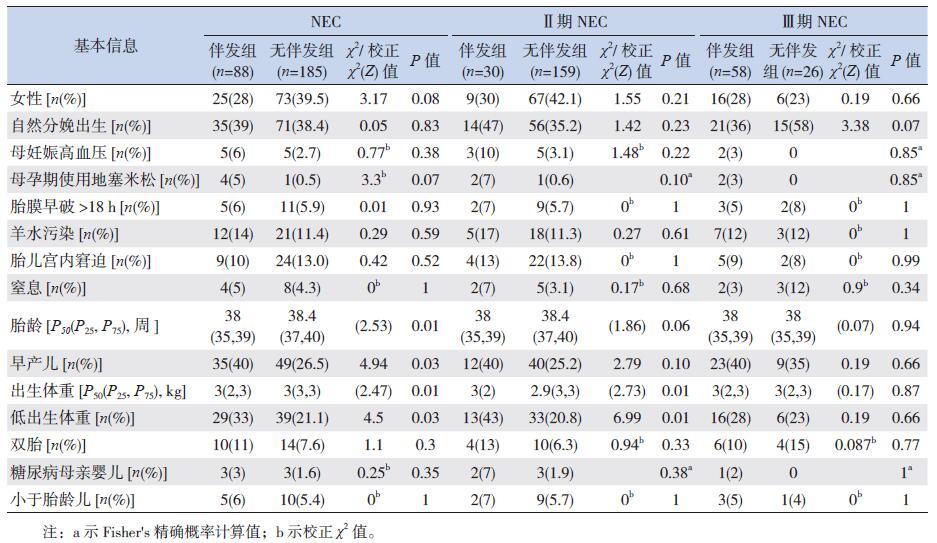
2.3 围生期因素对NEC 是否伴发败血症的影响患儿母孕期的相关因素如妊高症、糖尿病,以及出生时的相关情况如窒息、胎膜早破、羊水污染等在NEC 伴发组与无伴发组之间的差异均无统计学意义(P0.05);伴发组患儿的胎龄和出生体重较无伴发组低,早产及低出生体重儿的比例高于无伴发组(P<0.05)。Ⅱ期NEC 伴发败血症的患儿中,胎龄、出生体重较无伴发组低(P<0.05)。Ⅲ期NEC 患儿的围生期所有指标在伴发组与无伴发组之间,差异均无统计学意义(P0.05)。见表 2。
| 表 2 NEC 患儿的围生期基本信息比较 |
2.4 NEC 确诊前存在的疾病对伴发败血症的影响
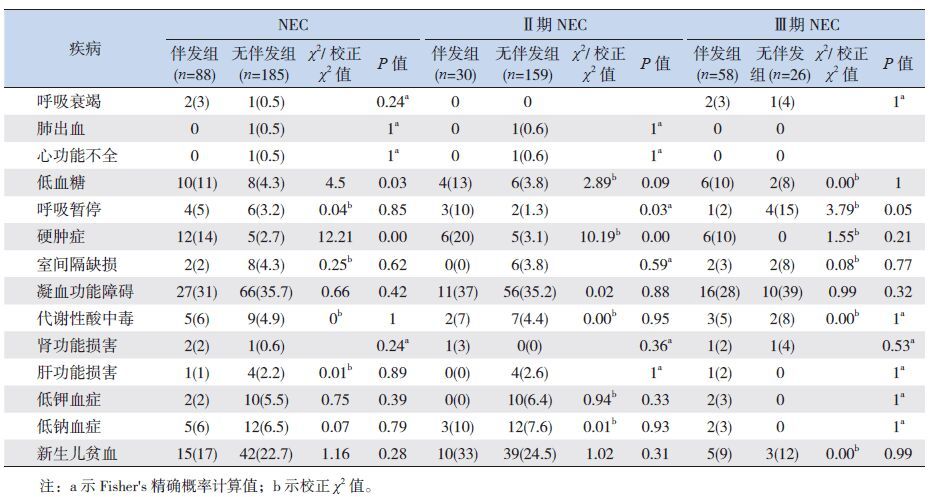
NEC 确诊前,伴发组与无伴发组的硬肿症、呼吸衰竭、先天性心脏病等疾病的发生几率差异无统计学意义(P0.05),伴发组的低血糖发生率高于无伴发组。NEC 确诊前,Ⅲ期NEC 伴发败血症组的呼吸衰竭、肺出血、心功能不全等疾病的发生率与无伴发组的差异无统计学意义(P0.05);Ⅱ期伴发败血症组的硬肿症、呼吸暂停比例高于无伴发组(P<0.05)。见表 3。
| 表 3 坏死性小肠结肠炎患儿确诊前存在的疾病对伴发败血症的影响 [ 例(%)] |
2.5 NEC 确诊前的处理措施对伴发败血症的影响
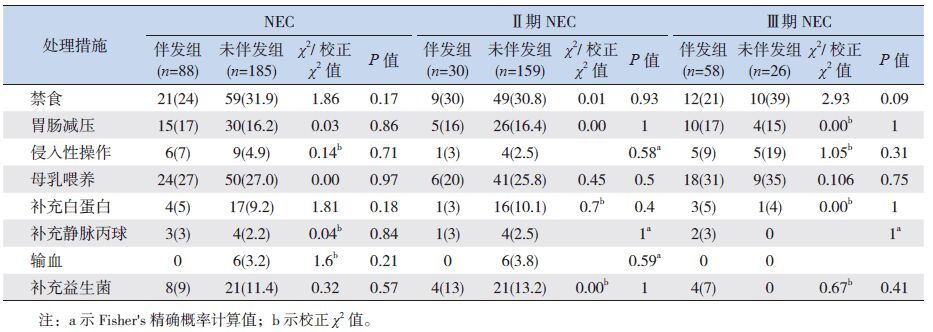
NEC 确诊前的一些处理措施如禁食、胃肠减压、喂养方式、侵入性操作以及白蛋白、球蛋白、输血、益生菌治疗等,在伴发组与无伴发组的差异无统计学意义(P0.05)。确诊NEC 前的各项处理措施在Ⅱ期或Ⅲ期NEC 的伴发组与无伴发组之间差异也无统计学意义(P0.05)。见表 4。
| 表 4 坏死性小肠结肠炎患儿确诊前处理措施比较 [ 例(%)] |
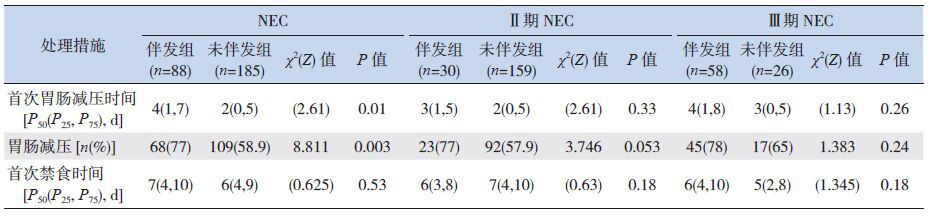
2.6 NEC 诊断后的处理措施对伴发败血症的影响
NEC 诊断后,伴发组的胃肠减压应用率及首次胃肠减压的持续时间均高于无伴发组(P<0.05);禁食时间、胃肠减压在Ⅱ期或Ⅲ期NEC 伴发组与无伴发组之间的差异均无统计学意义(P0.05)。见表 5。
| 表 5 坏死性小肠结肠炎患儿确诊后的处理措施比较 |
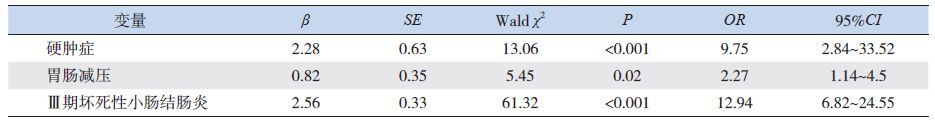
2.7 NEC 伴发败血症危险因素的logistic 回归分析
以P<0.1 为筛选标准,将单因素分析有意义的因素包括胎龄、出生体重、母孕期使用地塞米松、自然分娩、母乳喂养、硬肿症、禁食、胃肠减压、NEC 分别纳入多元逐步logistic 回归模型中,发现硬肿症、Ⅲ期NEC 以及胃肠减压为NEC 伴发败血症的独立危险因素(表 6)。Ⅱ期NEC 组logistic回归分析发现仅有硬肿症(P=0.02,OR:7.7,95%CI:2.18~27.21)是独立危险因素;Ⅲ期NEC组由于总例数仅84 例,样本量太小,logistic 回归分析未发现独立危险因素。
| 表 6 坏死性小肠结肠炎伴发败血症的logistic 回归分析 |
3 讨论
研究表明,NEC 患儿肠壁完整性遭到破坏,肠道屏障受损,菌群移位,易伴发败血症[12-13]。NEC 伴发败血症的发生率在20%~30%[6-8],甚至高达38.5%[5]。伴发败血症的NEC 肠穿孔发生率增加,手术几率增加,住院时间延长,死亡率明显升高[5]。本研究32.2% 的NEC 患儿伴发败血症,NEC 伴发败血症的患儿病死率高达27.3%,与类似研究结果相近[3, 5-8]。
本研究发现,NEC 伴发败血症组的早产及低出生体重比例明显高于对照组,其他研究也表明早产及低出生体重是NEC 伴发败血症的危险因素[5, 14]。分析其原因,可能与早产及低出生体重儿免疫系统及肠道屏障发育不完善,病原菌容易粘附和移位有关[15]。确诊Ⅱ期NEC 之前,伴发败血症组的硬肿症、呼吸暂停比例高于无伴发组(P<0.05),但进一步分析发现低血糖及呼吸暂停均发生在早产儿人群,这是早产儿人群容易出现的合并症,可能与NEC 并发败血症并无太大关联。本研究发现硬肿症是NEC 伴发败血症的独立危险因素。分析其原因,可能与硬肿症患儿血液循环差,凝血功能障碍,容易导致肠壁缺血、肠粘膜受损而加重肠道损伤,使感染进一步加重有关。本研究发现Ⅲ期NEC 败血症发生率近70%,高于Ⅱ期;logistic 回归分析也证实Ⅲ期NEC 为伴发败血症的独立危险因素。可能与Ⅲ期NEC 肠道损伤严重,病原菌容易移位引起肠源性败血症有关。本研究发现NEC 需要胃肠减压者以及首次胃肠减压时间长者更易伴发败血症。NEC 患儿的腹胀常常是由于肠道蠕动减弱甚至停止,导致食物在肠腔内积聚,肠道细菌产气难以及时排出所致[16]。因此,需要胃肠减压的NEC 患儿肠道损伤往往更严重,因此也更容易伴发败血症。
伴发败血症的NEC 主要病原是革兰氏阴性菌,以大肠埃希菌属、肺炎克雷伯菌属最为多见[5, 14-15]。本研究所获得的败血症病原主要为肺炎克雷伯菌,可能与本研究样本量较小有关(25%,4/16)。因此,对于伴发败血症的NEC 患儿,应主要针对大肠埃希菌属、肺炎克雷伯菌属等革兰氏阴性菌予以抗感染治疗。
本研究为回顾性研究,存在一定局限性:(1) 本研究的NEC 患儿中足月儿占14.2%(53/273)。大量研究表明NEC 主要发生在早产儿[2, 17-19],足月儿在NEC 发生前往往存在特定危险因素,如出生窒息、喂养不当等。由于本中心无妇产科,接收的危重患儿多为转诊而来,因此难以进一步分析这部分足月儿发生NEC 的高危因素。(2)本组患儿在住院期间,绝大部分采用配方奶喂养,这不利于NEC 患儿肠道功能恢复,可能延长患儿的住院时间。因此住院时间的延长不能仅仅归因于疾病本身的因素。
综上,早产、低出生体重NEC 患儿为高伴发败血症人群;伴发的败血症大多在NEC 诊断后72 h 内发生,硬肿症、Ⅲ期NEC 以及胃肠减压为NEC 伴发败血症的独立危险因素。
| [1] | Neu J. Necrotizing enterocolitis:the mystery goes on[J]. Neonatology , 2014, 106 : 289–295. DOI:10.1159/000365130 |
| [2] | Parravicini E, Fromm F. Necrotizing enterocolitis[J]. Clin Perinatol , 2012, 39 (2) : 387–401. DOI:10.1016/j.clp.2012.04.011 |
| [3] | Clark RH, Gordon P, Walker WM, et al. Characteristics of patients who die of necrotizing enterocolitis[J]. J Perinatol , 2012, 32 (3) : 199–204. DOI:10.1038/jp.2011.65 |
| [4] | Wu SF, Caplan M, Lin HC. Necrotizing enterocolitis:old problem with new hope[J]. Pediatr Neonatol , 2012, 53 (3) : 158–163. DOI:10.1016/j.pedneo.2012.04.001 |
| [5] | Bizzarro MJ, Ehrenkranz RA, Gallagher PG. Concurrent bloodstream infections in infants with necrotizing enterocolitis[J]. J Pediatr , 2014, 164 (1) : 61–66. DOI:10.1016/j.jpeds.2013.09.020 |
| [6] | Kliegman RM, Fanaroff AA. Necrotizing enterocolitis[J]. N Engl J Med , 1984, 310 : 1093–1103. DOI:10.1056/NEJM198404263101707 |
| [7] | Chaaban H, Shin M, Sirya E, et al. Inter-alpha inhibitor protein level in neonatal predicts necrotizing entericolitis[J]. J Pediatr , 2010, 157 (5) : 757–761. DOI:10.1016/j.jpeds.2010.04.075 |
| [8] | Arnold M, Moore SW, Sidler D, et al. Long-term outcome of surgically managed necrotizing enterocolitis in a developing country[J]. Pediatr Surg Int , 2010, 26 (4) : 355–360. DOI:10.1007/s00383-010-2583-8 |
| [9] | Miner CA, Fullmer S, Eggett DL, et al. Factors affecting the severity of necrotizing enterocolitis[J]. J Matern Fetal Neonatal Med , 2013, 26 (17) : 1715–1719. DOI:10.3109/14767058.2013.798283 |
| [10] | Walsh MC, Kliegman RM. Necrotizing enterocolitis:treatment based on staging criteria[J]. Pediatr Clin North Am , 1986, 33 (1) : 179–201. DOI:10.1016/S0031-3955(16)34975-6 |
| [11] | 中华医学会儿科学分会新生儿学组, 《中华医学会中华儿科杂志》编辑委员会. 新生儿败血症诊疗方案[J]. 中华儿科杂志 , 2003, 41 (12) : 897–899. |
| [12] | Anand RJ, Leaphart CL, Mollen KP, et al. The role of the intestinal barrier in the pathogenesis of necrotizing enterocolitis[J]. Shock , 2007, 27 (2) : 124–133. DOI:10.1097/01.shk.0000239774.02904.65 |
| [13] | Krediet TG, van Lelyveld N, Vijlbrief DC, et al. Microbiological factors associated with neonatal necrotizing enterocolitis:protective effect of early antibiotic treatment[J]. Acta Paediatr , 2003, 92 (10) : 1180–1182. DOI:10.1111/j.1651-2227.2003.tb02481.x |
| [14] | Sharma R, Tepas JJ, Hudak ML, et al. Neonatal gut injury and infection rate:impact of surgical debridement on outcome[J]. Pediatr Surg Int , 2005, 21 (12) : 977–982. DOI:10.1007/s00383-005-1539-x |
| [15] | Heida FH, Hulscher JBF, Schurink M, et al. Bloodstream infections during the onset of necrotizing enterocolitis and their relation with the pro-inflammatory response,gut wall integrity and severity of disease in NEC[J]. Pediatr Surg , 2015, 50 (11) : 1837–1841. DOI:10.1016/j.jpedsurg.2015.07.009 |
| [16] | 童笑梅.坏死性小肠结肠炎[M]//邵肖梅,叶鸿瑁,丘小汕.实用新生儿学.第4版.北京:人民卫生出版社,2011:477-483. |
| [17] | Thompson AM, Bizzarro MJ. Necrotizing enterocolitis in newborns pathogenesis,prevention and management[J]. Drugs , 2008, 68 (9) : 1227–1238. DOI:10.2165/00003495-200868090-00004 |
| [18] | Vongbhavit K, Underwood MA. Prevention of necrotizing enterocolitis through manipulation of the intestinal microbiota of the premature infant[J]. Clin Ther , 2016, 38 (4) : 716–732. DOI:10.1016/j.clinthera.2016.01.006 |
| [19] | Eaton S, Rees CM, Hall NJ. Current research in necrotizing enterocolitis[J]. Early Hum Dev , 2016, 97 : 33–39. DOI:10.1016/j.earlhumdev.2016.01.013 |
 2016, Vol. 18
2016, Vol. 18