动脉导管未闭(patent ductus arteriosus,PDA)为极低出生体重儿一个常见的合并症,是导致呼吸机依赖、严重颅内出血(IVH)、坏死性小肠结肠炎(NEC)和死亡率增加的一个重要因素,约40%~60% 的早产儿在生后第三天发生PDA[1-2]。尤其在超低出生体重儿中,PDA 的发生率高达65%,其中85% 需治疗[3]。但无论是药物还是手术治疗均存在相应的不良反应和风险,而早产儿PDA 自然关闭率高,治疗与否取决于是否为有血流动力学意义的PDA(hemodynamic significantPDA,hsPDA)。目前对于极低出生体重儿PDA 不同转归的影响因素研究较少,主要针对产前母亲因素、围产期合并症及治疗的分析,Koch 等[4] 曾调查超低出生体重儿PDA 转归的影响因素,发现胎龄越成熟、产前未使用激素或未合并新生儿呼吸窘迫综合征(NRDS)的患儿PDA 易自然关闭。而国内目前尚无相关研究报道。PDA 是否进展为hsPDA,除了根据临床症状判断,还可应用超声心动图观察动脉导管的形态学和血流特点以评估其发展趋势从而指导临床治疗[5]。因此,本研究旨在从临床及超声心动图两方面分析PDA 不同转归的影响因素,预测PDA 自然关闭的可能性及治疗指征。
1 资料与方法 1.1 研究对象选择我院2012 年1 月至2014 年12 月新生儿重症监护室收治的生后48 h 内入院且排除PDA以外先天性心脏病的极低出生体重儿作为研究对象,剔除生后7 d 内死亡或放弃治疗的患儿。共194 例患儿符合纳入标准,根据其住院期间动态超声心动图检查及治疗转归情况分为以下4 组:无PDA 组(7 d 内3 次超声心动图检查均未发现存在PDA,临床无症状);PDA 自然关闭组(存在PDA,但未发生血流动力学意义,未予治疗动态复查超声心动图关闭);药物关闭组(存在PDA,且发生血流动力学意义,即发生hsPDA,药物治疗1~2 个疗程后多次复查超声心动图关闭);手术关闭组(存在PDA,且发生血流动力学意义,药物治疗2 个疗程仍未关闭后经手术结扎关闭);分析不同PDA 关闭组的临床及超声心动图特征。
hsPDA 定义:发生血流动力学改变,动脉导管直径>1.5 mm,伴有以下临床表现之一:心脏杂音、心动过速、呼吸增快、脉压增大、低血压、水冲脉、心脏扩大[6]。
1.2 治疗方法PDA 药物治疗:采用吲哚美辛(消炎痛)胃内给药,每次0.2 mg/kg,每隔12 h 一次,3 次为一疗程,若一个疗程结束仍未关闭,且血流动力学改变明显,于第一疗程结束5 d 后给予第2 个疗程。治疗期间密切监测患儿尿量、有无出血倾向、血小板计数等,如出现血小板减少、肾功能不全、出血倾向则停用。
PDA 结扎指证:hsPDA 经吲哚美辛口服治疗2个疗程后仍未关闭,且临床上无法停止氧疗,动态复查超声心动图提示左房/ 主动脉根部直径之比增大,给予手术结扎关闭。
随访:所有极低出生体重儿于纠正胎龄44 周及年龄3 月、6 月时接受早产儿随访,如有PDA再开放症状者,常规复查超声心动图排查。
1.3 研究方法收集患儿的围产期、临床及心脏超声指标。
(1)围产期指标:母亲年龄、妊娠期高血压、胎膜早破、产前激素的应用、分娩方式。
(2)新生儿指标:出生体重、出生胎龄、性别、是否为小于胎龄儿、1 min 及5 min Apgar 评分,是否合并NRDS、PS 应用、生后72 h 入液量,后期并发症如:重度IVH、NEC、支气管肺发育不良(BPD)等。
(3)心脏超声指标:所有患儿入院后定期床旁超声心动图监测动脉导管的二维指标[导管直径(DA)]、M 超[左房/ 主动脉根部直径之比(LA/AO)、左心室舒张末期内径(LVIDD)] 及多普勒超声(经动脉导管血流方向、血流类型)等相关指标变化。监测时间为:生后48 h、日龄4 d、7 d 及治疗前后12~48 h,7 d 后仍未关闭者每隔1~2 周复查超声心动图,直至关闭。出院时未关闭者,每隔1~3 月随访并复查超声心动图,直至关闭。动脉导管分流类型根据Visconti 等[7] 报道分为以下4 类:①肺动脉高压型(肺高压型)(Pulmonary hypertension pattern),双向分流,以肺动脉向主动脉分流(右向左分流)为主,伴随小部分主动脉向肺动脉分流(左向右分流);②进展型(Growing pattern),双向分流,以左向右分流为主,而右向左分流减少;③脉冲型(Pulsatilepattern),脉冲式左向右分流,峰流速1.5 m/s 左右;④关闭型(closing pattern):连续性左向右分流,峰流速2 m/s 以上。
1.4 统计学分析采用SPSS 16.0 统计软件进行统计分析,计量资料以均数± 标准差((x±s))表示,组间比较采用方差分析或秩和检验;计数资料以率(%)表示,组间比较采用卡方检验;相关分析采用多因素logistic 回归分析。P<0.05 为差异有统计学意义。
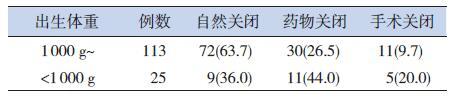
2 结果 2.1 极低出生体重儿PDA 的发生率及转归情况194 例极低出生体重儿中138 例(71.1%)发生PDA。138 例PDA 患儿中81 例(58.7%)动脉导管自然关闭;41 例(29.7%)通过药物关闭;16例(11.6%)于2 个疗程药物治疗失败后经手术结扎关闭。出生体重在1 000 g~ 之间的自然关闭率为63.7%,而<1 000 g 的自然关闭率为36.0%,二者之间差异有统计学意义,(χ2=6.847,P=0.011)。见表 1。
| 表 1 极低出生体重儿PDA 关闭途径 [ 例(%)] |
2.2 各组一般资料
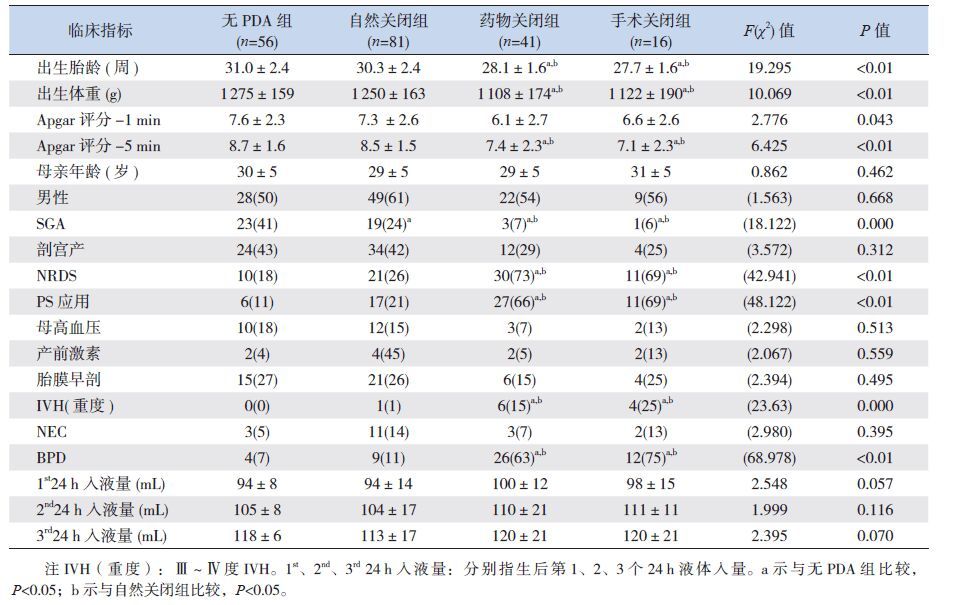
自然关闭组的出生胎龄及出生体重大于药物关闭组和手术关闭组(P<0.05),但与无PDA组比较差异无统计学意义(P>0.05)。自然关闭组SGA 比例明显高于药物及手术关闭组,低于无PDA 组,差异均有统计学意义(P<0.05);药物及手术关闭组的NRDS 发生率及PS 应用比例高于自然关闭组和无PDA 组,5 min Apgar 评分低于自然关闭组和无PDA 组,后期并发重度IVH 及BPD的比率均高于自然关闭组和无PDA 组,差异均有统计学意义(P<0.05)。见表 2。
| 表 2 4 组患儿一般资料 (x±s)或[ 例(%)] |
2.3 不同转归PDA 患儿超声心动图指标和动脉导管分流类型
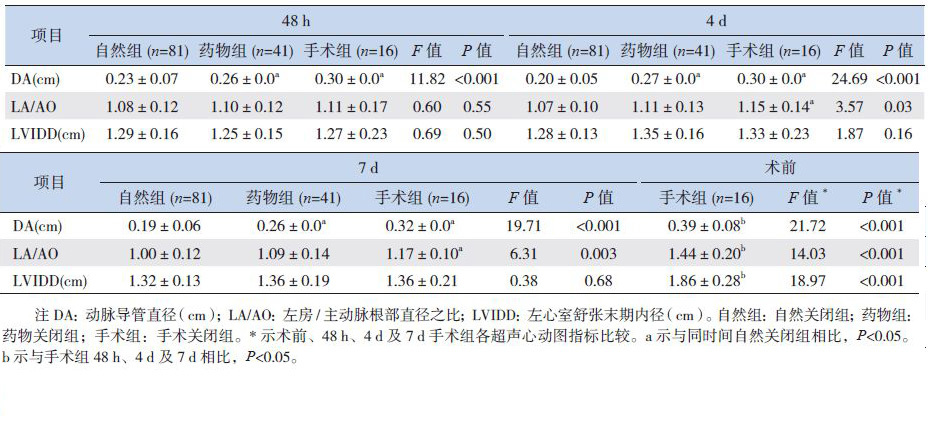
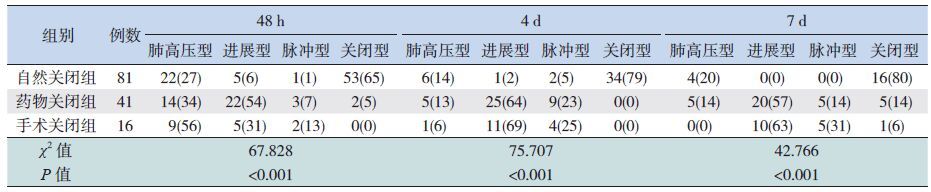
自然关闭组生后48 h、4 d 及7 d 的DA 均明显小于药物关闭组和手术关闭组,差异均有统计学意义(P<0.05)。48 h 内3 组间LA/AO 差异无统计学意义,4 d 及7 d 时3 组间LA/AO 差异均有统计学意义(P<0.05);手术组术前DA、LA/AO以及LVIDD 大于48 h、4 d 及7 d,差异有统计学意义(P<0.05)。3 组间LVIDD 在48 h、4 d 及7 d 时差异均无统计学意义。见表 3。自然关闭组动脉导管分流类型在不同时间段均以关闭型为主;而药物及手术关闭组在48 h 以肺高压型及进展型为主,在4 d 及7 d 时均以进展型为主,其次为脉冲型。见表 4。
| 表 3 不同转归PDA 患儿的超声心动图指标 (x±s) |
| 表 4 表4 不同转归PDA 患儿的动脉导管分流类型 [ 例(%)] |
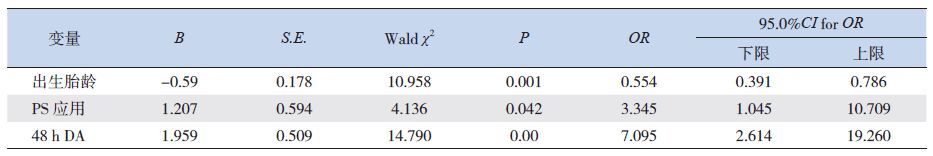
2.4 PDA 转归的logistic 回归分析
将药物治疗组及手术治疗组合并成一组(治疗组),与自然关闭组进行二分类多因素logistic回归分析发现出生胎龄、PS 应用、及48 h 动脉导管直径(48 h DA)与PDA 转归显著相关,胎龄是保护因素,PS 应用及48 h DA 是危险因素。见表 5。
| 表 5 PDA 转归相关因素logistic 回归分析 |
3 讨论
hsPDA 是极低出生体重儿死亡率增加的一个重要因素,Sellmer 等[8] 认为胎龄小于28 周生后3 d 伴有直径大于1.5 mm 的PDA 的极低出生体重儿,其发生重度IVH、BPD 的几率明显增加。
极低出生体重儿PDA 药物治疗主要包括吲哚美幸和布洛芬,文献报道两者疗效相当[3],但国内没有两药的静脉制剂,布洛芬混悬液在本中心的治疗效果欠佳,而吲哚美辛采用95% 酒精混匀后再用注射用水稀释成非常均匀的液体(含19%酒精),剂量准确性高,且摄入的量非常少,无明显酒精的不良反应,因此本研究采用吲哚美辛口服治疗。药物治疗失败且PDA 严重影响患儿的心肺功能者需手术治疗关闭PDA。尽管这些治疗已被证明有效,但无论哪一种方法均有其相应的副反应,且尚无证据能证明可以改善远期预后,所以PDA 的治疗仍有争议[9]。文献证实预防治疗可以降低hsPDA 的发生率及需外科结扎的比率,降低严重IVH 的发生率,但不改善远期神经系统的预后[10],部分研究发现预防治疗可增加无血流动力学意义的PDA(none hemodynamic significantPDA,nhsPDA)患儿BPD 的发生[11]。手术结扎术后可能出现急性心功能不全及血流动力学改变等并发症[12-13],且Kabra 等[14] 发现经历过PDA 结扎术的超低出生体重儿的远期神经系统预后更差。已有较多的文献证实早产儿PDA 大部分可以自然关闭。95% 以上出生体重大于1 500 g 的早产儿其动脉导管在生后96 h 关闭[4]。对于极低/ 超低出生体重儿,文献报道了其自然关闭的发生率在34%~73%[15-16],本研究发现极低出生体重儿自然关闭率58.7%,其中大于等于1 000 g 患儿的自然关闭率为63.7%,小于1 000 g 患儿的自然关闭率为36.0%,与文献报道接近[4, 17]。
极低出生体重儿PDA 能否自然关闭,除了与患儿出生胎龄及出生体重有关,围产期并发症也是影响PDA 是否需治疗的因素。本研究发现自然关闭组的出生胎龄、出生体重及SGA 的比例明显大于药物和手术治疗组,而并发症如NRDS 的发生率下降。Logistic 回归分析提示PS 应用与极低出生体重儿PDA 的转归密切相关,考虑NRDS 患儿应用PS 后肺血管阻力下降促使hsPDA 的发生,国内学者杜金凤等[18] 研究中发现NRDS 与hsPDA的发生相关,另有研究发现PS 的应用使关闭PDA所需的药物剂量增加,认为应用PS 可能增加PDA持续开放的概率,但具体机制尚不明[19]。SGA 患儿相对于AGA 其胎龄较大,血管平滑肌发育较成熟,故生后对氧刺激的因素更敏感,自然关闭率明显升高,Koch 等[4] 回顾分析发现自然关闭组中SGA 比例明显高于非自然关闭组(31% vs 5%)。此外,本研究发现药物及手术治疗组的重度IVH及BPD 的发生率明显高于自然关闭组,考虑与治疗组患儿hsPDA 的发生率更高、出生胎龄及体重更小有关,与Sellmer 等[8] 报道相近。
动脉导管直径大小也是影响极低出生体重儿PDA 进展为hsPDA 及自然关闭的因素。本研究发现自然关闭组在不同时间段的动脉导管直径均小于药物和手术治疗组,与El Hajjar 等[20] 报道一致。McNamara 等[21] 发现动脉导管直径大小与PDA 的血流动力学改变相关。PDA 直径大小可有助判断自然关闭的可能性,直径越小其关闭可能性越大。本研究发现LA/AO 及LVIDD 在早期三组无差异,但手术组术前以上指标明显高于早期各组,提示LA/AO 及LVIDD 在早期虽不能预测PDA 的转归,但后期可以作为是否需手术治疗的指证之一。
超声技术已应用于评判PDA 是否具有血流动力学改变,预测PDA 的发展趋势。Su 等[22] 发现nhsPDA 患儿的动脉导管流型以肺高压型、关闭型为主;hsPDA 以进展型及脉冲型为主。Visconti 等[7]也发现药物组及手术组PDA 分流类型为进展型或脉冲型为主,而自然关闭组以关闭型和肺高压型为主。本研究中自然关闭组PDA 分流类型在不同时间段均以关闭型为主,其次为肺高压型,而药物及手术关闭组在48 h 以肺高压及进展型为主,在4 d 及7 d 时转变为以进展型为主,其次为脉冲型,以上结果提示PDA 分流类型为进展型或脉冲型,或者由肺高压型演变为进展型或脉冲型,则自然关闭可能小。
综上,极低出生体重儿PDA 自然关闭率较高。出生胎龄体重越小、应用PS 以及48 h DA 越大者,PDA 自然关闭率越低。若药物治疗失败,且临床上呼吸窘迫无法改善、脱氧困难,超声心动图检查提示LA/AO 逐步增大,可考虑手术治疗。
| [1] | Abdel-Hady H, Nasef N, Shabaan AE, et al. Patent ductus arteriosus in preterm infants:do we have the right answers?[J]. Biomed Res Int , 2013, 2013 : 676192. |
| [2] | Evans N. Preterm patent ductus arteriosus:should we treat it?[J]. J Paediatr Child Health , 2012, 48 (9) : 753–758. DOI:10.1111/jpc.2012.48.issue-9 |
| [3] | Chiruvolu A, Jaleel MA. Therapeutic management of patent ductus arteriosus[J]. Early Hum Dev , 2009, 85 (3) : 151–155. DOI:10.1016/j.earlhumdev.2008.12.007 |
| [4] | Koch J, Hensley G, Roy L, et al. Prevalence of spontaneous closure of the ductus arteriosus in neonates at a birth weight of 1000 grams or less[J]. Pediatrics , 2006, 117 (4) : 1113–1121. DOI:10.1542/peds.2005-1528 |
| [5] | Tavera MC, Bassareo PP, Biddau R, et al. Role of echocardiography on the evaluation of patent ductus arteriosus in newborns[J]. J Matern Fetal Neonatal Med , 2009, 22 (Suppl 3) : 10–13. |
| [6] | De Buyst J, Rakza T, Pennaforte T, et al. Hemodynamic effects of fluid restriction in preterm infants with significant patent ductus arteriosus[J]. J Pediatr , 2012, 161 (3) : 404–408. DOI:10.1016/j.jpeds.2012.03.012 |
| [7] | Visconti LF, Morhy SS, Deutsch AD, et al. Clinical and echocardiographic characteristics associated with the evolution of the ductus arteriosus in the neonate with birth weight lower than 1,500g[J]. Einstein (Sao Paulo) , 2013, 11 (3) : 317–323. DOI:10.1590/S1679-45082013000300010 |
| [8] | Sellmer A, Bjerre JV, Schmidt MR, et al. Morbidity and mortality in preterm neonates with patent ductus arteriosus on day 3[J]. Arch Dis Child Fetal Neonatal Ed , 2013, 98 (6) : F505–F510. DOI:10.1136/archdischild-2013-303816 |
| [9] | Evans N. Preterm patent ductus arteriosus:A continuing conundrum for the neonatologist?[J]. Semin Fetal Neonatal Med , 20115, 20 (4) : 272–277. |
| [10] | Schmidt B, Davis P, Moddemann D, et al. Long-term effects of indomethacin prophylaxis in extremely-low-birth-weight infants[J]. N Engl J Med , 2001, 344 (26) : 1966–1972. DOI:10.1056/NEJM200106283442602 |
| [11] | Schmidt B, Roberts RS, Fanaroff A, et al. Indomethacin prophylaxis,patent ductus arteriosus,and the risk of bronchopulmonary dysplasia:further analyses from the Trial of Indomethacin Prophylaxis in Preterms (TIPP)[J]. J Pediatr , 2006, 148 (6) : 730–734. DOI:10.1016/j.jpeds.2006.01.047 |
| [12] | Noori S, Friedlich P, Seri I, et al. Changes in myocardial function and hemodynamics after ligation of the ductus arteriosus in preterm infants[J]. J Pediatr , 2007, 150 (6) : 597–602. DOI:10.1016/j.jpeds.2007.01.035 |
| [13] | McNamara PJ, Stewart L, Shivananda SP, et al. Patent ductus arteriosus ligation is associated with impaired left ventricular systolic performance in premature infants weighing less than 1000 g[J]. J Thorac Cardiovasc Surg , 2010, 140 (1) : 150–157. DOI:10.1016/j.jtcvs.2010.01.011 |
| [14] | Kabra NS, Schmidt B, Roberts RS, et al. Neurosensory impairment after surgical closure of patent ductus arteriosus in extremely low birth weight infants:results from the Trial of Indomethacin Prophylaxis in Preterms[J]. J Pediatr , 2007, 150 (3) : 229–234. DOI:10.1016/j.jpeds.2006.11.039 |
| [15] | Rolland A, Shankar-Aguilera S, Diomandé D, et al. Natural evolution of patent ductus arteriosus in the extremely preterm infant[J]. Arch Dis Child Fetal Neonatal Ed , 2015, 100 (1) : F55–F58. DOI:10.1136/archdischild-2014-306339 |
| [16] | Herrman K, Bose C, Lewis K, et al. Spontaneous closure of the patent ductus arteriosus in very low birth weight infants following discharge from the neonatal unit[J]. Arch Dis Child Fetal Neonatal Ed , 2009, 94 (1) : F48–F50. |
| [17] | Nemerofsky SL, Parravicini E, Bateman D, et al. The ductus arteriosus rarely requires treatment in infants >1000 grams[J]. Am J Perinatol , 2008, 25 (10) : 661–666. DOI:10.1055/s-0028-1090594 |
| [18] | 杜金凤, 刘田田, 武辉. 早期早产儿动脉导管未闭发生的危险因素的病例对照研究[J]. 中国当代儿科杂志 , 2016, 18 (1) : 15–19. |
| [19] | McPherson C, Gal P, Ransom JL, et al. Indomethacin pharmacodynamics are altered by surfactant:a possible challenge to current indomethacin dosing guidelines created before surfactant availability[J]. Pediatr Cardiol , 2010, 31 (4) : 505–510. DOI:10.1007/s00246-009-9628-6 |
| [20] | El Hajjar M, Vaksmann G, Rakza T, et al. Severity of the ductal shunt:a comparison of different markers[J]. Arch Dis Child Fetal Neonatal Ed , 2005, 90 (5) : F419–F422. DOI:10.1136/adc.2003.027698 |
| [21] | McNamara PJ, Sehgal A. Towards rational management of the patent ductus arteriosus:the need for disease staging[J]. Arch Dis Child Fetal Neonatal Ed , 2007, 92 (6) : F424–F427. DOI:10.1136/adc.2007.118117 |
| [22] | Su BH, Watanabe T, Shimizu M, et al. Echocardiographic assessment of patent ductus arteriosus shunt flow pattern in premature infants[J]. Arch Dis Child Fetal Neonatal Ed , 1997, 77 (1) : F36–F40. DOI:10.1136/fn.77.1.F36 |
 2016, Vol. 18
2016, Vol. 18