2. 中江县人民医院儿科, 四川 中江 618100 ;
3. 首都医科大学附属北京儿童医院/北京市儿科研究所/儿科学国家重点学科/教育部儿科重大疾病研究重点实验室/国家呼吸系统疾病临床医学研究中心/儿童呼吸道感染性疾病研究北京市重点实验室, 北京 100045
呼吸道感染是儿童最常见的感染性疾病,也是导致儿童抗菌药物使用频率和数量最高的疾病。在儿童呼吸道感染细菌病原中,卡他莫拉菌常位于肺炎链球菌和流感嗜血杆菌之后,是第3 位致病菌[1-3],该菌还可引起中耳炎、心内膜炎、败血症、脑膜炎等[4]。随着肺炎链球菌和b 型流感嗜血杆菌疫苗的推广普及,卡他莫拉菌可能成为一个重要病原。已有一些研究表明卡他莫拉菌的耐药性有越来越严重的趋势,但因为检测方法、判定标准不统一,不同地区报道数据差异较大[5-9]。本研究检测中江县人民医院儿科住院的呼吸道感染儿童鼻咽部卡他莫拉菌的携带情况,并对分离株进行抗生素敏感性检测,了解卡他莫拉菌的耐药性状况,为临床用药提供参考。
1 资料与方法 1.1 研究对象2015 年1~12 月四川省中江县人民医院儿科共收治住院患儿2 750 例,其中呼吸道感染患儿2600 例。符合以下标准者纳入本研究:(1)年龄1 个月至14 岁;(2)病程<3 d;(3)具备发热、咳嗽表现;(4)获得患儿父母或法定监护人的知情同意采集鼻咽拭子。
排除标准包括:(1)现存的或潜在的可能会影响采集鼻咽拭子的情况(如出血体质、重度呼吸窘迫和其他临床医师认定的因素);(2)虽然具备发热、咳嗽表现,但同时具有明显的呼吸系统以外的异常临床表现,如腹泻、脱水、反复抽搐、喷射性呕吐等;(3)同一患儿只能参加一次本试验。
最终入组患儿1 082 例,其中男642 例,女440 例,年龄为1 个月至 14 岁。
1.2 标本采集经监护人知情同意后采集鼻咽拭子。拭子采集后立即放入脱脂奶粉- 胰蛋白胨- 葡萄糖- 甘油(skim milk-tryptoneglucose-glycerol,STGG)转运培养基中,并于2 h 内置于35℃、5% CO2 孵箱中孵育2 h,然后-40℃冻存。分别于2015 年6 月和12 月底转运至北京儿童医院微生物研究室进行细菌分离培养。
1.3 细菌分离、培养和鉴定标本解冻后震荡混匀,取20 μL 接种到含5%脱纤维羊血TSA 琼脂(OXOID,英国)平板,于35℃、5% CO2 孵箱中孵育。培养24 h 及48 h 后检视平板,挑选中等大小、灰白色、光滑、可用接种环平行推移的菌落进一步鉴定,镜检为革兰阴性双球菌,氧化酶试验、触酶试验、DNA 酶试验及硝酸盐还原试验均为阳性者鉴定为卡他莫拉菌。
1.4 β- 内酰胺酶和抗生素敏感性检测用头孢硝噻吩纸片法检测分离株是否产β- 内酰胺酶。
采用E-test 法检测菌株对氨苄西林、阿莫西林- 克拉维酸、头孢呋辛、头孢他啶、头孢吡肟、环丙沙星、红霉素和美罗培南的最低抑菌浓度(MIC)值,采用纸片扩散法检测磺胺甲噁唑- 甲氧苄啶、氯霉素和四环素的敏感性。药敏培养基为Mueller-Hinton(英国OXOID 公司)加5% 脱纤维羊血,25 mL/90 mm 平皿。质控菌株为肺炎链球菌ATCC49619。
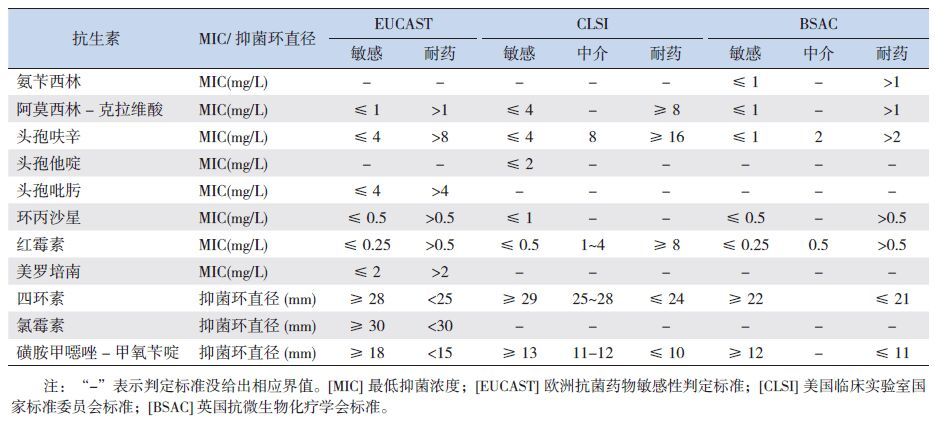
目前没有统一的卡他莫拉菌药敏判定标准,欧洲抗菌药物敏感性判定标准(EuropeanCommittee on Antimicrobial Susceptibility Testing,E U C A S T 。http://www.eucast.org/clinical_breakpoints/)、美国临床实验室国家标准委员会(Clinical and Laboratory Standards Institute,CLSI)标准[10] 和英国抗微生物化疗学会(British Societyfor Antimicrobial Chemotherapy,BSAC)标准[11] 中选择的抗生素种类以及敏感性界值都有所不同。本研究结合3 种判读标准解读检测结果,所检测的抗生素及其判定标准见表 1。
| 表 1 本研究检测的抗生素及其敏感性判定的EUCAST、CLSI 和BSAC 标准 |
1.5 统计学分析
采用WHONET 5.6 软件录入抗生素敏感性检测数据,并进行敏感性分析。采用SPSS 16.0 统计软件进行统计学分析。计数资料用百分率(%)表示,组间比较采用χ2 检验或Fisher 确切概率法。P<0.05 表示差异有统计学意义。
2 结果 2.1 卡他莫拉菌携带率研究期间共收集到鼻咽拭子标本1 082 份,分离出卡他莫拉菌77 株,总携带率为7.12%(77/1 082)。男性患儿和女性患儿卡他莫拉菌的分离阳性率分别为6.7%(43/642)和7.7%(34/440),差异无统计学意义(χ2=0.419,P=0.518)。
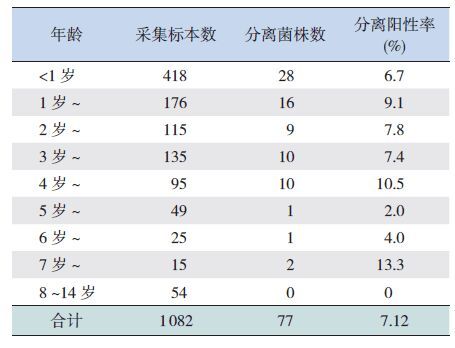
不同年龄呼吸道感染儿童鼻咽部携带卡他莫拉菌状况见表 2。8 岁以上儿童中收集到的54 份鼻咽拭子标本没有分离到卡他莫拉菌。8 岁以下各个年龄组儿童均有检出卡他莫拉菌,其携带率没有明显的年龄分布规律。按年龄段分析,<3 岁婴幼儿阳性率为7.5%(53/709),学龄前(3 岁至6 岁前)儿童阳性率为7.5%(21/279),6~14 岁儿童阳性率为3.2%(3/94),卡方检验显示3 个年龄组儿童携带率差异无统计学意义(χ2=2.400,P=0.301)。
| 表 2 不同年龄组呼吸道感染儿童鼻咽部携带卡他莫拉菌状况 |
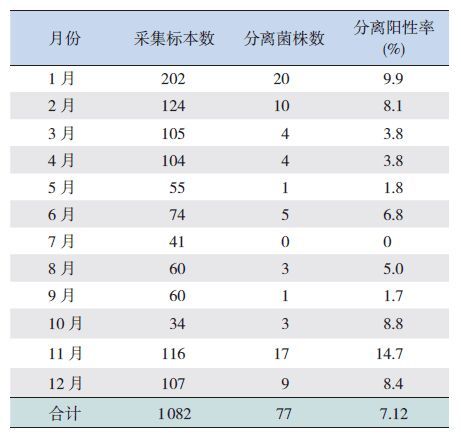
各个月份卡他莫拉菌分离阳性率见表 3。1 月、2月、10 月、11 月及12 月分离阳性率较高,其中11 月最高,达14.7%。
| 表 3 各个月呼吸道感染儿童鼻咽部卡他莫拉菌分离状况 |
2.2 抗生素敏感性检测结果
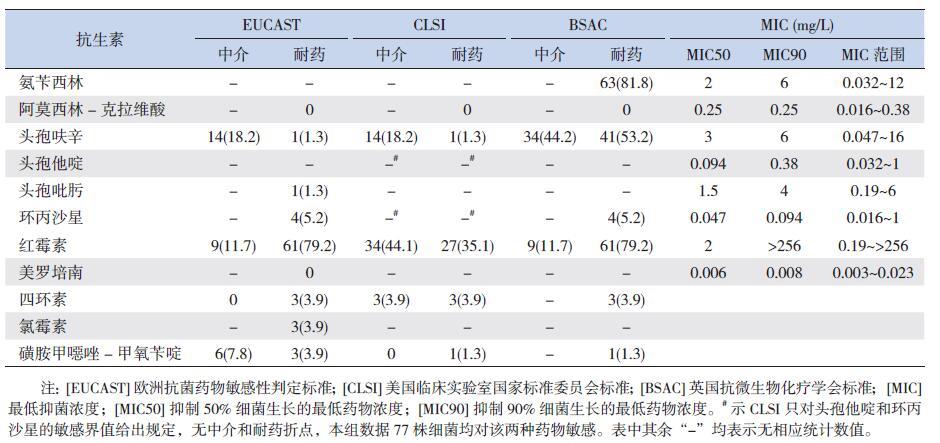
所有77 株卡他莫拉菌均产β- 内酰胺酶,产酶率为100%。
分离株对检测的11 种常见抗菌药物的敏感性见表 4。无论使用哪种判读标准,所有菌株对阿莫西林- 克拉维酸均敏感;对环丙沙星和四环素的敏感率均>95.0%;而菌株对红霉素的敏感性较差,MIC50 值为2 mg/L,MIC90>256 mg/L。根据EUCAST 和CLSI 标准,分离株对所检测的3 种头孢菌素均较敏感(>80%),但根据BSAC 标准判读时,菌株对头孢呋辛的敏感率仅为2.6%,中介率和耐药率分别达到44.2% 和53.2%,氨苄西林耐药率为81.8%。
| 表 4 77 株菌株对11 种常见抗菌药物的耐药性 [n(%)] |
3 讨论
本研究显示,本组病例住院呼吸道感染儿童卡他莫拉菌携带率为7.12%,该携带率低于宁夏银川[8]、湖北[9]、河北[12] 的报道结果(分别为11.6%、11.13%、11.0%)。本研究中8 岁以下儿童各个年龄组的携带率无明显的年龄分布规律,与以往其他地区[9, 13] 报道的3 岁以下婴幼儿携带率较高不太一致。这可能与本研究中无法实现在当地进行细菌分离培养有关,采集到的鼻咽拭子只能-40℃冻存,每半年一次转运到北京儿童医院进行分离培养,整个过程不排除会有部分卡他莫拉菌在冻存或转运过程中死亡,因此,本研究总的携带率数据可能比真实的携带率偏低,各个年龄段的分离率也可能受到影响。但由于掺杂了各个月份本身分离率的差异等其他因素,单凭本次研究结果很难断定哪些因素是造成该研究结果与其他报道数据不太一致的主要原因,本地区的真实携带状况还需要进一步研究证实。另外,本结果显示卡他莫拉菌分离高峰出现在冬季和秋冬、冬春交替的月份(10 月至次年2 月),与其他研究报告结果相符[9, 12-15]。
本研究中分离到的77 株菌株全部产β- 内酰胺酶,与近年来报道的卡他莫拉菌高产酶率相符(96.5%~100%)[3, 16-18]。EUCAST 标准认为卡他莫拉菌产β- 内酰胺酶检测阳性即可判定为氨苄西林耐药。本研究中参照BSAC 判定标准时,分离株对氨苄西林的耐药率为81.8%,表明产酶率和BSAC氨苄西林MIC 判断的耐药率之间存在差异,临床报告检测结果时应予以注意。同样参考BSAC 标准时,巴基斯坦采用琼脂稀释法检测出97 株卡他莫拉菌株对氨苄西林的耐药率为84.5%[19];北京地区王艳等[20] 采用纸片扩散法检测出79 株卡他莫拉菌对氨苄西林的耐药率为89.2%,本研究结果与之接近。
在卡他莫拉菌抗生素敏感性研究中常使用到3种判定标准:EUCAST、CLSI 和BSAC,国内临床实验室在报告细菌耐药性时常参照CLSI 标准。以CLSI 标准判断,本研究中卡他莫拉菌分离株均对阿莫西林- 克拉维酸、头孢他啶及环丙沙星敏感,对磺胺甲噁唑- 甲氧苄啶的敏感率也高达98.7%,提示经验治疗时仍可选用这些抗菌药物。不同标准下,头孢呋辛的不敏感率明显不同,CLSI 标准下,头孢呋辛的中介率和耐药率分别为18.2% 和1.3%,而依据BSAC 标准时,二者分别高达44.2% 和53.2%,仅2.6% 的菌株敏感,这种情况会对临床选药造成很大的困惑。另外,由于判定标准的差异,也使得不同研究结果之间难于比较。综合来看,几个已有报告与本研究结果都显示卡他莫拉菌对第三代和第四代头孢菌素(如头孢曲松、头孢他啶)及阿莫西林- 克拉维酸100% 敏感[6, 13, 18, 21]。
不论采用哪种判定标准,卡他莫拉菌对红霉素的敏感性都较差。依据CLSI 判读时,分离株对红霉素的不敏感率为79.2%,根据EUCAST或BSAC 判断时,其不敏感率更是高达90.9%,且超过三分之一的菌株(27/77,35.1%)MIC 值>256 mg/L。文献报道,卡他莫拉菌23S rRNA 基因A2330T[22-23] 和A2058T[24] 的突变可能是导致该菌对大环内酯类抗生素耐药的主要原因。我国儿科报道的其他呼吸道病原,如肺炎链球菌、流感嗜血杆菌、肺炎支原体对红霉素等大环内酯类抗生素耐药率都很高,应该严格掌握此类抗生素的经验使用指征。
综上所述,本组病例呼吸道感染患儿鼻咽部携带卡他莫拉菌所有分离株产β- 内酰胺酶,对阿莫西林- 克拉维酸全部敏感,对第三代和第四代头孢菌素、磺胺甲噁唑- 甲氧苄啶敏感率高,但多对氨苄青霉素、头孢呋辛和红霉素耐药。卡他莫拉菌抗生素敏感性检测结果的判断标准存在较大差异,需进一步研究,尽快制定出适合临床使用的统一标准。
| [1] | Wang H, Chen M, Xu Y, et al. Antimicrobial susceptibility of bacterial pathogens associated with community-acquired respiratory tract infections in Asia:report from the Community-Acquired Respiratory Tract Infection Pathogen Surveillance (CARTIPS) STUDY,2009-2010[J]. Int J Antimicrob Agents , 2011, 38 (5) : 376–383. DOI:10.1016/j.ijantimicag.2011.06.015 |
| [2] | 漆坚. 流感嗜血杆菌、肺炎链球菌和卡他莫拉菌的耐药性分析[J]. 实验与检验医学 , 2013, 31 (6) : 559–560. |
| [3] | 张泓, 孔菁, 王传清, 等. 2010中国CHINET流感嗜血杆菌和卡他莫拉菌耐药性监测[J]. 中国感染与化疗杂志 , 2012, 12 (3) : 180–184. |
| [4] | Aebi C. Moraxella catarrhalis-pathogen or commensal?[J]. Adv Exp Med Biol , 2011, 697 : 107–116. DOI:10.1007/978-1-4419-7185-2 |
| [5] | Morrissey I, Maher K, Williams L, et al. Non-susceptibility trends among Haemophilus influenzae and Moraxella catarrhalis from community-acquired respiratory tract infections in the UK and Ireland,1999-2007[J]. J Antimicrob Chemother , 2008, 62 (Suppl 2) : ii97–ii103. |
| [6] | Bandet T, Whitehead S, Blondel-Hill E, et al. Susceptibility of clinical Moraxella catarrhalis isolates in British Columbia to six empirically prescribed antibiotic agents[J]. Can J Infect Dis Med Microbiol , 2014, 25 (3) : 155–158. |
| [7] | 潘韶霞, 徐洪玉, 潘韶华, 等. 卡他莫拉菌的致病性及耐药性的临床研究[J]. 中华医院感染学杂志 , 2003, 13 (6) : 583–585. |
| [8] | 袁少伟, 李慧. 儿童呼吸道卡他莫拉菌感染分布及耐药分析[J]. 宁夏医学杂志 , 2014, 36 (5) : 451–453. |
| [9] | 李振国, 贵琳, 黄洋, 等. 儿童卡他莫拉菌呼吸道感染的耐药性研究[J]. 中华医院感染学杂志 , 2016, 26 (1) : 185–187. |
| [10] | Clinical and Laboratory Standards Institute (CLSI).Methods for Antimicrobial Dilution and Disk Susceptibility Testing of Infrequently Isolated or Fastidious Bacteria;Approved Guideline[S].M45-A,2014,26(19):28-29. |
| [11] | Andrews JM;BSAC Working Party on Susceptibility Testing. BSAC standardized disc susceptibility testing method (version 8)[J]. J Antimicrob Chemother , 2009, 64 (3) : 454–489. DOI:10.1093/jac/dkp244 |
| [12] | 杨海娟, 陈霞, 吴佳辉, 等. 患儿呼吸道感染91例卡他莫拉菌及耐药性分析[J]. 陕西医学杂志 , 2015, 44 (5) : 527–529. |
| [13] | 车大钿, 张泓, 陆权, 等. 急性下呼吸道感染患儿卡他莫拉菌耐药性与bro基因分型研究[J]. 中国实用儿科杂志 , 2009, 24 (8) : 606–609. |
| [14] | 张莉萍, 李贺扬, 袁达康, 等. 东莞市12月~18月龄健康婴幼儿鼻咽部肺炎链球菌、流感嗜血杆菌及卡他莫拉菌携带状况调查[J]. 中国卫生检验杂志 , 2011, 21 (2) : 496–498. |
| [15] | 孙慧明, 周卫芳, 季伟, 等. 苏州地区下呼吸道感染住院患儿卡他莫拉菌感染与气候因素相关性研究[J]. 临床儿科杂志 , 2014, 32 (6) : 524–527. |
| [16] | 王频佳, 谢成彬, 吴雨露. 儿童呼吸道卡他莫拉菌分离株耐药性与BRO基因分型研究[J]. 临床儿科杂志 , 2013, 31 (8) : 719–722. |
| [17] | 林爱心, 谭南, 杨晓华, 等. 997例卡他莫拉菌的分布情况及药物敏感性分析[J]. 国际检验医学杂志 , 2016, 37 (3) : 376–377. |
| [18] | 罗宇鹏. 住院儿童呼吸道标本病原菌分布及耐药性分析[J]. 现代临床医学 , 2016, 42 (1) : 52–54. |
| [19] | Sheikh SO, Fasih N, Irfan S, et al. β-Lactamase production and antimicrobial susceptibility pattern of Moraxella catarrhalis isolates:report from Pakistan[J]. Asian Pac J Trop Med , 2014, 7 (S1) : S228–S231. |
| [20] | 王艳, 袁林, 沈叙庄, 等. 北京地区呼吸道感染患儿卡他莫拉菌携带情况及耐药性分析[J]. 中国抗感染化疗杂志 , 2003, 3 (6) : 332–335. |
| [21] | Abdullah FE, Ahuja KR, Kumar H. Prevalence and emerging resistance of Moraxella catarrhalis in lower respiratory tract infections in Karachi[J]. J Pak Med Assoc , 2013, 63 (11) : 1342–1344. |
| [22] | Liu Y, Xu H, Xu Z, et al. High-level macrolide-resistant Moraxella catarrhalis and development of an allele-specific PCR assay for detection of 23S rRNA gene A2330T mutation:a three-year study at a Chinese tertiary hospital[J]. Microb Drug Resist , 2015, 21 (5) : 507–511. DOI:10.1089/mdr.2014.0217 |
| [23] | Iwata S, Sato Y, Toyonaga Y, et al. Genetic analysis of pediatric clinical isolate of Moraxella catarrhalis with resistance to macrolides and quinolones[J]. J Infect Chemother , 2015, 21 (4) : 308–311. DOI:10.1016/j.jiac.2014.11.002 |
| [24] | Kasai A, Ogihara S, Yamada K, et al. Prevalence and molecular analysis of macrolide-resistant Moraxella catarrhalis isolates in Japan,following emergence of the highly macrolide-resistant strain NSH1 in 2011[J]. J Med Microbiol , 2015, 64 (7) : 708–713. DOI:10.1099/jmm.0.000076 |
 2016, Vol. 18
2016, Vol. 18