侵袭性真菌病(invasive fungal disease,IFD)是指真菌侵袭了原本处于无菌状态的深部组织、器官和/ 或血液,在其中生长繁殖且造成局部组织损害、器官功能障碍和全身感染的过程[1-2]。近年来,随着广谱抗生素、免疫抑制剂、糖皮质激素、抗肿瘤药物的广泛应用,侵袭性操作的增多以及新型治疗手段如实体器官或造血干细胞移植的开展,IFD 逐渐被关注。土耳其一项研究显示,急性淋巴细胞白血病患儿IFD 的发病率为24%[3];日本的一项调查指出,在血液病/ 恶性肿瘤基础上合并IFD的患儿中,病死率高达48.2%[4]。关于IFD,以往的研究多集中在有血液病/ 恶性肿瘤等基础疾病的人群,对于无基础疾病的IFD 关注较少、警惕性不够,而且此类患儿临床表现缺乏特异性,病原确诊难度大,常常错过最佳治疗时机,影响预后。本研究对四川大学华西第二医院儿科近10 年住院儿童中诊断为IFD 并且无基础疾病的临床资料进行回顾性分析,旨在探讨无基础疾病IFD 的临床特点,以利早期诊断,及时治疗。
1 资料与方法 1.1 研究对象通过已建立的儿童IFD 数据库,收集整理2005 年1 月至2015 年9 月四川大学华西第二医院儿科住院的IFD 患儿的临床资料。
1.2 诊断标准参考国内外IFD 的诊断标准[2, 5-6],本研究纳入的确诊、临床诊断、拟诊病例均符合以下标准:(1)确诊:具有组织病理学证据,即相关组织存在损害时,针吸或活检组织病理可见菌丝或球形体,非粘膜组织采用针吸或活检病理可见酵母菌细胞和/ 或假菌丝;在通常无菌的体腔液或组织(如血液、脑脊液、肺组织、深部淋巴结等)中真菌培养呈阳性且具有相关症状、体征。(2)临床诊断:不符合确诊条件,但同时满足以下3 项诊断标准:①宿主和/ 或环境(危险)因素:接受侵入性操作(包括血管内置管、留置导尿管、气管插管等);环境危险因素:密切接触有真菌存在的环境(如鸽子粪等);近期发生中性粒细胞缺乏并持续10 d 以上;具有侵袭性真菌感染病史:曾被诊断为IFD,包括拟诊,临床诊断和确诊。②临床证据:发热、咳嗽和肺部体征经抗菌药物治疗无好转或好转后再次出现;肺部影像学至少存在以下表现之一:致密、边界清楚的病变,伴或不伴晕轮征、新月征、空洞;支气管镜检发现:气管支气管溃疡、结节、伪膜、斑块或结痂;中枢神经系统影像学检查提示局灶性病变和/ 或脑膜强化。③微生物学证据:合格痰标本直接镜检发现菌丝,且培养连续2 次以上分离到同种真菌;支气管肺泡灌洗液经直接镜检发现菌丝,真菌培养阳性;合格痰液或支气管肺泡灌洗液直接镜检或培养发现新型隐球菌;血清(1,3)-β-D- 葡聚糖检测(G 试验)阳性;血、支气管肺泡灌洗液、脑脊液半乳甘露聚糖抗原检测(GM 试验)呈阳性。(3)拟诊:至少符合上述1 项宿主和/ 或环境因素、1项临床证据,但缺乏微生物学证据。排除标准:新生儿。有基础疾病,如血液病/ 恶性肿瘤(包括接受造血干细胞移植),实体器官移植并长期服用免疫抑制剂,其他系统慢性疾病(如肾病综合征,慢性肾衰竭等)。尽量排除能解释该病病情的其他病因,如结核、HIV 感染等。
1.3 统计学分析采用SPSS 18.0 软件进行统计学处理。正态分布的计量资料用均值± 标准差((x±s))表示,非正态分布的计量资料用中位数表示;计数资料采用百分率(%)表示。计数资料的组间比较采用Fisher 确切概率法。P<0.05 为差异具有统计学意义。
2 结果 2.1 一般资料2005 年1 月至2015 年9 月我院儿科住院患者中诊断为IFD 的共118 例,排除有基础疾病的患儿55 例(46.6%) 以及新生儿14 例(11.9%),纳入本研究的患儿49 例(41.5%):其中确诊20例(脑脊液培养,血培养或淋巴结活检获得真菌病原)、临床诊断17 例(有宿主和/ 或环境因素、相应的临床证据以及微生物学证据)、拟诊12 例(有宿主和/ 或环境因素以及相应的临床证据)。49 例患儿中,男性28 例、女性21 例,年龄2 个月至15 岁(中位年龄为4.1 岁)。病程为8 d 至7个月(中位病程为40 d),从发病到诊断为IFD的时间为1~90 d(中位时间为20 d),住院日为2~79 d(中位住院日为18 d)。
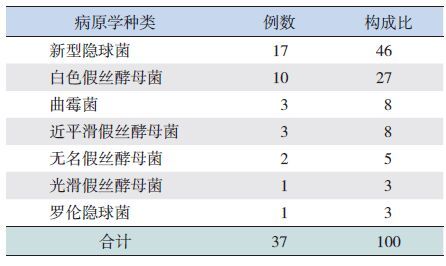
2.2 真菌侵袭部位及病原学分类49 例患儿中,37 例(76%)患儿有病原学依据,其前3 位的病原菌分别为新型隐球菌(46%)、白色假丝酵母菌(27%)、曲霉菌及近平滑假丝酵母菌(均占8%),见表 1。
| 表 1 37 例确诊或临床诊断IFD 的病原及构成比 (%) |
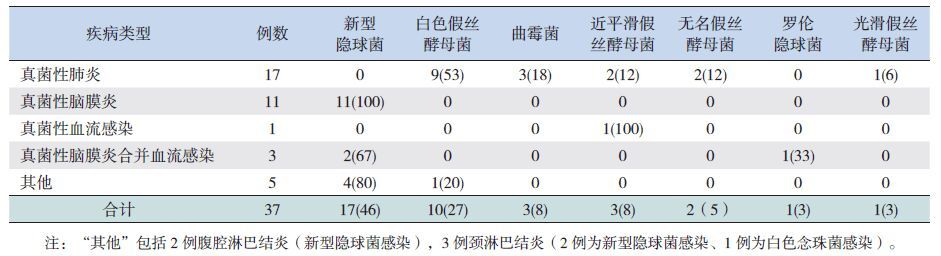
37 例确诊或临床诊断的患儿中,以真菌性肺炎最为多见(46%,17/37)、其次为真菌性脑膜炎(38%,14/37)、真菌性血流感染(11%,4/37),3 例(8%,3/37)患儿发生多部位真菌感染:表现为同时侵袭脑膜和血流。在17 例真菌性肺炎中,白色假丝酵母菌有9 例(53%),曲霉菌3 例(18%),近平滑假丝酵母菌以及无名假丝酵母菌各2 例(均占12%)。见表 2。
| 表 2 37 例确诊或临床诊断IFD 的疾病类型以及病原分布 [ 例(%)] |
2.3 IFD 的高危因素
49 例患儿中,31 例(63%)患儿住院日≥ 2 周;14 例(29%)患儿半年内住院次数≥ 2 次;12 例(25%)患儿在诊断IFD 之前有ICU 住院史;19例(39%)患儿住院期间接受过侵袭性操作,包括中央静脉置管(12%)、气管插管(6%)、内窥镜检查(8%)、泌尿道插管(2%)或两项及以上侵袭性操作(10%:中央静脉置管联合内窥镜检查1 例,联合气管插管2 例,气管插管联合内窥镜检查与泌尿道插管1 例,联合内窥镜检查与中央静脉置管1 例)。
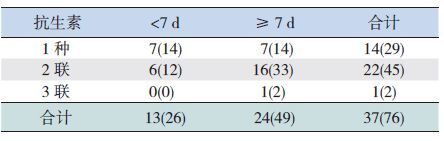
37 例(76%,36/49)患儿在明确IFD 诊断之前使用过抗生素,其中24 例(49%)抗生素使用时间≥ 7 d。平均使用2.9±1.1 种抗生素,以头孢菌素类、碳青霉烯类、多肽类、青霉素类以及大环内脂类抗生素为主。23 例(47%)患儿使用过2或以上抗生素联合治疗,以万古霉素联合亚胺培南或头孢类抗生素为主的有12 例(25%)。见表 3。
| 表 3 49 例IFD 患儿诊断前抗生素使用情况 [ 例(%)] |
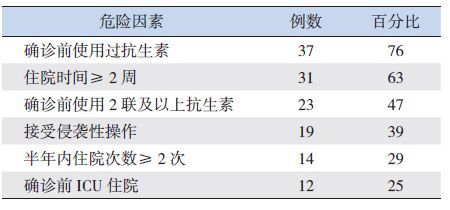
综上,在本组患儿中,最常见的危险因素为诊断前抗生素运用(占76%,47% 的患儿在诊断前用过2 联及以上抗生素)、长时间住院(63%)以及住院期间接受侵袭性操作(39%)。此外,半年内住院次数≥ 2 次(29%)以及诊断本病之前的ICU 住院史(25%)亦为常见的危险因素。见表 4。
| 表 4 49 例患儿的宿主危险因素分布情况 (%) |
2.4 临床表现
无基础疾病的IFD 患儿临床表现不典型。49例患儿中,40 例(82%)患儿出现抗生素治疗效果不佳或反复高热,其中28 例(57%)患儿发热≥ 20 d;肺部受侵袭的患儿主要表现为咳嗽(16 例,其中5 例合并咳痰、3 例合并气促)、气促(1 例);中枢神经系统受累的患儿主要表现为头痛(8 例,其中2 例合并呕吐、1 例合并抽搐)、呕吐(2 例)、抽搐(2 例)、意识障碍(2 例)。此外,27 例(55%)患儿合并细菌感染。
2.5 G 试验对儿童IFD 的诊断意义在49 例IFD 中有24 例(49%)患儿进行了G 试验检查,阳性17 例(71%):其中确诊组2 例、临床诊断组5 例、拟诊组10 例。且行G 试验的患儿,均有不同热程的发热。根据定义[7]:热程≤ 7 d 为急性发热期,热程>7 d 为非急性发热期。7 例患儿在急性发热期内行G 试验,阳性率为71%(5/7);17 例患儿在非急性发热期内行G 试验,阳性率为70.6%(12/17),两者阳性率的差异无统计学意义。
2.6 治疗及转归本研究中49 例患儿均接受了抗真菌治疗,治疗药物主要为氟康唑、伏立康唑、两性霉素B 以及5- 氟胞嘧啶。45 例(92%)患儿以单药治疗为主,4 例(8%)患儿接受联合治疗方案(两性霉素B 和5- 氟胞嘧啶)。49 例患儿中,4 例(8%)痊愈,38 例(78%)好转出院,5 例(10%)要求出院,2 例(4%)死亡。38 例好转出院患儿中,2例失访;33 例在我院门诊或其他医院继续接受抗真菌治疗,已痊愈停药;3 例患儿仍在进一步治疗随访中。5 例要求出院的患儿3 例死亡、2 例失访。
3 讨论近年来,儿童IFD 因其越来越高的发病率和病死率而备受重视,其主要的致病菌为念珠菌(亦称假丝酵母菌)、曲霉菌以及隐球菌。据文献报道[8],在接受化疗的肿瘤患儿中,IFD 的主要病原为念珠菌(以白色假丝酵母菌为主)及曲霉菌;而国内研究显示[9],重症监护室有基础疾病的IFD 儿童主要病原依次为白色假丝酵母菌、曲霉菌以及毛霉菌。本研究显示,无基础疾病的IFD 患儿的主要病原菌分别为新型隐球菌、白色假丝酵母菌、曲霉菌以及近平滑假丝酵母菌。与有基础疾病的IFD患儿相比,致病菌类似,但新型隐球菌例数较多,可能因为本研究有14 例(14/37)确诊为真菌性脑膜炎,而新型隐球菌为中枢神经系统真菌感染最常见的病原菌;曲霉菌例数较少,可能与曲霉菌感染常发生于有基础疾病的情况下有关 [10];念珠菌属中,仍以白色假丝酵母菌为主、占27%,非白色假丝酵母菌类念珠菌比例有增加趋势、占16%(以光滑假丝酵母菌为主),与国外报道相符[11]。光滑假丝酵母菌感染多发生于广谱抗生素使用后的病人中[12],而本研究76% 的患儿在确诊IFD 前使用过抗生素。本研究37 例确诊或临床诊断的IFD 患儿中,以真菌性肺炎最为多见,提示肺部为最容易受到真菌侵袭的部位,与国内外文献报道相符合[13-14]。
IFD 的发生与宿主、入侵真菌的毒力和数量、环境及医源性因素均有关。住院时间长、ICU 住院史、营养不良、慢性腹泻、侵入性操作、抗生素以及激素的长期使用、接受过外科手术等均为IFD的危险因素[15-16]。本研究结果与之相符。49 例患儿中,76% 的患儿诊断IFD 之前使用过抗生素(47% 的患儿使用过2 联及以上抗生素)、 63%的患儿住院时间≥ 2 周、39% 的患儿住院期间接受过侵袭性操作、29% 的患儿半年内住院次数≥ 2次、25% 的患儿在诊断之前有ICU 住院史。在上述因素中以长期大量使用抗生素最为突出。据文献报道,在确诊IFD 前两周使用过万古霉素或抗厌氧菌制剂3 d 以上的患儿念珠菌血症患病几率较高[17]。本研究中,37 例(76%)患儿在明确IFD诊断之前使用过抗生素,23 例(47%)患儿联合使用2 种或以上抗生素,24 例(49%)患儿抗生素使用天数7 d 以上。长期大量使用抗生素,尤其是广谱抗生素,可能打破患儿体内正常菌群稳态,破坏免疫屏障,导致机体抵抗条件致病菌能力受损。
对于无基础疾病的患儿,IFD 的临床表现缺乏特异性,抗生素治疗效果欠佳或反复发热往往是此类患儿最为突出的表现,不明原因的发热可作为诊断念珠菌血症的线索之一,抗生素抵抗的长期发热常常是念珠菌感染的主要症状之一[18-19]。本研究中,40 例(82%)患儿均有抗生素治疗效果欠佳或不明病原的反复发热症状,其中28 例(57%)患儿发热持续时间≥ 20 d。
深部组织的病检或无菌体液的真菌培养是确诊IFD 的金标准,但有创性检查开展的难度、风险均较大,真菌培养也耗时、阳性率低,故临床上多采用包括G 实验的血清学检测方法为IFD 的临床诊断提供微生物学证据。据文献报道[20-21],G试验的敏感度和特异度均可达70%~80%。本研究中,24 例进行G 试验检测的患儿中17 例(71%)阳性,其敏感度与文献相符。此外,虽然在本研究中,急性发热期和非急性发热期行G 试验的阳性率差异无统计学意义,但由于本研究纳入的样本含量较少,产生的偏倚较大,故此结论尚需更大样本含量的临床研究进一步证实。
儿童IFD 的治疗药物包括以下4 类:多烯类、三唑类、棘白菌素类以及嘧啶类。氟康唑是治疗念珠菌病的首选药物;而针对隐球菌感染,主要选择两性霉素B、5- 氟胞嘧啶[6, 22]。本研究中隐球菌与念珠菌感染占绝大多数,抗真菌药物的选择主要以氟康唑、伏立康唑、两性霉素B 单用为主。而4 例接受两性霉素B 与5- 氟胞嘧啶联合治疗的患儿均为较严重的隐球菌脑膜炎患儿。此外,本研究显示,无基础疾病的IFD 患儿抗真菌治疗有效率高达86%,随访发现37 例患儿完全治愈,治愈率达75%。与有基础疾病患儿相比,抗真菌治疗有效率较为一致,但治愈率远远高于有基础疾病的患儿[9]。
综上所述,对于无基础疾病的IFD 患儿,病原以新型隐球菌、念珠菌为主,肺部为主要受累器官。在众多危险因素中,以长期大量使用抗生素较为突出。此类患儿临床症状不典型,实验室检查缺乏特异性,临床上诊断难度较大,但对抗真菌药物敏感,预后较好。因此,临床医师应警惕此类患儿的IFD,对于可疑患儿,应积极完善相关实验室检查,必要时做组织病理学活检,争取早期诊断,及时治疗,改善预后。
| [1] | 李光辉. 癌症和造血干细胞移植的免疫缺陷患者机会性侵袭性真菌感染诊断定义:国际共识[J]. 中国感染与化疗杂志 , 2007 (1) : 9–10. |
| [2] | De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Croup[J]. Clin Infect Dis , 2008, 46 (12) : 1813–1821. DOI:10.1086/590167 |
| [3] | Sahbudak Bal Z, Yilmaz Karapinar D, Karadas N, et al. Proven and probable invasive fungal infections in children with acute lymphoblastic leukaemia:results from an university hospital,2005-2013[J]. Mycoses , 2015, 58 (4) : 225–232. DOI:10.1111/myc.2015.58.issue-4 |
| [4] | Kobayashi R, Kaneda K, Sato T, et al. The clinical feature of invasive fungal infection in pediatric patients with hematologic and malignant diseases:a 10-year analysis at a single institution at Japan[J]. J Pediatr Hematol Oncol , 2008, 30 (12) : 886–890. DOI:10.1097/MPH.0b013e3181864a80 |
| [5] | 中华内科杂志编辑委员会. 血液病/恶性肿瘤患者IFD的诊断标准与治疗原则(第四次修订版)[J]. 中华内科杂志 , 2013, 52 (8) : 704–709. |
| [6] | 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童侵袭性肺部真菌感染诊治指南(2009版)[J]. 中华儿科杂志 , 2009, 47 (2) : 96–98. |
| [7] | Avner JR. Acute fever[J]. Pediatr Rev , 2009, 30 (1) : 5–13. DOI:10.1542/pir.30-1-5 |
| [8] | Yeh TC, Liu HC, Wang LY, et al. Invasive fungal infection in children undergoing chemotherapy for cancer[J]. Ann Trop Paediatr , 2007, 27 (2) : 141–147. DOI:10.1179/146532807X192516 |
| [9] | 蔡小芳, 孙继民, 董宗祈, 等. 儿童重症监护病房侵袭性真菌感染38例临床分析[J]. 中国当代儿科杂志 , 2013, 15 (8) : 644–648. |
| [10] | Tragiannidis A, Roilides E, Walsh TJ, et al. Invasive aspergillosis in children with acquired immunodeficiencies[J]. Clin Infect Dis , 2012, 54 (2) : 258–267. DOI:10.1093/cid/cir786 |
| [11] | Nucci M, Marr KA. Emerging fungal diseases[J]. Clin Infect Dis , 2005, 41 (4) : 521–526. DOI:10.1086/432060 |
| [12] | Pfaller MA, Diekema DJ. Epidemiology of invasive candidiasis:a persistent public health problem[J]. Clin Microbiol Rev , 2007, 20 (1) : 133–163. DOI:10.1128/CMR.00029-06 |
| [13] | 刘又宁, 佘丹阳, 孙铁英, 等. 中国1998年至2007年临床确诊的肺真菌病患者的多中心回顾性调查[J]. 中华结核和呼吸杂志 , 2011, 34 (2) : 86–90. |
| [14] | Ozsevik SN, Sensoy G, Karli A, et al. Invasive fungal infections in children with hematologic and malignant diseases[J]. J Pediatr Hematol Oncol , 2015, 37 (2) : e69–e72. DOI:10.1097/MPH.0000000000000225 |
| [15] | 母发光, 何海兰, 李晶. 儿童侵袭性肺部真菌感染危险因素分析[J]. 中国当代儿科杂志 , 2014, 16 (8) : 779–782. |
| [16] | Muskett H, Shahin J, Eyres G, et al. Risk factors for invasive fungal disease in critically ill adult patients:a systematic review[J]. Crit Care , 2011, 15 (6) : R287. DOI:10.1186/cc10574 |
| [17] | Zaoutis TE, Prasad PA, Localio AR, et al. Risk Factors and Predictors for Candidemia in Pediatric Intensive Care Unit Patients:Implications for Prevention[J]. Clin Infect Dis , 2010, 51 (5) : e38–e45. DOI:10.1086/652979 |
| [18] | Singhi S, Deep A. Invasive candidiasis in pediatric intensive care units[J]. Indian J Pediatr , 2009, 76 (10) : 1033–1044. DOI:10.1007/s12098-009-0219-6 |
| [19] | Jordán I, Hernandez L, Balaguer M, et al. C.albicans,C.parapsilosis and C.tropicalis invasive infections in the PICU:clinical features,prognosis and mortality[J]. Rev Esp Quimioter , 2014, 27 (1) : 56–62. |
| [20] | Onishi A, Sugiyama D, Kogata Y, et al. Diagnostic accuracy of serum 1,3-beta-D-glucan for pneumocystis jiroveci pneumonia,invasive candidiasis,and invasive aspergillosis:systematic review and meta-analysis[J]. J Clin Microbiol , 2012, 50 (1) : 7–15. DOI:10.1128/JCM.05267-11 |
| [21] | 张晓艳, 董方, 赵顺英, 等. 血浆1,3-β-D葡聚糖检测对儿童侵袭性真菌感染诊断价值[J]. 中国循证儿科杂志 , 2012, 7 (3) : 192–195. |
| [22] | 万朝敏, 罗双红. 儿童侵袭性真菌病诊治进展[J]. 中华实用儿科临床杂志 , 2012, 27 (22) : 1697–1700. |
 2016, Vol. 18
2016, Vol. 18