感染性腹泻是一种危害婴幼儿健康的重要疾病。细菌、病毒和寄生虫是引起婴幼儿感染性腹泻的三大主要病因,其中病毒性腹泻占80%。病毒性腹泻的发病人群以6 个月至2 岁婴幼儿为主,是儿童生长发育迟缓和死亡的常见病因[1]。Flewett等[2] 于1975 年运用电镜技术在急性胃肠炎患儿的粪便中首次发现了腺病毒(adenovirus,AdV),目前已发现腺病毒有57 个基因型,分属于7 个亚组(A~G)。AdV 引起的腹泻呈全球分布,其发病率仅次于轮状病毒和杯状病毒腹泻[3]。鉴于病毒性腹泻对儿童健康的巨大危害,本研究拟对我院收治的3 岁以下腹泻患儿进行AdV 检测,并对AdV的流行特征进行分析,以明确婴幼儿腹泻腺病毒基因型分布的特点。
1 资料与方法 1.1 研究对象收集2011 年11 月至2014 年11 月我院急性腹泻患儿425 例,采集粪便标本5 mL 或5 g,与磷酸盐缓冲液混合制成20% 的悬液,离心后取上清,-80℃保存备用。急性腹泻诊断参考世界卫生组织标准[4]。
1.2 基因组DNA 提取将冻融的粪便悬液8 000 转/min 离心,取上清150 μL,按照DNA Mini Kit 试剂盒(OMEGA)操作说明提取DNA,保存于-80℃冰箱备用。
1.3 AdV 核酸检测采用Go Taq Green Master Mix(Promega) 优化后扩增AdV 的A~F 6 个亚组的六邻体蛋白编码区(hexon)基因片段,片段大小为482 bp,上游引物(5'~3')TTCCCCATGGCICAYAACAC,下游引物(5'~3')CCTGGTAKCCRATRTTGTA,反应体系为25 μL,PCR 扩增条件为:94℃ 3 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35 个循环后72℃ 延伸10 min。扩增产物在1.5% 的琼脂糖凝胶以100 V 恒压电泳30 min,通过凝胶成像系统(GEImageQuant350,美国)观察AdV 的DNA 特异性扩增条带。
1.4 测序分析将AdV 检测阳性的PCR 产物送上海英俊生物有限公司进行测序,测得的碱基序列在BLAST 上进行比对寻找同源序列,再应用DNAstar 进行多重序列对比,应用MEGA5 的Neighbor-joining 模型构建系统进化树;bootstrap 为1 000,参考株均来自Genbank 中。
1.5 统计学分析统计学处理采用SPSS 19.0 软件。计数资料采用频数和百分比表示,组间比较采用χ2 检验。
P<0.05 为差异有统计学意义。
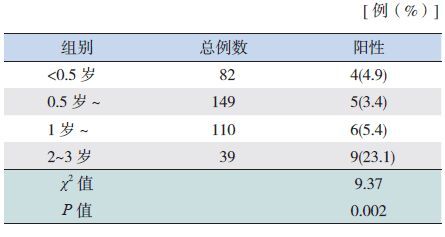
2 结果 2.1 腺病毒流行特征380 例标本中共检出AdV 24 例,检出率为6.3%(24/380),其中男性15 例、女性9 例,男女比例为1.6 : 1,不同性别腹泻患儿的AdV 检出率差异无统计学意义(χ2=0.27,P=0.599)。腹泻患儿各年龄组的腺病毒阳性率以2~3 岁组儿童最高(23.1%),差异具有统计学意义(P<0.05)。见表 1。
| 表 1 3 岁以下腹泻患儿不同年龄组AdV 检测结果比较例 |
2.2 腺病毒基因分型
对AdV 阳性的24 例进行基因测序比对:肠道AdV41 型(enteric adenovirus type 41,EAdV41)16 例(68%);非肠道腺病毒(non-EAdV)8 例(33%),其中AdV1 型2 例、AdV2 型2 例、AdV7 型1 例、AdV12 型2 例、AdV31 型1 例。见图 1。
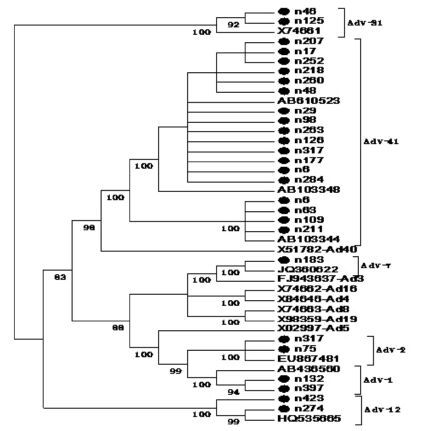
|
图 1 AdV 六邻体蛋白编码区核苷酸序列(482 bp)遗传进化树 |
3 讨论
婴幼儿腹泻是一组多病原、多病因的临床综合征,发病率高,是引起婴幼儿死亡的主要原因之一,其病原有细菌、病毒、原虫等,以病毒最为严重[5]。腺病毒是引起婴幼儿病毒性腹泻的重要病原体,仅次于轮状病毒。有研究表明,急性腹泻患儿粪便中AdV 的检出率为1.1%~12%,甚至无腹泻症状儿童的粪便中也可检测出AdV [6]。许多国家已将AdV 检测列入儿童腹泻病常规检测[7]。
本研究收集了我院近3 年的3 岁以下腹泻病例,其粪便AdV 的总检出率为 6.3%,低于北京地区(14.6%)及广州地区(15.5%)[6, 8],但高于成都地区(1.64%)[9],表明AdV 的感染呈现出一定的地区分布差异,可能与地区环境及人群的遗传和免疫背景差异有关[10]。
研究表明,AdV 易感人群为6 个月至2 岁的婴幼儿[11]。这与6 个月以后来自母体的抗体逐渐减少以及局部或全身免疫功能尚不成熟有关 [3, 12]。与以往研究略有不同的是,本研究AdV 检出率以2~3 岁组最高,这可能与本研究的对象仅来自一家医院、样本量相对较小有关[3, 10]。为此,我们拟将样本扩大至整个市区,以进一步确定本地区AdV感染的年龄分布特点。
65% 以上的腺病毒腹泻为肠道腺病毒所致,即F 亚属AdV40 和AdV41。近年来AdV40 的感染率逐渐下降,但AdV41 感染率却逐渐增加,达到90%以上,已成为腹泻病原的第一流行毒株[13]。腹泻病原中非肠道腺病毒也占了一定比例,以AdV2、3、5、8、31 型较为多见[5, 8, 11]。本研究检出的腺病毒中,AdV41 占 66.7%,未检出AdV40,同样也发现AdV1、AdV2、AdV7、AdV12和AdV31 型等非肠道腺病毒,与全球AdV 感染的血清型趋势一致。其中AdV7 型感染可引起婴幼儿急性呼吸道疾病,对于AdV12 型感染国内报道较少。有研究报道,AdV12 型可诱导体外培养的细胞转化,可引起新生啮齿类动物发生肿瘤,但目前缺乏有力证据表明该型与人类的癌症具有相关性[12, 14]。
综上所述,婴幼儿腺病毒腹泻常见于2~3 岁年龄段,AdV41 是主要流行优势株。因此,可将2~3 岁组婴幼腹泻患儿作为AdV 感染的重点人群,并加强对AdV41 型病毒进行感染监测。
| [1] | Favier AL, Schoehn G, Jaquinod M, et al. Structural studies of human enteric adenovirus type 41[J]. Virology , 2002, 293 (1) : 75–85. DOI:10.1006/viro.2001.1235 |
| [2] | Flewett TH, Boxall E. The hunt for viruses in infections of the alimentary system:an immunoelectron-microscopical approach[J]. Clin Gastroenterol , 1976, 5 (2) : 359–385. |
| [3] | 柳彩霞, 李奇凤, 贾娜尔, 等. 2011年乌鲁木齐地区婴幼儿腹泻轮状病毒和腺病毒感染调查[J]. 国际病毒学杂志 , 2012, 19 (2) : 60–63. |
| [4] | World Health Organization.The treatment of diarrhoea:a manual for physicians and other senior health workers[EB/OL].[2005].http://apps.who.int/iris/bitstream/10665/43209/1/9241593180.pdf. |
| [5] | 向静瑶, 李丹地, 李宇宁, 等. 肠道腺病毒的研究进展[J]. 中华实验和临床病毒学杂志 , 2014, 28 (3) : 239–240. |
| [6] | 邓间开, 王瑞莲, 罗欣, 等. 广州地区病毒性腹泻的病原分布和病毒基因分型调查[J]. 现代预防医学 , 2015, 42 (13) : 2393–2396. |
| [7] | Liu EB, Ferreyra L, Fischer SL, et al. Genetic analysis of a novel human adenovirus with a serologically unique hexon and a recombinant fiber gene[J]. PLoS One , 2011, 6 (9) : e24491. DOI:10.1371/journal.pone.0024491 |
| [8] | 刘立颍, 钱渊, 张又, 等. 2010年北京住院腹泻患儿腺病毒感染的研究[J]. 中华儿科杂志 , 2012, 50 (6) : 450–454. |
| [9] | 谢晓丽, 张伟, 廖雪春, 等. 成都地区婴幼儿病毒性腹泻分子流行病学研究[J]. 中华实验和临床病毒学杂志 , 2012, 26 (1) : 2–4. |
| [10] | 郑晓群, 黄燕燕, 彭颖, 等. 应用实时荧光聚合酶链反应检测婴幼儿腹泻标本中的腺病毒[J]. 中华流行病学杂志 , 2009, 30 (4) : 380–383. |
| [11] | 陈昌辉, 李茂军, 吴青, 等. 婴幼儿腹泻病的诊断和治疗[J]. 现代临床医学 , 2011, 37 (5) : 389–397. |
| [12] | Joshi D, Buehring GC. Are viruses associated with human breast cancer? Scrutinizing the molecular evidence[J]. Breast Cancer Res Treat , 2012, 135 (1) : 1–15. DOI:10.1007/s10549-011-1921-4 |
| [13] | 柳彩霞, 孙荷. 腺病毒感染所致婴幼儿腹泻的研究进展[J]. 国际病毒学杂志 , 2013, 20 (1) : 44–47. |
| [14] | Abbink P, Lemckert AA, Ewald BA, et al. Comparative seroprevalence and immunogenicity of six rare serotype recombinant adenovirus vaccine vectors from subgroups B and D[J]. J Virol , 2007, 81 (9) : 4654–4663. DOI:10.1128/JVI.02696-06 |
 2016, Vol. 18
2016, Vol. 18