2. 乐平市妇幼保健院儿科, 江西 乐平 333300
支气管哮喘(以下简称为哮喘)是由多种细胞和炎性介质共同参与的一种慢性气道炎性高反应性疾病。其确切发病机制尚未阐明,研究表明免疫调节功能异常为哮喘发病的主要因素[1]。潜态相关多肽(latency-associated peptide,LAP)是一种与转化生长因子(TGF)氨基末端非共价结合的前肽,两者结合后产生一种潜态的TGF-β 复合体,TGF-β 生物活性的激活需要该复合体的解离。最近,有报道称CD4+LAP+ 调节性T 细胞(CD4+LAP+Treg)是一种新的调节性细胞亚群,在体外可抑制效应T细胞的增殖,这些细胞通过IL-10 和TGF-β 介导其调节和抑制作用[2]。目前,CD4+LAP+Treg 细胞在某些自身免疫性疾病中已有相关研究,在小鼠模型研究中增加CD4+LAP+Treg 细胞的数量可以抑制实验性自身免疫性脑脊髓膜炎、系统性红斑狼疮等自身免疫性疾病的发展[3-4]。哮喘作为与自身免疫密切相关的疾病,设想CD4+LAP+Treg 这种新型的Treg 细胞与经典的Treg 细胞一样也在哮喘患儿中也存在异常。本研究中,我们通过观察哮喘患儿外周血CD4+LAP+Treg 细胞比例及功能变化,从哮喘患儿CD4+LAP+Treg 细胞数量和功能两个方面来探讨其在哮喘发病机制中的作用,为进一步研究哮喘的免疫发病机制提供新思路。
1 资料与方法 1.1 研究对象选取2014 年3 月至2015 年9 月在南昌大学第二附属医院儿科住院或门诊治疗的哮喘患儿75例为研究对象,所有患儿按照儿童哮喘诊断标准确诊[5],依据病情将哮喘患儿分为哮喘急性期组和哮喘缓解期组。急性期组患儿40 例,均初诊为哮喘或缓解后复发,其中男22 例,女18 例,平均年龄4.2±2.2 岁;缓解期组35 例,均为药物治疗后哮喘症状及体征消失并持续3 个月以上无发作者,其中男18 例,女17 例,平均年龄4.8±2.9 岁。同时选取在我院行健康体检儿童30 例为健康对照组,其中男15 例,女15 例,平均年龄4.5±2.5 岁。所有患儿在标本采集前3 个月内均未使用糖皮质激素以及免疫抑制剂或免疫调节剂等;健康对照组儿童近期均无感染和慢性病史,且排除过敏性和免疫相关性疾病。本研究经医院伦理委员会批准通过,并获得家长知情同意。
1.2 主要试剂75%、100% Ficoll-hypaque 购自上海索莱宝生物科技有限公司,胎牛血清购自美国Gibico 公司,Anti-Human LAP PE、Anti-Human CD4 FITC、Anti-Human CD25 APC 及同型抗体购自美国eBioscience公司,人CD4+LAP+Treg 分离纯化试剂盒购自德国Miltenyi 公司,抗人CD3、CD28 单克隆抗体购自美国R & D 公司。
1.3 流式细胞术检测外周血CD4+LAP+Treg 水平急性期哮喘患儿在发病3 d 内且未使用任何药物治疗前,缓解期患儿在药物治疗后3 个月,对照组儿童在健康体检时空腹采集外周静脉血3 mL于肝素钠抗凝管中。加3 mL 100%Ficoll-hypaque 于15 mL 离心管中,沿管壁缓慢加入3 mL 全血于淋巴细胞分离液上层,离心20 min,吸取中间云雾状层于10 mL 离心管,加PBS 3 mL 洗涤,离心10 min,弃上清,洗涤2 次。加RPMI 1640 将细胞沉淀重悬,细胞计数,调整细胞密度为2×106/mL。每份标本分成2 管(实验管和同型对照管),每管400 μL,混匀,实验管加入表面抗体Anti-Human LAP PE 5 μL、Anti-Human CD4 FITC 5 μL、Anti-Human CD25 APC 5 μL;同型对照管加入相应的同型抗体。室温、避光孵育15 min。加PBS 3 mL,离心5 min,弃上清,注意保护沉淀。沉淀加入1% 多聚甲醛400 μL 重悬,过滤细胞悬液移入流式检测管,上流式细胞仪检测,每个样本平行重复3 次,取平均值。
1.4 3H 脱氧胸腺嘧啶苷掺入法检测外周血CD4+LAP+Treg 细胞免疫抑制功能急性期哮喘患儿在发病3 d 内且未使用任何药物治疗前,缓解期患儿在药物治疗后3 个月,对照组儿童在健康体检时空腹采集外周静脉血20 mL于肝素钠抗凝管中。用淋巴细胞分离液分离人外周血单个核细胞(PBMC)。参照免疫磁珠(MACS)CD4+LAP+Treg 分离纯化试剂盒说明书进行操作,分离出CD4+LAP+Treg、CD4+LAP-T 淋巴细胞。每个研究对象为一个样本,每个样本设3 个孔,分别加入单独培养的5×104 CD4+LAP+Treg 细胞、5×104 CD4+LAP-T 淋巴细胞及两者按照1 : 1 的比例共培养的细胞,接种于抗CD3 包被的96 孔板中,加入浓度为5 mg/L 的抗CD28 抗体。培养结束前16~18 h 加入最终放射活性为37 kBq/ 孔的3H- 脱氧胸腺嘧啶苷培养液继续培养,收集细胞至玻璃纤维纸上,置37℃孵箱烘干,烘干后收集细胞滤纸,置于专用孔中,加入液闪液,密封后用液闪仪测定每分钟放射计数(cpm)。抑制率=[1-(两种T细胞共培养的cpm/CD4+LAP-T 淋巴细胞单独培养的cpm)]×100 %。
1.5 统计学分析应用SPSS 17.0 统计软件对数据进行统计学分析。正态分布计量资料以均数± 标准差((x±s))表示,多组数据比较采用单因素方差分析,组间两两比较行SNK-q 检验,P<0.05 为差异有统计学意义。
2 结果 2.1 各组CD4+LAP+Treg 亚群比例比较哮喘急性期组CD4+LAP+Treg 占CD4+T 细胞百分比低于哮喘缓解期组及健康对照组(P<0.05),哮喘缓解期组与健康对照组相比,差异无统计学意义(P>0.05),见表 1。
| 表 1 各组CD4+LAP+Treg 占CD4+T 细胞比例比较 |
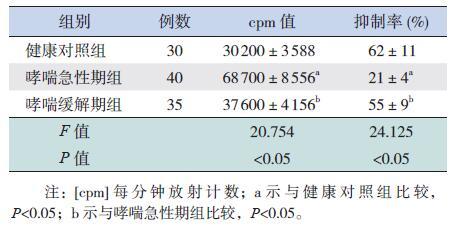
2.2 CD4+LAP+Treg 细胞对CD4+LAP-T 淋巴细胞的免疫抑制功能
哮喘急性期组CD4+LAP+Treg 细胞和CD4+LAP-T 淋巴细胞共培养后的cpm 值高于哮喘缓解期组和健康对照组(P<0.05),哮喘缓解期组与健康对照组相比,差异无统计学意义(P>0.05);哮喘急性期组CD4+LAP+Treg 细胞对CD4+LAP-T淋巴细胞抑制率低于哮喘缓解期组和健康对照组(P<0.05),哮喘缓解期组与健康对照组相比,差异无统计学意义(P>0.05)。见表 2。
| 表 2 各组CD4+LAP+Treg 细胞和CD4+LAP-T 淋巴细胞共培养后cpm 值和抑制率比较 (x±s) |
3 讨论
哮喘是儿童期常见的慢性呼吸道疾病,具有病程长、反复发作、需要长期治疗等特点,严重影响儿童的健康和生活质量。据流行病学调查统计[6],2010 年我国33 个城市儿童哮喘患病率为2.11%,较10 年前上升32.7%。
哮喘发病机制十分复杂,有研究表明肺组织中抗原递呈细胞、树突状细胞、T 辅助细胞(Thelp cells,Th)、Th17 细胞、Treg 及其相互作用参与了哮喘发病过程,此外哮喘外周血和肺组织中也存在Th1/Th2、Treg/Th17 比例失衡[7-9]。
目前的Treg 细胞类型包括经典的CD4+CD25+FOXP3+Treg、分泌IL-10 的1 型调节性T 细胞(Tr1 Treg) 和分泌TGF-β 的Th3 Treg。CD4+CD25+FOXP3+Treg 细胞在维持外周免疫耐受,预防自身免疫性疾病以及抑制慢性炎症性疾病中发挥着重要作用。研究发现,CD4+CD25+FOXP3+Treg 细胞在哮喘、系统性红斑狼疮、类风湿性关节炎等多种免疫性疾病患者外周血中数目减少,动物实验表明,增加循环中的CD4+CD25+FOXP3+Treg细胞数量,可以减轻以上动物模型疾病的进展,进一步证实了Treg 细胞在维持免疫平衡方面的重要作用[10-12]。
2003 年,Oida 等[13] 首次在小鼠体内发现了一类新型的T 细胞亚群,其特点是该细胞膜表面表达LAP,即CD4+LAP+Treg 细胞,该细胞亚群同样具有免疫抑制作用。2010 年,Gandhi 等[2] 又在人外周血中分选出了CD4+LAP+Treg 细胞,该细胞表型定义为CD4+LAP+Treg,这类细胞膜表面标记与天然产生的CD4+CD25+FOXP3+Treg 细胞不同,其活化和增殖不依赖于IL-2,可被IL-8 放大。它所分泌的细胞因子包括IL-8、IL-9、IL-10、IFN-γ和TGF-β,CD4+LAP+Treg 细胞的抑制功能与经典的CD4+CD25+FOXP3+Treg 细胞相似,其抑制功能依赖于TGF-β,IL-10 的介导以及细胞与细胞接触抑制的途径,但是其抑制效应T 细胞的功能却要比经典的CD4+CD25+FOXP3+Treg 细胞高50 倍[14]。
本研究中发现在数量上,急性期组CD4+LAP+Treg 占CD4+T 细胞百分比显著低于哮喘缓解期组及健康对照组,而哮喘缓解期组与健康对照组相比,差异无统计学意义,这与既往对CD4+CD25+Foxp3+Treg 细胞在哮喘患儿中的研究结果一致[15],说明CD4+LAP+Treg 的减少与哮喘的急性发作有关,在哮喘得到控制后,体内CD4+LAP+Treg 数量也得到恢复。CD4+CD25+Foxp3+Treg 细胞可维持哮喘模型小鼠气道的免疫耐受能力,增加CD4+CD25+Foxp3+Treg细胞数量可以有效减轻哮喘的症状。虽然CD4+LAP+Treg 不表达Foxp3,但是可表达产生抑制性T 淋巴细胞相关的分子,包括颗粒酶B 和细胞毒T 淋巴细胞抗原-4(CTLA-4),这类分子参与免疫反应的负调节,在动物实验中这类细胞能有效抑制哮喘小鼠的肺部炎症反应,因此被认为是治疗和分析哮喘的一个靶点[16]。因此,本研究中哮喘患儿外周血中CD4+LAP+Treg 数量减少可能导致哮喘患儿气道免疫耐受能力下降,肺部炎症反应不能得到有效抑制,从而参与了哮喘的急性发病过程。
从功能上看,哮喘急性期组CD4+LAP+Treg和CD4+LAP-T 淋巴细胞共培养后的cpm 值高于哮喘缓解期组和健康对照组,哮喘缓解期组与健康对照组相比,差异无统计学意义;哮喘急性期组CD4+LAP+Treg 细胞对CD4+LAP-T 淋巴细胞抑制率显著低于哮喘缓解期组和健康对照组,哮喘缓解期组与健康对照组相比,差异无统计学意义,表明哮喘急性期患儿CD4+LAP+Treg 细胞不能有效抑制效应T 细胞的增殖能力。CD4+LAP+Treg 细胞的功能包括通过抑制效应T 细胞的功能及其分泌的细胞因子以及细胞与细胞直接接触的方式抑制效应T 细胞的增殖,除此之外,CD4+LAP+Treg 细胞还可通过抑制B 淋巴细胞的增殖以及抗体的分泌起到免疫调节作用[17]。本研究中哮喘患儿急性期CD4+LAP+Treg 细胞对效应T 细胞抑制率下降,抑制功能减弱,进一步证实了CD4+LAP+Treg 细胞可通过细胞与细胞直接接触的方式抑制效应T 细胞的增殖。哮喘患儿进入缓解期后,CD4+LAP+Treg细胞功能恢复正常,哮喘患儿炎性细胞因子IL-6、IL-17 的水平都恢复正常[18],可能提示CD4+LAP+Treg 细胞功能恢复有效抑制了效应T 细胞分泌细胞因子,从而减轻哮喘患儿的症状。
综上所述,哮喘作为与自身免疫密切相关的疾病,免疫失衡参与了该病的发展,我们推测CD4+LAP+Treg 细胞数量的减少和功能的下降可能导致哮喘患儿不能维持气道的免疫耐受,有效抑制效应性CD4+T 淋巴细胞的活化、增殖及分泌细胞因子,以及抑制B 淋巴细胞的增殖和抗体的分泌;而免疫耐受能力的下降、效应细胞产生的细胞因子IL-6、IL-17 以及IgE 等抗体均参与了哮喘患儿气道炎性反应及气道重构的过程,从而导致了哮喘的急性发作。但是CD4+LAP+Treg 细胞与效应T 淋巴细胞及其产生的炎性细胞因子具体如何发挥作用以及CD4+LAP+Treg 细胞是否可作为哮喘的免疫治疗新的方法有待进一步研究。
| [1] | Holgate ST. Innate and adaptive immune responses in asthma[J]. Nat Med , 2012, 18 (5) : 673–683. DOI:10.1038/nm.2731 |
| [2] | Gandhi R, Farez MF, Wang Y, et al. Cutting edge:human latency-associated peptide+T cells:a novel regulatory T cell subset[J]. J Immunol , 2010, 184 (9) : 4620–4624. DOI:10.4049/jimmunol.0903329 |
| [3] | Rezende RM, Oliveira RP, Medeiros SR, et al. Hsp65-producing Lactococcus lactis prevents experimental autoimmune encephalomyelitis in mice by inducing CD4+LAP+ regulatory T cells[J]. J Autoimmun , 2013, 40 : 45–57. DOI:10.1016/j.jaut.2012.07.012 |
| [4] | Wu HY, Center EM, Tsokos GC, et al. Suppression of murine SLE by oral anti-CD3:inducible CD4+CD25-LAP+ regulatory T cells control the expansion of IL-17+ follicular helper T cells[J]. Lupus , 2009, 18 (7) : 586–596. DOI:10.1177/0961203308100511 |
| [5] | 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南[J]. 中华儿科杂志 , 2008, 46 (10) : 745–753. |
| [6] | 沙莉, 邵明军, 刘传合, 等. 2010年与2000年中国城市儿童支气管哮喘患病率比较[J]. 中华结核和呼吸杂志 , 2015, 38 (9) : 664–668. |
| [7] | Jiang H, Wu X, Zhu H, et al. Foxp3(+) Treg/Th17 cell imbalance in lung tissues of mice with asthma[J]. Int J Clin Exp Med , 2015, 8 (3) : 4158–4163. |
| [8] | 潘珍珍, 李羚, 郭赟, 等. CD4+CD25+Foxp3+调节性T细胞与IL-33在儿童哮喘发病机制中的作用[J]. 中国当代儿科杂志 , 2014, 16 (12) : 1211–1214. |
| [9] | Zhu M, Liang Z, Wang T. Th1/Th2/Th17 cells imbalance in patients with asthma with and without psychological symptoms[J]. Allergy Asthma Proc , 2016, 37 (2) : 148–156. DOI:10.2500/aap.2016.37.3928 |
| [10] | Chauhan A, Singh M, Agarwal A, et al. Correlation of TSLP,IL-33,and CD4+CD25+Foxp3+T regulatory (Treg) in pediatric asthma[J]. J Asthma , 2015, 52 (9) : 868–872. DOI:10.3109/02770903.2015.1026441 |
| [11] | Samson M, Audia S, Janikashvili N, et al. Brief report:inhibition of interleukin-6 function corrects Th17/Treg cell imbalance in patients with rheumatoid arthritis[J]. Arthritis Rheum , 2012, 64 (8) : 2499–2503. DOI:10.1002/art.34477 |
| [12] | Ohl K, Tenbrock K. Regulatory T cells in systemic lupus erythematosus[J]. Eur J Immunol , 2015, 45 (2) : 344–355. DOI:10.1002/eji.201344280 |
| [13] | Oida T, Zhang X, Goto M, et al. CD4+CD25-T cells that express latency-associated peptide on the surface suppress CD4+CD45RBhigh- induced colitis by a TGF-beta-dependent mechanism[J]. J Immunol , 2003, 170 (5) : 2516–2522. DOI:10.4049/jimmunol.170.5.2516 |
| [14] | Scurr M, Ladell K, Besneux M, et al. Highly prevalent colorectal cancer-infiltrating LAP+Foxp3-T cells exhibit more potent immunosuppressive activity than Foxp3+ regulatory T cells[J]. Mucosal Immunol , 2014, 7 (2) : 428–439. DOI:10.1038/mi.2013.62 |
| [15] | Stelmaszczyk-Emmel A, Zawadzka-Krajewska A, Szypowska A, et al. Frequency and activation of CD4+CD25+Foxp3+ regulatory T cells in peripheral blood from children with atopic allergy[J]. Int Arch Allergy Immunol , 2013, 162 (1) : 16–24. DOI:10.1159/000350769 |
| [16] | Duan W, So T, Mehta AK, et al. Inducible CD4+LAP+Foxp3- regulatory T cells suppress allergic inflammation[J]. J Immunol , 2011, 187 (12) : 6499–6507. DOI:10.4049/jimmunol.1101398 |
| [17] | Zhu ZF, Tang TT, Dong WY, et al. Defective circulating CD4+LAP+regulatory T cells in patients with dilated cardiomyopathy[J]. J Leukoc Biol , 2015, 97 (4) : 797–805. DOI:10.1189/jlb.5A1014-469RR |
| [18] | Tang XQ, Sun WP, Xu HB, et al. The changes in the levels of IL-6,IL-17,and IL-21 in the acute stage of childhood asthma[J]. Clin Lab , 2013, 59 (11-12) : 1381–1387. |
 2016, Vol. 18
2016, Vol. 18