2. 湖南省妇幼保健院, 湖南 长沙 410000 ;
3. 中信湘雅生殖与遗传专科医院, 湖南 长沙 410008
Bartter 综合征(Bartter syndrome,BS)是一组临床表现为低钾血症、肾性失盐、代谢性碱中毒、肾素、醛固酮水平升高而血压正常的遗传性肾小管疾病,遗传方式主要为常染色体隐性遗传[1]。该病发病率约为19/1 000 000,世界各地及所有种族均有报道,女性多于男性,确诊最早的在胎龄20 周,最晚至50 岁。本病常见于儿童,5 岁之前出现症状者占半数以上[2]。
符合BS 的定义即可临床诊断[3],并可根据临床表现的差异及基因突变的不同而分成不同的亚型。根据临床表现的差异将其分为新生儿型BS、经典型BS、新生儿型BS 伴感音性耳聋、BS 合并常染色体显性遗传性低血钙和Gitelman 综 合 征(Gitelman syndrome,GS)。根据致病基因不同,将BS 分为5 个亚型和GS,编码Na+-K+-2C1- 共转运蛋白NKCC2 的SLC12A1 基因突变导致Ⅰ型BS(MIM #601678); 编码钾通道ROMK 的KCNJI 基因突变导致Ⅱ型BS(MIM #214200);编码氯通道蛋白CLC-Kb 的CLCNKB 基因突变导致Ⅲ 型BS(MIM #607364); 编码基底氯通道β 亚基barttin 的BSND 突变导致Ⅳ型BS(MIM#602522);CaSR 基因激活突变导致Ⅴ型BS(MIM+601199);编码远曲小管管腔膜上的NaCl 同向转运体NCCT 的SLC12A3 基因突变导致GS(MIM#263800)[4-5]。
在临床上,各亚型BS 存在着遗传异质性和表型异质性[6],基因型和表型有时并不一致,临床上鉴别诊断较困难,也有报道本病存在双基因突变致病的现象[7]。在本研究中,我们通过高通量捕获测序技术结合PCR-Sanger 测序对1 例BS 的家系进行了BS 相关致病基因的突变检测,并在此基础上完成了产前诊断。我们发现先证者的CLCNKB 基因存在2 个复合杂合突变,结合临床表型明确为BS Ⅲ型,并通过产前诊断帮助该家系生育一个健康的婴儿。
1 资料与方法 1.1 研究对象患儿,女,1 岁6 个月,因外院考虑其患有BS 且患儿母亲已宫内妊娠4 月余,要求进行遗传咨询。患儿为第1 胎第1 产,足月顺产,出生体重2.9 kg,出生1 周后常有呕吐和腹泻,1 岁时因消瘦、乏力、多饮、多尿,生长发育落后在外院就诊。患儿父母健康,否认家族中有类似患者,否认近亲结婚。体查:身高72 cm,体重6 kg,头围45.5 cm,无特殊面容。神志清楚,精神反应可。心肺腹部和神经系统查体无明显异常。实验室检查:血钾2.41 mmol/L(正常值3.50~5.50 mmol/L),血钠132.5 mmol/L(正常值135.0~145.0 mmol/L),血氯84.9 mmol/L( 正常值96.0~108.0 mmol/L),二氧化碳结合力33.70 mmol/L( 正常值18.00~29.00 mmol/L),血pH 7.614,BE 19,肾素- 血管紧张素活性升高;肝功能正常;尿钙0.62 mmol/L(正常值2.7~7.5 mmol/L),尿磷3.30 mmol/L(正常值 16.1~42 mmol/L);尿比重1.010;肾活检示部分肾小球旁器细胞增生,肾小管、间质无异常发现;儿童发育量表智能评分75(参考值>86)。
1.2 基因组 DNA 提取在签署知情同意书之后,采集患儿及其父母空腹静脉血各2 mL,EDTA 抗凝,采用QIAamp DNA Blood Mini Kit(Qiagen,Hilden,Germany) 提取基因组 DNA。
1.3 高通量捕获测序和数据分析取先证者基因组DNA 5 ng,采用Ion-Torrent-PGM 技术对BS 相关致病基因的外显子区及两侧的剪切位点序列进行高通量测序(Bartter 综合征相关基因Panel 检测)。数据分析以NCBI 公布的人类基因组序列为参考,去除dbSNP、Hapmap 和本地数据库等记载的SNP 位点并优先考虑编码区点突变及剪切位点突变,结合遗传方式确定可疑致病突变。本部分内容委托金域医学检验中心完成。
1.4 突变验证及家系分析利用PCR-Sanger 测序对先证者及父母进行突变验证和家系分析。根据GenBank 中人类CLCNKB 基因序列(NG_013079.1),针对CLCNKB 基因2 号和10 号外显子及其侧翼序列,用 Premier 5.0 软件设计引物如下:CLCNKB-2F:5'-CTAGAGGCAGTGCGAGGACG-3';CLCNKB-2R:5'- GGGCTGTATCTCCCGAAAGG-3';CLCNKB-10F:5'- GCTCATGTCTCCATGCTCCC-3';CLCNKB-10R:5'- GTGGTGTTAGGGGCTCCACAT-3'。并用NCBI 的Primer_BLAST 软件分析其特异性,由上海生工公司合成。PCR 反应体系:20 mmol/L 的上、下游引物各0.2 μL,2.5 mmol/L 的dNTPs 1.5 μL,10×buffer 2 μL,TaqDNA 聚合酶0.2 μL(1 U),基因组DNA 1 μL(100 ng),ddH2O 补足至50 μL。PCR 反应条件:95℃预变性90 s;94℃ 变性40 s,57~60 ℃ 退火40 s,72 ℃ 延伸40 s,共35 个循环;72℃延伸5 min。取2 μL PCR 产物行20 g/L 琼脂糖凝胶电泳,确定产物大小后采用ABI377 DNA 测序仪进行双向测序分析,测序结果参照正常序列(NM_000085)BLAST 分析。
1.5 产前诊断及随访签署知情同意书后,先证者母亲妊娠5 个月时取羊水,按照上述方法提取基因组DNA,运用上述引物及反应条件扩增第2 号和第10 号外显子,然后进行测序分析。孕妇根据检测结果选择是否继续妊娠,并对继续妊娠的胎儿在出生后随诊,进一步明确基因诊断的准确性。
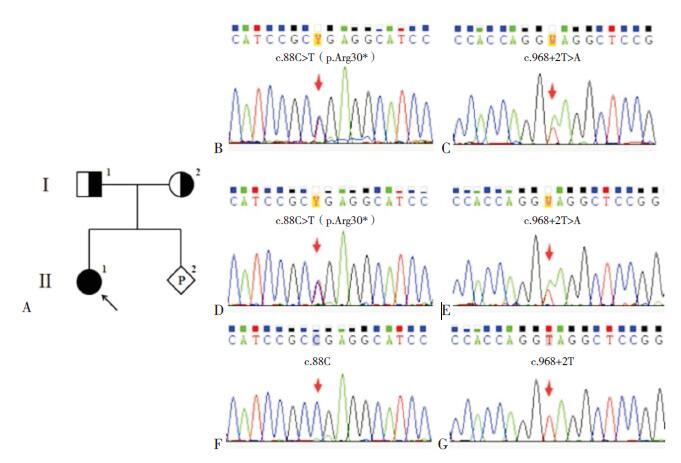
2 结果 2.1 基因突变分析结果经高通量捕获测序检测,发现先证者CLCNKB 基因存在2 个杂合突变:位于2 号外显子的c.88C>T(p.Arg30*)的无义突变和位于10 号外显子的c.968+2T>A 的剪切位点突变。c.88C>T(p.Arg30*)为已报道的致病突变。针对c.968+2T>A突变,查阅db SNP 数据库(http:// www.ncbi.nlm.nih.gov/snp),人类基因突变数据库(Human Gene Mutation Database http://www.hgmd.org) 和ClinVar数据库(http://www.ncbi.nlm.nih.gov/clinvar),均无该突变的记载。另外,经查阅PubMed(http://www.ncbi.nlm.nih.gov/pubmed)和CNKI(http://www.cnki.net/)文献数据库,均未发现该突变的文献报道。因此,c.968+2T>A 为未见报道的新突变。该突变为10 号内含子剪切供体位点由“GT”突变为“GA”,推测可能引起mRNA 剪切异常,产生异常蛋白,不能行使正常功能。运用PCR-Sanger 测序进行突变验证以及家系分析,证实先证者携带这2 个复合杂合突变,且突变分别源自母亲和父亲(图 1)。
|
图 1 家系图及突变位点测序图 图 A 为家系图,Ⅰ -1 和Ⅰ -2 分别为先证者父亲和母亲(均为突变携带者),Ⅱ -1为先证者,Ⅱ -2 为妊娠胎儿;图 B、D、F 分别为先证者、母亲和胎儿的2 号外显子c.88 位测序图;图 C、E、G 分别为先证者、父亲和胎儿的10 号外显子c.968+2 位测序图。箭头所指为突变位点。 |
2.2 产前诊断结果及随访
产前诊断结果显示胎儿未携带先证者所具的c.88C>T(p.Arg30*)和c.968+2T>A 两个突变(图 1),提示胎儿为正常个体。出生后2 岁随访显示,生长发育和智力发育均正常,但父母拒绝对其进行再次的基因诊断验证。
3 讨论BS 根据致病基因不同可分为5 型。Ⅰ型和Ⅱ型多于新生儿期起病,表现为消瘦、嗜睡、多尿和喂养困难,生长发育迟缓,严重的电解质紊乱和代谢性碱中毒[8-9],可有母孕期羊水过多和早产史。部分Ⅰ型患儿出现三角脸、前额突出等特殊面容[10]。Ⅱ型患儿症状较Ⅰ型略轻[11]。Ⅲ型BS 为经典型,多于学龄前起病,主要表现为多饮、多尿、嗜盐、疲劳和发育迟缓等,生化检测中以低血钾、代谢性碱中毒为常见特征,其次为低血氯和低血钠;而肾素- 血管紧张素- 醛固酮系统改变不一致,通常不伴肾钙化[12-13]。Ⅳ型BS 即伴感音性耳聋的新生儿期BS,除了与Ⅱ型有类似的症状,还患有感音性耳聋[14]。Ⅴ型BS 患儿可出现类似Ⅱ型的症状,且具有低钙血症,Ⅴ型BS 不同于其他亚型,遗传方式上表现为常染色体显性遗传[15]。除Ⅳ型,其他亚型在临床上有时难以区分。本研究无家族史,先证者起病较早,1 岁前已出现烦渴、多尿、消瘦症状,生长发育落后,智力发育轻度迟缓,但听力视力尚可,生化检测提示低血钾、代谢性碱中毒、高肾素- 血管紧张素活性,病检示肾小球旁器细胞增生,临床上基本符合BS。为明确亚型,我们通过高通量捕获测序结合Sanger 测序同时检测BS 6 个致病基因,发现先证者携带CLCNKB 基因c.88C>T(p.Arg30*)和c.968+2T>A 复合杂合突变,诊断为Ⅲ型BS。
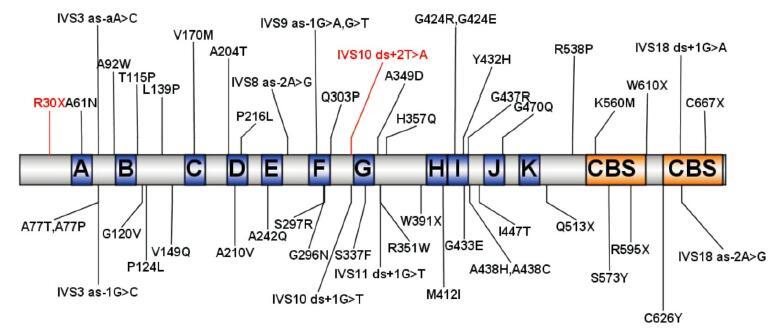
CLCNKB 基因突变可导致Ⅲ型BS,由Simon等[16] 于1997 年首次报道。CLCNKB 基因共19 个外显子,编码一个687 氨基酸的蛋白- 电压门控氯离子通道CLC-Kb,有11 个跨膜区,氨基端和羧基端均位于胞内。CLC-Kb 主要表达于肾髓袢升支粗段、远曲小管、连接小管、集合管上皮细胞的基底膜侧,负责Cl- 转运[16-17]。CLC-Kb 失活后髓袢升支粗段上皮细胞基底膜侧Cl- 排出减少,从而影响顶膜侧Na+-K+-2Cl- 共转运子的转运功能,使NaCl 重吸收严重降低,细胞外液容量不足,引起高肾素- 血管紧张素Ⅱ - 醛固酮血症、血前列腺素E 增高,导致低钾、低氯性碱中毒[18]。Ⅲ型BS 呈常染色体隐性遗传,目前人类基因突变数据库(http://www.hgmd.cf.ac.uk/ac/search.php)已报道的CLCNKB 基因突变有70 余种,绝大部分为错义突变、无义突变、剪切位点突变、小缺失和插入突变等。对这些突变进行分析,发现突变均匀分布于整个基因,无明显突变热点区(图 2)。
|
图 2 CLC-Kb 蛋白结构示意图及部分突变分布情况 A~K:跨膜结构域;CBS:胱硫醚β- 内合酶相关结构域;所示突变中红色标注的为本研究发现的突变,黑色为HGMD 数据库记载的与Ⅲ型Bartter 综合征相关的错义以及剪切突变。 |
本文发现的c.88C>T(p.Arg30*)和c.968+2T>A突变均为功能缺失性突变。Yu 等[1] 的研究中,将c.88C>T(p.Arg30*)突变与BSND 基因p.Tyr98Ala突变共转染到爪蟾卵母细胞,通过双电极电压钳分析发现,与野生型相比,c.88C>T(p.Arg30*)突变废除了氯化物电流,表明该无义突变导致的蛋白截短最终影响了氯离子通道CLC-Kb 的功能。c.968+2T>A 为新的剪切位点突变,可导致mRNA的错误剪切产生异常蛋白而丧失功能。因此,这两个复合杂合突变可能是导致患儿出现较严重临床症状的致病原因。
本病高危风险家系进行产前诊断是预防疾病再发的重要措施[19-20]。本文中产前诊断结果显示该家系的胎儿未携带先证者的致病突变,孕妇选择了继续妊娠,随诊显示出生的婴儿健康,进一步证实了基因诊断的准确性。同时表明,在明确基因突变前提下,进行产前诊断,对于预防患儿出生,降低疾病发生,达到优生优育有着重要的意义。
| [1] | Yu Y, Xu C, Pan X, et al. Identification and functional analysis of novel mutations of the CLCNKB gene in Chinese patients with classic Bartter syndrome[J]. Clin Genet , 2010, 77 (2) : 155–162. DOI:10.1111/cge.2010.77.issue-2 |
| [2] | 于迎, 潘晓霞, 任红, 等. 成人经典型Bartter综合征家系CLCNKB基因突变的研究[J]. 中华肾脏病杂志 , 2010, 26 (8) : 598–602. |
| [3] | Akuma AO, Mittal SK, Sambo AA. Neonatal Bartter syndrome associated with ileal atresia and cystic fibrosis[J]. Indian J Nephrol , 2013, 23 (1) : 47–50. DOI:10.4103/0971-4065.107200 |
| [4] | Wang XM, Shen Z, Xu M, et al. A Chinese girl with Bartter Syndrome Type Ⅲ due to a novel mutation and/or single nucleotide polymorphisms (SNPs) in CLCNKB gene[J]. Iran J Pediatr , 2013, 23 (1) : 89–94. |
| [5] | Lee BH, Cho HY, Lee H, et al. Genetic basis of Bartter syndrome in Korea[J]. Nephrol Dial Transplant , 2012, 27 (4) : 1516–1521. DOI:10.1093/ndt/gfr475 |
| [6] | Robitaille P, Merouani A, He N, et al. Bartter syndrome in two sisters with a novel mutation of the CLCNKB gene,one with deafness[J]. Eur J Pediatr , 2011, 170 (9) : 1209–1211. DOI:10.1007/s00431-011-1464-z |
| [7] | Nozu K, Inagaki T, Fu XJ, et al. Molecular analysis of digenic inheritance in Bartter syndrome with sensorineural deafness[J]. J Med Genet , 2007, 45 (3) : 182–186. DOI:10.1136/jmg.2007.052944 |
| [8] | Wong AC, Chan LG. Neonatal bartter syndrome[J]. Med J Malaysia , 2014, 69 (5) : 229–230. |
| [9] | Afzal M, Khan EA, Khan WA, et al. Antenatal Bartter syndrome[J]. J Coll Physicians Surg Pak , 2014, 24 (Suppl 2) : S121–S123. |
| [10] | Brochard K, Boyer O, Blanchard A, et al. Phenotype-genotype correlation in antenatal and neonatal variants of Bartter syndrome[J]. Nephrol Dial Transplant , 2009, 24 (5) : 1455–1464. DOI:10.1093/ndt/gfn689 |
| [11] | Chan WK, To KF, Tong JH, et al. Paradoxical hypertension and salt wasting in Type Ⅱ Bartter syndrome[J]. Clin Kidney J , 2012, 5 (3) : 217–220. DOI:10.1093/ckj/sfs026 |
| [12] | Shibli AA, Narchi H. Bartter and Gitelman syndromes:Spectrum of clinical manifestations caused by different mutations[J]. World J Methodol , 2015, 5 (2) : 55–61. |
| [13] | Tajima T, Nawate M, Takahashi Y, et al. Molecular analysis of the CLCNKB gene in Japanese patients with classic Bartter syndrome[J]. Endocr J , 2006, 53 (5) : 647–652. DOI:10.1507/endocrj.K06-034 |
| [14] | Luque de Pablos A, García-Nieto V, López-Menchero JC, et al. Severe manifestation of Bartter syndrome type IV caused by a novel insertion mutation in the BSND gene[J]. Clin Nephrol , 2014, 81 (5) : 363–368. DOI:10.5414/CN107687 |
| [15] | Choi KH, Shin CH, Yang SW, et al. Autosomal dominant hypocalcemia with Bartter syndrome due to a novel activating mutation of calcium sensing receptor,Y829C[J]. Korean J Pediatr , 2015, 58 (4) : 148–153. DOI:10.3345/kjp.2015.58.4.148 |
| [16] | Simon DB, Bindra RS, Mansfield TA, et al. Mutations in the chloride channel gene,CLCNKB,cause Bartter's syndrome type Ⅲ[J]. Nat Genet , 1997, 17 (2) : 171–178. DOI:10.1038/ng1097-171 |
| [17] | Kobayashi K, Uchida S, Okamura HO, et al. Human CLC-Kb gene promoter drives the EGFP expression in the specific distal nephron segments and inner ear[J]. J Am Soc Nephrol , 2002, 13 (8) : 1992–1998. DOI:10.1097/01.ASN.0000023434.47132.3D |
| [18] | Koulouridis E, Koulouridis I. Molecular pathophysiology of Bartter's and Gitelman's syndromes[J]. World J Pediatr , 2015, 11 (2) : 113–125. DOI:10.1007/s12519-015-0016-4 |
| [19] | Garnier A, Dreux S, Vargas-Poussou R, et al. Bartter syndrome prenatal diagnosis based on amniotic fluid biochemical analysis[J]. Pediatr Res , 2010, 67 (3) : 300–303. DOI:10.1203/PDR.0b013e3181ca038d |
| [20] | Rachid ML, Dreux S, de Ponfilly GP, et al. Prenatal diagnosis of Bartter syndrome:amniotic fluid aldosterone[J]. Prenat Diagn , 2016, 36 (1) : 88–91. DOI:10.1002/pd.v36.1 |
 2016, Vol. 18
2016, Vol. 18

