食物过敏(food allergy,FA)是机体对食物变应原产生的不良免疫反应,可累及胃肠道、皮肤和呼吸道等。由于婴幼儿的肠道屏障功能、胃肠道免疫及非免疫功能均未发育成熟,一旦接触食物抗原,容易发生食物过敏,故FA 的发生在儿童中高于成人。欧美等发达国家儿童食物过敏发生率为5%~10%,且主要为IgE 介导的过敏[1-2]。鸡蛋蛋白是引起儿童FA 的重要过敏原之一,5 岁以内儿童的患病率约为1.8%~2.0%[1]。研究发现,大部分儿童对烘烤或几乎全熟的鸡蛋耐受[2-3],而对生的或半熟的鸡蛋均过敏。食物抗原是婴儿出生后最早接触到的过敏原,随着年龄增长,FA 婴儿发生哮喘等严重过敏性疾病的可能性更大,FA 往往被认为是过敏进程的第一步[4]。研究表明,啮齿类动物在免疫调节的许多方面与人类相似[5-6],如Th1 和Th2 细胞的分化和IgE 介导的过敏反应等。在多数情况下,引起人类过敏的食物可导致动物过敏,因此可以通过建立敏感动物的食物过敏原模型,研究实验动物对过敏原免疫应答的机制,为预防和治疗过敏性疾病提供依据。目前虽然没有统一的FA 模型,但大鼠和小鼠由于遗传背景使它们对蛋白相关的FA 反应产生的免疫机制均由IgE 介导发生;且相对体积较大的啮齿类动物而言,大鼠和小鼠的价格较低,这些优点使它们较广泛应被用于FA 模型中。挪威棕色(Brown Norway,BN)大鼠是高免疫球蛋白(尤其是IgE)应答品系,已作为过敏动物模型被广泛研究。Knippels 等[7] 早在1999 年已对FA 模型的建立进行了研究,近年来,采用免疫佐剂辅助建立FA 模型的研究也相继增加[8-10]。然而,以上研究采用免疫佐剂和腹腔内注射等方式进行模型制作,与儿童自然发生的FA 进程并不完全相同。本研究拟采用全程经口灌胃,且无免疫佐剂作为致敏的方法,建立口服致敏模型,在某种程度上说,更接近于儿童FA 发生的途径。
1 材料与方法 1.1 实验动物3 周龄清洁级雄性BN 大鼠20 只,身长27±4 cm,体重91±15 g,购自上海斯莱克实验动物有限公司,饲养于上海交通大学医学院附属新华医院动物实验中心。动物饲料购自江苏省南通特洛菲饲料科技有限公司(LAD0011 号大鼠小鼠普通饲料),不含卵清蛋白(ovalbumin,OVA),原料组成包括小麦粉、玉米粉、次粉、豆粕、玉米蛋白粉、植物油、啤酒酵母、盐、赖氨酸、蛋氨酸、矿物质、维生素。动物饮用水为实验动物中心提供的纯净水。饲养温度23±3℃,湿度50%~70%,12 h : 12 h 自动昼夜循环。干预前,所有动物均适应性喂养4 d。每两只大鼠于一个笼子中饲养。
1.2 动物分组及模型建立采用随机分组方法将动物分成过敏组和对照组,每组各10 只大鼠。在文献[7] 方法的基础上,本研究进行了改变,过敏组给予1 mg/mL OVA(Sigma 公司) 灌胃(1 mL/d),全程不使用免疫佐剂;对照组给予生理盐水灌胃(1 mL/d)。过敏组在连续灌胃41 d 后,于第42 天给予OVA100 mg/ 只灌胃激发,1 h 后经眼内眦静脉取血约1 mL,分离血清并置于-20℃冰箱保存待测。造模期间大鼠均可自由进食和饮水,灌胃时间固定于每天早晨8 : 00。分别在第0、7、14、21、28、35和42 天测量大鼠的体重、身长和进食量。第42天激发后观察两组大鼠性状和粪便性状的变化。
1.3 身长、体重和进食量的测量(1)身长的测量:将皮尺固定于桌面上,测量者右手拇指和食指固定大鼠头部,其余三指固定大鼠背部,左手托起大鼠尾部及尾巴,测量从大鼠鼻尖至尾巴末端的距离,精确至0.01 cm。(2)体重的测量:将U 型凹槽置于电子秤上,调零后,将大鼠放入槽中,待大鼠静止时读取测量结果,精确至0.01 g。(3)进食量的测量:记录大鼠24 h 前后饲料的重量,计算差值,得出平均每两只大鼠前一天的进食量,精确至0.01 g。造模期间大鼠身长、体重和进食量的测量时间均固定。
1.4 过敏反应的评估在大剂量OVA 激发后,连续45 min 观察两组大鼠的状态,并进行致敏症状评分。评分标准为:0= 没有症状;1= 抓鼻子,挠头;2= 眼睛、嘴巴周围浮肿,毛发竖立,活动减少或呼吸频率升高;3= 哮喘,呼吸困难,嘴和尾巴周围苍白;4= 刺激后抽搐或静止;5= 死亡[11]。
1.5 血清OVA-IgE 含量和血浆组胺水平测定采用眼静脉丛采血法将大鼠血标本分别收集于A 管(含肝素的抗凝管,用于分离血浆)和B 管(不含抗凝剂,用于分离血清)中。A 管收集后混匀,以3 000 转/min 离心15 min 获得血浆,分装后置于-20℃冰箱中备用;B 管于37 ℃水浴静置1 h,再以3 000 转/min 离心15 min,吸取上清液进行分装,冻存于-20℃备用。采用酶联免疫法(ELISA)检测两组大鼠血清OVA-IgE抗体和血浆组胺水平,OVA-IgE ELISA 试剂盒和组胺ELISA 试剂盒均购自TaKaRa 公司,实验步骤严格按照说明书进行操作。
1.6 FA 大鼠模型建立成功的标志FA 模型建立成功的标志[7]:过敏组大鼠血清OVA-IgE 含量≥对照组大鼠血清OVA-IgE 含量均数+3 标准差(x±3 s)。
1.7 统计学分析采用SPSS 16.0 统计软件对数据进行统计学分析。计量资料采用均数± 标准差(x±s)表示,两组间比较采用独立样本t 检验,P<0.05 为差异有统计学意义。
2 结果 2.1 一般情况造模前,对照组大鼠身长27.7±3.6 cm,体重95±18 g,进食量10.8±3.1 g; 过敏组大鼠身长26.9±3.5 cm,体重88±12 g,进食量11.1±2.0 g,两组大鼠身长、体重和进食量比较差异无统计学意义(P>0.05),具有基线可比性。在第7、14、21、28、35 和42 天,两组大鼠身长和体重比较差异无统计学意义(P>0.05)(表 1~2)。第21 天时,对照组大鼠进食量大于过敏组(P<0.05),其他时间点两组大鼠进食量比较差异无统计学意义(P>0.05)(表 3)。在42 d 激发后,过敏组大鼠出现激惹、活动度减低的表现,但未观察到两组大鼠粪便性状的差异。
| 表 1 对照组和过敏组大鼠各阶段身长比较 |
| 表 2 对照组和过敏组大鼠各阶段体重比较 |
| 表 3 对照组和过敏组大鼠各阶段进食量比较 |
2.2 两组大鼠过敏反应表现
过敏组10 只大鼠中,3 只出现嘴和尾巴周围苍白等评分为3 分的表现;5 只出现眼睛或嘴巴周围浮肿、毛发竖立、活动减少等评分为2 分的表现;2 只仅出现抓鼻子、挠头等评分为1 分的表现。对照组10 只大鼠则没有症状,过敏症状评分均为0。
2.3 两组大鼠血清OVA-IgE 水平检测结果对照组血清OVA-IgE 水平为0.9±0.5 μg/mL,过敏组为5.4±3.1 μg/mL,两组比较差异有统计学意义(t=-4.651,P<0.001)。依照FA 模型建模的阳性判定公式得,过敏组大鼠10 只中共有9 只IgE 水平达到≥对照组均数+3 倍标准差的水平,致敏率为90%。
将过敏组中未致敏大鼠剔除,过敏组和对照组大鼠身长、体重和进食量在不同时间点比较差异均无统计学意义(P>0.05),见图 1。
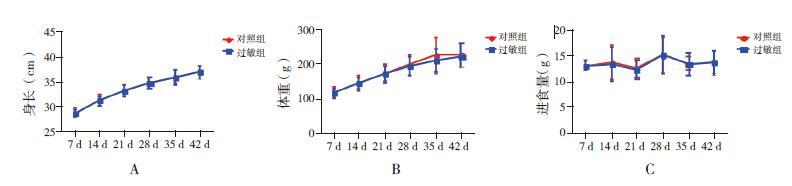
|
图 1 过敏组大鼠致敏成功后两组大鼠一般情况比较 A:两组大鼠身长比较;B:两组大鼠体重比较;C:两组大鼠进食量比较。对照组n=10;过敏组n=9。 |
2.4 两组大鼠血浆组胺水平检测
对照组血浆组胺水平为0.07±0.04 μg/L,过敏组为0.65±0.58 μg/L,两组比较差异有统计学意义(t=-3.137,P=0.006)。
3 讨论BN 大鼠是高免疫球蛋白(尤其是IgE)应答品系,已作为过敏动物模型被广泛研究。本研究采用无佐剂、经口致敏的方式给予BN 大鼠1 mg/d 的OVA 研究FA 的动物模型,以血清特异性IgE 抗体为指标,验证BN 大鼠FA 模型的可行性,以期为FA 的研究提供可参考的动物模型。
Akiyama 等[12] 将BN 大鼠与BALB/c 小鼠、ASK 小鼠及B10A 小鼠进行口服致敏模型的比较,发现BN 大鼠和B10A 小鼠更适合用于IgE 介导的FA 研究。Sun 等[13] 将BN 大鼠和Wistar 大鼠在口服致敏肠道模型中进行了比较,两者均产生了显著的OVA 特异性IgE 抗体水平的变化,但BN 大鼠相比Wistar 大鼠对IgE 介导的过敏反应更为敏感。Knippels 等[14] 的研究也证实了BN 大鼠是一种较理想的口服致敏动物模型。Knippels 等[15] 在免疫印迹实验中,分别采集口服鸡蛋蛋白和牛奶过敏的人类血清和BN 大鼠血清检测,结果提示该大鼠与人类表现出相同的蛋白识别模式;大鼠过敏动物模型适于进行血清特异性抗体的动力学分析,口服致敏且无需佐剂,可产生与人类相似的过敏症状[16],而口服致敏与人类FA 的致敏途径最相似,故更适合用于FA 模型的研究。此外,有研究发现,初始干预年龄对BN 大鼠产生FA 反应并无影响[17]。基于以上的研究,Knippels 等[7] 在不使用佐剂的前提下,连续42 d 给予BN 大鼠OVA(1 mg/d)灌胃,结果显示超过80%BN 大鼠产生OVA 特异性IgE,且致敏大鼠在激发后肠道通透性增加。本研究结果与之相似,在干预的第42 天给予每只大鼠100 mg 的OVA 的激发剂量,发现其致敏率达到90%。
一个纵向研究[18] 发现,牛奶蛋白过敏的儿童(1~17 月龄)身高(身长)增长较正常儿童减慢,且过敏症状发生越早对儿童生长的影响更明显。Christie 等[19] 在一项对儿童(1 月龄至10 岁)FA的横断面研究中指出,FA 对儿童身高增长存在负面影响。然而,2013 年刘俊红等[20] 在动物研究中发现,短期内FA 并未对体重增长造成影响。2014年,Robbins 等[21] 的临床研究指出,牛奶蛋白过敏儿童的体重身高和BMI 百分位数均值相比正常儿童而言,显著性减低,而在其他FA 组(花生和鸡蛋蛋白)中均未发现。本研究干预措施为期6 周,采用OVA 为致敏原建立FA 模型,并未发现OVA过敏对BN 大鼠的体重和身长产生影响,与以上研究者得出结论一致。过敏组在第21 天的进食量较对照组减低,但发现两组大鼠体重增长并无差异,由此推断短期进食量减少对体重增长影响不大。
血清特异性IgE 水平升高是人类或动物过敏模型发生速发型过敏反应的诊断因素之一。ELISA检测血清特异性IgE 最为常用,已逐渐取代被动皮肤试验,并由Birmingham 等[22] 证实更具敏感性、特异性和高重复性。故本研究采用ELISA 法检测血清OVA-IgE 抗体水平,评价BN 大鼠FA 模型的建立。经口灌胃且不采用佐剂所建立的FA 动物模型与人类FA 发生过程更为相似。且本研究发现,OVA 激发所产生的FA 发生率较高,是研究IgE 介导的FA 较理想的动物模型。然而,本研究未从BN 大鼠亲代进行干预,故不能排除亲代暴露于易过敏食物(如蛋白、坚果等)对子代产生食物过敏造成的影响,未来还需对其进行进一步的研究。
| [1] | Sicherer SH. Epidemiology of food allergy[J]. J Allergy Clin Immunol , 2011, 127 (3) : 594–602. DOI:10.1016/j.jaci.2010.11.044 |
| [2] | Bartnikas LM, Sheehan WJ, Larabee KS, et al. Ovomucoid is not superior to egg white testing in predicting tolerance to baked egg[J]. J Allergy Clin Immunol Pract , 2013, 1 (4) : 354–360. DOI:10.1016/j.jaip.2013.04.002 |
| [3] | Turner PJ, Mehr S, Joshi P, et al. Safety of food challenges to extensively heated egg in egg-allergic children:a prospective cohort study[J]. Pediatr Allergy Immunol , 2013, 24 (5) : 450–455. DOI:10.1111/pai.12093 |
| [4] | Tan RA, Corren J. The relationship of rhinitis and asthma,sinusitis,food allergy,and eczema[J]. Immunol Allergy Clin North Am , 2011, 31 (3) : 481–491. DOI:10.1016/j.iac.2011.05.010 |
| [5] | Oyoshi MK, Oettgen HC, Chatila TA, et al. Food allergy:Insights into etiology,prevention,and treatment provided by murine models[J]. J Allergy Clin Immunol , 2014, 133 (2) : 309–317. DOI:10.1016/j.jaci.2013.12.1045 |
| [6] | Johnston LK, Chien KB, Bryce PJ. The immunology of food allergy[J]. J Immunol , 2014, 192 (6) : 2529–2534. DOI:10.4049/jimmunol.1303026 |
| [7] | Knippels LM, Penninks AH, van Meeteren M, et al. Humoral and cellular immune responses in different rat strains on oral exposure to ovalbumin[J]. Food Chem Toxicol , 1999, 37 (8) : 881–888. DOI:10.1016/S0278-6915(99)00064-2 |
| [8] | Liu ZQ, Zheng PY, Yang PC. Hapten facilitates food allergen-related intestinal hypersensitivity[J]. Am J Med Sci , 2013, 345 (5) : 375–379. DOI:10.1097/MAJ.0b013e3182571f28 |
| [9] | Ahrens B, Quarcoo D, Buhner S, et al. Development of an animal model to evaluate the allergenicity of food allergens[J]. Int Arch Allergy Immunol , 2014, 164 (2) : 89–96. DOI:10.1159/000363109 |
| [10] | Claude M, Lupi R, Bouchaud G, et al. The thermal aggregation of ovalbumin as large particles decreases its allergenicity for egg allergic patients and in a murine model[J]. Food Chem , 2016, 203 : 136–144. DOI:10.1016/j.foodchem.2016.02.054 |
| [11] | Li XM, Schofield BH, Huang CK, et al. A murine model of IgE-mediated cow's milk hypersensitivity[J]. J Allergy Clin Immunol , 1999, 103 (2 Pt 1) : 206–214. |
| [12] | Akiyama H, Teshima R, Sakushima JI, et al. Examination of oral sensitization with ovalbumin in Brown Norway rats and three strains of mice[J]. Immunol Lett , 2001, 78 (1) : 1–5. DOI:10.1016/S0165-2478(01)00229-2 |
| [13] | Sun N, Zhou C, Pu Q, et al. Allergic reactions compared between BN and Wistar rats after oral exposure to ovalbumin[J]. J Immunotoxicol , 2013, 10 (1) : 67–74. DOI:10.3109/1547691X.2012.693546 |
| [14] | Knippels LM, Penninks AH. Assessment of the allergic potential of food protein extracts and proteins on oral application using the brown Norway rat model[J]. Environ Health Perspect , 2003, 111 (2) : 233–238. DOI:10.1289/ehp.5704 |
| [15] | Knippels LM, van der Kleij HP, Koppelman SJ, et al. Comparison of antibody responses to hen's egg and cow's milk proteins in orally sensitized rats and food-allergic patients[J]. Allergy , 2000, 55 (3) : 251–258. DOI:10.1034/j.1398-9995.2000.00403.x |
| [16] | Dearman RJ, Kimber I. Animal models of protein allergenicity:potential benefits,pitfalls and challenges[J]. Clin Exp Allergy , 2009, 39 (4) : 458–468. DOI:10.1111/cea.2009.39.issue-4 |
| [17] | Pilegaard K, Madsen C. An oral Brown Norway rat model for food allergy:comparison of age,sex,dosing volume,and allergen preparation[J]. Toxicology , 2004, 196 (3) : 247–257. DOI:10.1016/j.tox.2003.11.010 |
| [18] | Isolauri E, Sütas Y, Salo MK, et al. Elimination diet in cow's milk allergy:risk for impaired growth in young children[J]. J Pediatr , 1998, 132 (6) : 1004–1009. DOI:10.1016/S0022-3476(98)70399-3 |
| [19] | Christie L, Hine RJ, Parker JG, et al. Food allergies in children affect nutrient intake and growth[J]. J Am Diet Assoc , 2002, 102 (11) : 1648–1651. DOI:10.1016/S0002-8223(02)90351-2 |
| [20] | 刘俊红, 吴斌, 赖乾坤, 等. SD幼鼠食物过敏模型的建立与评价[J]. 临床儿科杂志 , 2013, 31 (10) : 953–958. |
| [21] | Robbins KA, Wood RA, Keet CA. Milk allergy is associated with decreased growth in US children[J]. J Allergy Clin Immunol , 2014, 134 (6) : 1466–1468. DOI:10.1016/j.jaci.2014.08.037 |
| [22] | Birmingham N, Payankaulam S, Thanesvorakul S, et al. An ELISA-based method for measurement of food-specific IgE antibody in mouse serum:an alternative to the passive cutaneous anaphylaxis assay[J]. J Immunol Methods , 2003, 275 (1-2) : 89–98. DOI:10.1016/S0022-1759(03)00008-5 |
 2016, Vol. 18
2016, Vol. 18




