铅中毒将导致人类中枢神经系统不可逆的损害,主要表现为认知能力下降,并且不随血铅水平的降低而恢复。儿童由于消化吸收较快,手口活动较多,神经系统处于快速生长发育之中,血脑屏障不完善,因此成为铅暴露最大的受害者[1]。近年来大量研究证明环境中低浓度的铅即可引起儿童认知能力降低,而受损的认知能力并不会随着体内铅水平的降低而恢复[2],且铅导致认知受损的病理机制至今仍不明确。
铅在血液中的半衰期是1 个月左右,因此血铅只能反映近一个月来的铅暴露情况,而对以往是否铅暴露以及铅暴露引起的认知损伤程度,并无太多参考意义。寻找既能反映铅暴露状况又能关联铅所致神经损伤程度的标志物,是目前铅中毒机制研究中的关键问题之一。
瘦素主要是由白色脂肪组织产生,分子量为16 KD,以单体形式存在于血浆中。最初是以能影响摄食行为、调节能量代谢而被人类发现[3]。后续研究发现,瘦素在生殖、代谢、创伤修复以及免疫等过程中都发挥重要作用,瘦素的神经保护作用也被越来越多的认识到。瘦素可通过血脑屏障,与中枢神经系统瘦素受体结合从而激活中枢代谢调控神经元,启动多种细胞信号转导通路。瘦素信号异常多表现为瘦素抵抗,即瘦素水平正常或升高,但机体对瘦素不敏感或无反应。临床研究证明,高血浆瘦素水平可降低阿尔茨海默病(alzheimer disease,AD)患者老年痴呆的风险,而AD 患者海马中瘦素表达高于正常同龄人[4]。海马是负责学习记忆的关键部位,海马内突触的可塑性调节是学习记忆的分子基础,主要表现为长时程增强(long-term potentiation,LTP)。Moult 等[5]的研究证明,瘦素在调节海马突触兴奋性和突触可塑性上起重要作用。Oomura 等[6] 的研究发现,瘦素通过增强海马CA 区突触上N- 甲基-D- 天冬氨酸受体的功能,促进短时程增强转化为LTP。Li等[7] 的研究发现,在人工脑脊液中添加瘦素可以易化大鼠海马CA 区LTP 的形成。因此我们推测瘦素可能参与铅的神经毒性机制,与铅暴露引起的认知损伤有一定相关性。本课题组之前的研究已经证实,铅暴露儿童血浆中瘦素水平是降低的,且与血铅水平呈负相关[8]。本研究拟在前期研究基础上,通过建立Sprague Dawley(SD)大鼠发育期慢性铅暴露后认知受损模型,进一步探讨铅暴露对血浆、脑脊液和海马中瘦素水平的影响,以及瘦素和认知能力的相关性,以期为铅神经毒性的诊断和治疗提供新的理论基础。
1 材料与方法 1.1 主要试剂醋酸铅(成都科龙化工试剂公司),二氨基联苯胺(DAB)显色试剂盒(武汉博士德生物工程有限公司),ECL 底物化学发光剂(PIERCE 公司,美国),BCA 蛋白定量检测试剂盒(上海碧云天生物技术有限公司),聚偏氟乙烯(PVDF)膜(O.Roche 公司,瑞士),兔抗鼠瘦素、Bax 抗体(abcam 公司,美国),兔抗鼠Bcl-2 抗体(Cell Signaling Technology 公司,美国),瘦素ELISA 试剂盒(R&D 公司,美国)。
1.2 慢性铅暴露致认知能力损伤的大鼠模型健康成年清洁级SD 大鼠,由四川大学华西动物中心提供。雌鼠体重220~250 g,雄鼠体重250~280 g,每笼雌雄比例为1 : 2,雌鼠怀孕后单笼饲养。随机选取孕鼠12 只,平均分为对照组、低铅组、中铅组和高铅组。实验过程中每天给大鼠提供12 h 光照-12 h 黑暗时间,环境温度22~24℃,各组大鼠可随意饮食饮水,实验期间避免对各组大鼠强光和噪声刺激。各组孕鼠分娩后,仔鼠数量分别为对照组25 只,低铅组22 只,中铅组24 只,高铅组31 只。
孕鼠自分娩第1 天起,低铅组、中铅组和高铅组母鼠饮用的蒸馏水中分别添加50 ppm、200 ppm和1 000 ppm浓度的醋酸铅行慢性铅暴露,仔鼠通过母乳慢性铅暴露,对照组母鼠饮用蒸馏水。各组仔鼠断奶后饮用与母鼠相同浓度的醋酸铅蒸馏水。至8 周时,对照组不明原因死亡2 只,剩余23 只;低铅组不明原因死亡1 只,剩余21只;中铅组不明原因死亡2 只,剩余22 只;高铅组不明原因死亡4 只,剩余27 只。给各组大鼠从1 开始依次编号,每组随机选取16 只大鼠。采用Morris 水迷宫实验检测各组大鼠认知能力,当铅暴露组大鼠认知能力显著低于对照组时,采集大鼠心脏血并检测血铅含量,确认慢性铅暴露致认知能力损伤的大鼠模型成功后,采集大鼠脑脊液和海马标本待检测相应指标。
1.3 大鼠认知能力检测大鼠认知能力通过水迷宫实验来检测,水迷宫实验设备由成都泰盟软件有限公司制造。水迷宫系统主要由一个圆形的黑色水池(直径1.8 m,高50 cm),一个圆形白色平台(直径12 cm,高30 cm)和动物行为轨迹分析系统组成。实验时水温保持在22±1℃,水中加脱脂奶粉染为白色直至和平台颜色一致;水池可被等分为4 个象限,顺时针分别记为Ⅰ、Ⅱ、Ⅲ、Ⅳ象限。水迷宫实验由4 d 的定位航行实验和第5 天的空间探索实验组成。定位航行实验时,水池内加水至高于平台约1.5 cm 处,平台置于第一象限的正中位置(距池壁和池心均为45 cm ),平台所在象限定义为目标象限;每只大鼠头朝池壁依次从四个象限中点轻轻放入水池中,每天训练4 次,每次最长训练120 s,记录大鼠从入水中到爬上平台所用时间。如果大鼠入水后120 s 内未能找到平台,则引导大鼠至平台并站立30 s,然后放回笼中休息至少30 min,再进行下一次训练。实验参数主要有逃避潜伏期,游泳速度等。在第4 天的定位航行实验结束后24 h,即第5 天,移除平台,将大鼠从目标象限放入水中,观察大鼠在120 s 内的游泳轨迹,记录大鼠游泳时经过原平台的时间,即平台停留时间,以此作为大鼠认知能力的检测指标,并进行统计学分析。
1.4 大鼠血液、脑脊液和海马组织中铅含量测定各组大鼠称重后用10% 水合氯醛腹腔注射麻醉(0.3 mL/100 g),采集大鼠心脏血约1.5 mL于肝素锂抗凝真空采血管(美国BD 公司)中,采血后迅速颠倒混匀,取抗凝全血检测铅含量,每管重复检测两次取平均值;真空管中其余血液3 600 转/min 离心10 min 后,分装血浆于EP 管,超低温冰箱保存,待测瘦素。
每组随机选取8 只大鼠采集脑脊液。切开大鼠颈部皮肤,分离颈部肌肉至暴露枕骨大孔,由枕骨大孔直接进针抽取脑脊液80~120 μL,保存于0.5 mL 的EP 管中,12 000 转/min 离心3 min 后管底无红细胞沉积视为标本合格,取40 μL 脑脊液标本检测铅含量;其余保存于超低温冰箱,待测瘦素。
上述每组8 只大鼠取完脑脊液后断头处死取海马组织,每只大鼠单侧海马组织称重后,液氮研磨成细小粉末,收集于盛有0.3 mL 细胞裂解液的EP 管中,充分混匀后4℃、12 000 转/min 离心20 min;取上清40 μL 检测铅含量(μg/L),换算成海马组织铅含量(μg/g);其余上清用BCA 定量检测试剂盒测定总蛋白浓度后,-20℃冻存,Western blot 检测待用。
所有标本铅含量的检测都在四川大学华西第二医院临床检验科完成,采用BH2100T 型原子吸收光谱仪检测铅含量。本实验室血铅检测项目已通过ISO15189 认证和美国病理学会(CAP)认可,实验人员持有培训上岗证。室内质控每天早上1 次,使用挪威SeronormTM Trace Elements Whole Blood 质控品(LOTMR9607),室间质评合格。
1.5 大鼠血浆和脑脊液中瘦素水平检测取与脑脊液编号相同的各组大鼠血浆进行瘦素检测。大鼠血浆和脑脊液中瘦素的检测采用R& D 大鼠瘦素ELISA 试剂盒(MN55413),所有实验过程严格按照说明书进行操作。灵敏度为62.5 pg/mL,批内变异系数为3.3%~4.3%,批间变异系数为4.7%~7.6%。
1.6 大鼠海马中瘦素的分布每组剩下的8 只大鼠用10% 水合氯醛腹腔注射麻醉(0.3 mL/100 g),4% 多聚甲醛经心灌注后取脑,常规固定、脱水、包埋制作石蜡切片。切片脱蜡至水后,PBS (0.01 mol/L,pH=7.4)充分淋洗。每张切片加1 滴3%H2O2,室温避光10 min以封闭内源性过氧化氢酶。微波热修复抗原,PBS冲洗;滴加5%BSA 封闭液,室温20 min 后甩去多余液体,不洗。滴加兔抗大鼠瘦素抗体(1 : 100),4℃过夜。PBS 冲洗后,滴加生物素化山羊抗兔IgG(1 : 100)抗体,37℃孵育30 min,PBS 冲洗后,滴加试剂SABC(1 : 100),室温孵育30 min,PBS冲洗。DAB 室温显色,镜下控制显色时间,蒸馏水洗涤。苏木精轻度复染,脱水后中性树脂封片。光学显微镜下观察并拍照(Olympus 公司,日本)。镜下阳性结构为棕黄色,阴性细胞为蓝色。实验中PBS 冲洗均为冲洗3 次,每次5 min。
1.7 Western blot 法检测海马中瘦素的表达及海马内神经细胞凋亡趋势取步骤1.4 中大鼠海马组织总蛋白提取液,采用SDS-PAGE 电泳对含等量总蛋白的上样量进行分离,先80 V 20 min,再120 V 50 min,蛋白上样量分别为:瘦素120 μg/ 泳道,Bax 和Bcl-280 μg/ 泳道,然后以40 V 转膜3 h 将蛋白转印至PVDF 膜上。将膜放入含5% 脱脂牛奶中室温下封闭1 h 后,加入最适浓度的一抗(瘦素 1 : 100,Bax 1 : 500,Bcl-2 1 : 500),室温条件下摇床孵育1 h 后4℃过夜,内参为β-actin。TBST 洗膜3 次,每次5~10 min,加入最适浓度辣根过氧化物酶标记的二抗(1:10 000),37℃孵育1 h,TBST 洗膜3 次,每次10 min。最后ECL 化学发光显示目的条带,将膜放入凝胶成像仪成像,并用Quantity One 4.6.2(美国)软件分析条带的积分光密度值,以目的蛋白条带和内参β-actin 条带的积分光密度比值表示目的蛋白的相对表达量。
1.8 统计学分析采用SPSS 19.0 统计学软件对数据进行统计学分析,计量资料用均数± 标准差(x±s)表示,多组间比较采用单因素方差分析,进一步组间两两比较采用Dunnett-t 检验;非正态分布计量资料以中位数(四分位间距)[P50 (P25,P75)] 表示,多组间比较采用Kruskal-Wallis H 检验,组间两两比较采用Nemenyi 检验。相关性分析采用Pearson 分析。P<0.05 为差异有统计学意义。
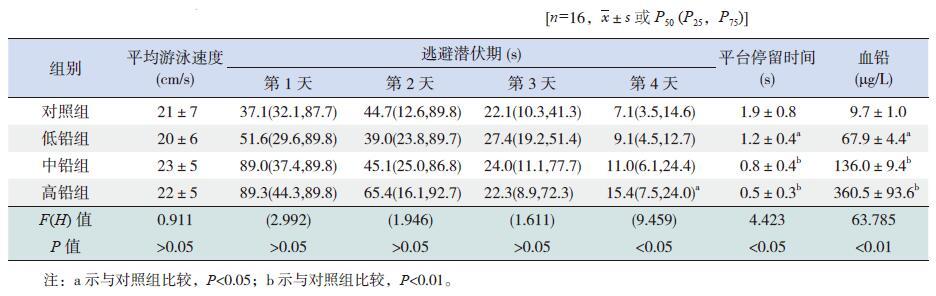
2 结果 2.1 建立铅暴露致认知能力损伤的大鼠模型Morris 水迷宫实验结果显示,各组大鼠在实验中游泳的平均速度差异无统计学意义(P>0.05),经过4 d 的定位航行训练,各组大鼠逃避潜伏期越来越短,前3 d 铅暴露组大鼠逃避潜伏期比对照组略长,但差异无统计学意义(P>0.05),第4 天时高铅组与对照组相比逃避潜伏期延长(P<0.05)。在第5 天的空间探索实验中,3 个铅暴露组大鼠与对照组大鼠相比,平台停留时间明显缩短(P<0.05)。水迷宫实验中,逃避潜伏期主要反映大鼠的学习能力,平台停留时间主要反映大鼠的空间记忆能力。由于大鼠的学习能力可以随着定位航行训练次数的增多而提高,最终达到饱和状态,而空间记忆能力相对恒定[9],因此本实验中把大鼠空间记忆能力作为认知能力的主要指标。水迷宫实验结果说明3 个铅暴露组大鼠与对照组大鼠相比,认知能力受到了损伤。见表 1。
| 表 1 各组大鼠血铅和水迷宫实验结果的比较 |
原子吸收光谱仪检测结果显示,对照组大鼠与低铅组、中铅组和高铅组大鼠血铅水平分别为9.7±1.0 μg/L、67.9±4.4 μg/L、136.0±9.4 μg/L、360.5±93.6 μg/L,差异有统计学意义(F=63.785,P<0.01)。3 个铅暴露组与对照组相比,血铅水平均升高(P<0.05)。见表 1。
各组大鼠水迷宫实验和血铅检测的结果说明,本实验中铅暴露引起认知损伤的大鼠模型成功建立,可以进行后续实验。
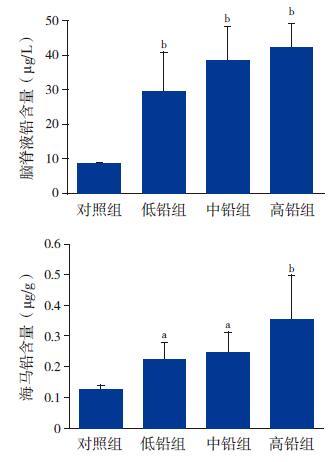
2.2 各组大鼠脑脊液和海马铅含量原子吸收光谱仪检测结果显示,对照组、低铅组、中铅组和高铅组大鼠脑脊液中的铅含量分别为8.4±0.6 μg/L、29.3±11.3 μg/L、38.3±10.1 μg/L、42.2±7.5 μg/L,差异有统计学意义(F=37.096,P<0.01);3 个铅暴露组大鼠与对照组相比,脑脊液中的铅含量均显著升高(P<0.01)。海马中铅含量检测结果显示,对照组、低铅组、中铅组和高铅组大鼠海马中铅含量分别为0.124±0.015 μg/g、0.227±0.048 μg/g、0.244±0.067 μg/g、0.353±0.115 μg/g,差异有统计学意义(F=7.308,P<0.01);且3 个铅暴露组大鼠海马中铅含量均显著高于对照组(P<0.05)。见图 1。
|
图 1 各组大鼠脑脊液和海马中的铅含量(n=8) a 示与对照组比较,P<0.05;b 示与对照组比较,P<0.01。 |
2.3 各组大鼠血浆、脑脊液中瘦素水平的变化
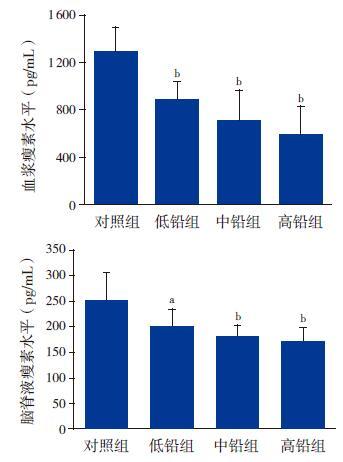
ELISA 检测结果显示,对照组、低铅组、中铅组和高铅组大鼠血浆瘦素水平分别为1 286±213 pg/mL、889±148 pg/mL、702±260 pg/mL、591±235 pg/mL,差异有统计学意义(F=11.747,P<0.01);3 个铅暴露组大鼠与对照组相比,血浆瘦素水平均显著降低(P<0.01)。对照组、低铅组、中铅组和高铅组大鼠脑脊液瘦素水平分别为252±54 pg/mL、201±32 pg/mL、180±22 pg/mL、171±26 pg/mL,差异有统计学意义(F=6.131,P<0.01);且3 个铅暴露组大鼠脑脊液瘦素水平均显著低于对照组(P<0.05)。见图 2。
|
图 2 各组大鼠血浆和脑脊液的瘦素水平(n=8) a 示与对照组比较,P<0.05;b 示与对照组比较,P<0.01。 |
2.4 相关性分析
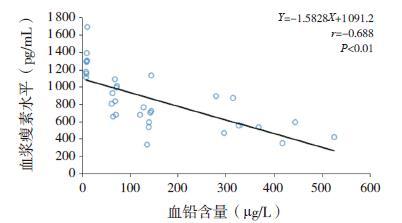
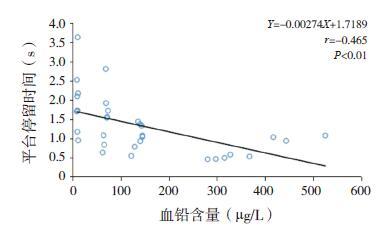
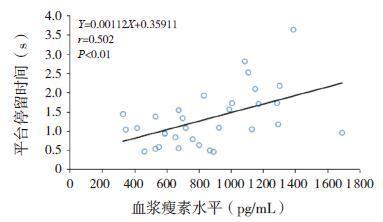
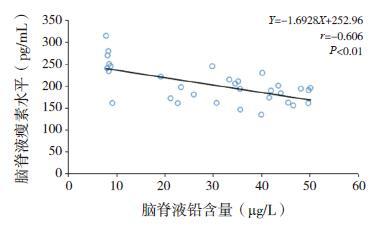
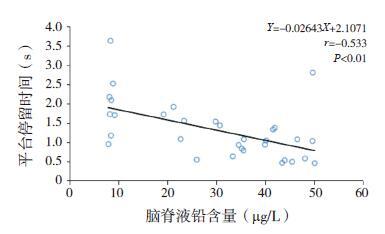
通过Pearson 相关性分析可知,大鼠血浆瘦素水平与血铅水平呈负相关(r=-0.688,P<0.01,图 3);大鼠的认知能力(即平台停留时间)与血铅水平也呈负相关(r=-0.465,P<0.01,图 4);通过进一步相关性分析,发现大鼠的认知能力和血浆瘦素水平呈正相关(r=0.502,P<0.01,图 5)。大鼠脑脊液中瘦素水平和铅含量呈负相关(r=-0.606,P<0.01,图 6);大鼠的认知能力与脑脊液铅含量与呈负相关(r=-0.533,P<0.01,图 7); 而大鼠脑脊液瘦素水平和认知能力无明显相关性(r=0.327,P>0.05)。
|
图 3 大鼠血浆瘦素水平与血铅含量之间的相关分析图 |
|
图 4 大鼠认知能力与血铅含量之间的相关分析图 |
|
图 5 大鼠认知能力与血浆瘦素水平之间的相关分析图 |
|
图 6 大鼠脑脊液瘦素水平与脑脊液铅含量之间的相关分析图 |
|
图 7 大鼠认知能力与脑脊液铅含量之间的相关分析图 |
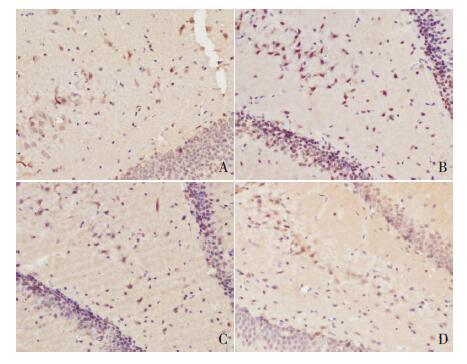
2.5 各组大鼠海马中瘦素蛋白的定位
免疫组化结果表明,各组大鼠海马内均有瘦素蛋白的表达,主要位于海马CA 区锥体神经细胞胞浆内(图 8),齿状回颗粒细胞胞浆内也有瘦素的表达。
|
图 8 各组大鼠海马内瘦素的分布(免疫组化,×400) A、B、C、D 分别为对照组、低铅组、中铅组和高铅组。瘦素阳性表达呈棕色。各组大鼠海马CA 区锥体神经细胞胞浆内均有瘦素的表达,齿状回的颗粒细胞胞浆也有瘦素的表达。 |
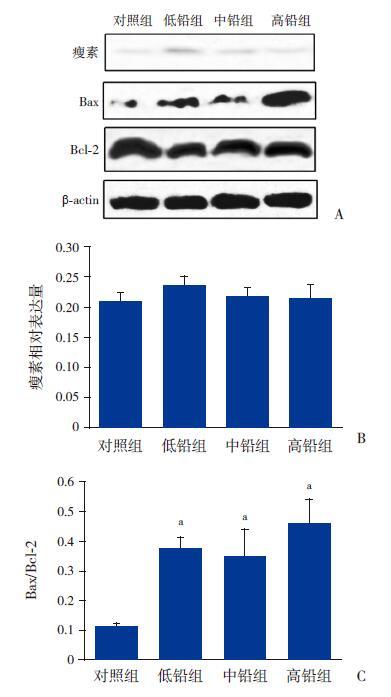
2.6 铅暴露对大鼠海马内瘦素蛋白表达和凋亡的影响
Western blot 结果表明,各组大鼠海马内瘦素蛋白表达水平差异无统计学意义(F=2.835,P>0.05)。Bax/Bcl-2 蛋白比值与对照组相比有显著差异(F=47.256,P<0.01)。3 个铅暴露组与对照组相比,海马内瘦素蛋白表达量略升高但差异无统计学意义(P>0.05)(图 9A、9B)。与对照组相比,3 个铅暴露组大鼠海马内的Bax/Bcl-2 蛋白比值均显著升高(P<0.01)(图 9A、9C)。Bax蛋白有促凋亡作用,Bcl-2 蛋白有抗凋亡作用,比值升高,说明铅暴露组大鼠海马内神经细胞呈凋亡趋势,且随着铅暴露剂量的增加,凋亡趋势越来越明显。
|
图 9 Western blot 检测各组大鼠海马内瘦素蛋白以及Bax 和Bcl-2 蛋白的表达 Figure 9 A:蛋白电泳条带图;B:瘦素的相对表达量统计分析图(n=8);C:Bax/Bcl-2 比值统计分析图(n=8)。a 示与对照组比较,P<0.01。 |
3 讨论
随着人类工业化的发展,铅污染已经从职业污染成为普遍存在的环境污染。儿童由于血脑屏障发育不完善,铅更容易进入中枢神经系统。铅对儿童的神经毒性作用主要表现为不可逆的认知能力受损,且临床上至今没有有效的改善认知损伤的方法,对于铅中毒儿童只能被动排铅以减少铅对机体的持续损伤。因此,铅神经毒性的防治已经成为全球性的环境卫生问题,而探索铅具体的神经毒性机制以及如何改善受损的认知能力也引起了医学界的高度关注。
本实验中大鼠从出生后母乳染铅到断奶后饮水染铅均属于慢性染铅,可以更好的复制儿童慢性铅中毒的病理生理过程。脑脊液主要存在于中枢神经系统的脑室和蛛网膜下腔中,对中枢神经系统起缓冲、保护、运输代谢产物和调节颅内压等作用。生理作用下,脑脊液和血浆之间有血脑屏障,限制相互之间的物质交换,以保持脑脊液自身的理化特性。因此假如中枢神经系统发生病变,或者血脑屏障受损,脑脊液相应的理化性质就会改变。铅可以损伤中枢神经系统且破坏血脑屏障,海马是中枢神经系统中主要负责认知能力的脑区,因此我们选择大鼠的脑脊液和海马作为主要研究对象。
本课题组前期已经用蛋白芯片分析的方法筛选出瘦素在铅中毒儿童和正常儿童血浆中的差异表达,并用临床研究证实了这个结果[8]。动物实验结果表明大鼠血浆瘦素水平和血铅水平呈负相关,且血铅水平和认知能力呈负相关,进一步相关性分析得出大鼠血浆瘦素水平和认知能力呈正相关,因此我们推测瘦素可能参与了铅暴露引起的认知损伤,且对铅暴露大鼠受损的认知能力有一定的保护作用。与对照组相比,铅暴露组脑脊液中铅含量升高,瘦素水平降低,且呈负相关,说明铅暴露可以影响脑脊液中的瘦素水平。脑脊液中瘦素水平只是瘦素发挥中枢作用必经的第一步,后面还有无数个环节影响瘦素生理作用的发挥。瘦素主要存在于海马锥体神经细胞的胞浆内,3 个铅暴露组与对照组相比瘦素表达略升高但差异无统计学意义,具体的机制有待进一步探索。Bax 和Bcl-2 同属于Bcl-2 家族,其中Bax 蛋白有促凋亡作用,Bcl-2 蛋白有抗凋亡作用,细胞的生长状态取决于两者的比值[10]。若比值升高,细胞趋于凋亡;比值降低,则细胞趋于增殖状态。本实验中海马内神经细胞的凋亡趋势增加,说明铅对海马神经细胞的毒性作用引起凋亡,也是铅暴露组大鼠认知能力损伤的机制之一。
瘦素是由瘦素基因(ob-gene)编码,主要由外周白色脂肪组织分泌的激素样蛋白,在血液中的存在形式有游离型和结合型两种。瘦素以主动转运的方式通过血脑屏障,进入中枢神经系统发挥作用。近年来大量研究证实瘦素是一种神经保护因子,动物实验证明,瘦素可以促进AD 小鼠齿状回神经细胞增殖,减少细胞凋亡[11]。Bouret[12] 的研究证明,瘦素可以促进突触、神经元和轴突的生长。直接在小鼠海马内注射瘦素可以提高记忆能力,增强突触可塑性,促进LTP 的诱导[13]。瘦素主要通过和瘦素受体(ObR)结合,发挥相应的生理学作用。ObR 有6 种亚型,分别为ObRa、b、c、d、e 和 f。其中除了ObRe 为可溶性受体外,其余均为跨膜受体,分为胞外域、跨膜域和胞内域。根据胞内域的长短可分为长型受体和短型受体,ObRb 为长型受体,ObRa、c、d、f 均为短型受体,短型受体具体的生理学作用目前的研究相对较少,主要与瘦素的转运和清除有关。ObRb 是唯一能与瘦素结合并激活下游信号转导通路的受体。瘦素受体广泛分布于中枢神经系统中[14],其中下丘脑、海马和小脑尤其多。已知瘦素有6 条经典的信号转导通路,其中ObRb/JAK2/STAT3(STAT5)是最主要的,研究最多的信号转导通路[15]。有研究证明,JAK2/STAT3 通路的激活可以促进胚胎星形胶质细胞的增殖分化[16],可以参与修复受损的神经细胞[17]。本研究中铅暴露可以引起大鼠海马内神经细胞凋亡,认知能力下降,但铅暴露组大鼠海马内瘦素的表达没有降低,我们推测铅暴露可能引起大鼠海马内产生瘦素抵抗,从而导致瘦素不能发挥相应的神经保护作用。瘦素抵抗主要原因有血脑屏障转运障碍,竞争性抑制,ObR 突变和ObR 后细胞信号转导异常这4 种[18],本研究中产生瘦素抵抗的可能原因是ObR 突变或是ObR 后细胞信号转导异常,这也将是我们下一步研究的重点。
总之,铅暴露可以引起大鼠认知能力损伤,血浆和脑脊液中瘦素水平的失调,铅暴露后大鼠海马内瘦素相关的信号转导通路可能出现异常,提示瘦素表达异常与大鼠认知能力损伤的机制有关。
| [1] | Hirsch HV, Lnenicka G, Possidente D, et al. Drosophila melanogaster as a model for lead neurotoxicology and toxicogenomics research[J]. Front Genet , 2012, 3 : 68. |
| [2] | Carpenter DO, Nevin R. Environmental causes of violence[J]. Physiol Behav , 2010, 99 (2) : 260–268. DOI:10.1016/j.physbeh.2009.09.001 |
| [3] | Zhang Y, Proenca R, Maffei M, et al. Positional cloning of the mouse obese gene and its human homologue[J]. Nature , 1994, 372 (6505) : 425–432. DOI:10.1038/372425a0 |
| [4] | Bonda DJ, Stone JG, Torres SL, et al. Dysregulation of leptin signaling in Alzheimer disease:evidence for neuronal leptin resistance[J]. Neurochem , 2014, 128 (1) : 162–172. DOI:10.1111/jnc.12380 |
| [5] | Moult PR, Cross A, Santos SD, et al. Leptin regulates AMPA receptor trafficking via PTEN inhibition[J]. Neurosci , 2010, 30 (11) : 4088–4101. DOI:10.1523/JNEUROSCI.3614-09.2010 |
| [6] | Oomura Y, Hori N, Shiraishi T, et al. Leptin facilitates learning and memory performance and enhances hippocampal CA1 long-term potentiation and CaMK Ⅱ phosphorylation in rats[J]. Peptides , 2006, 27 (11) : 2738–2749. DOI:10.1016/j.peptides.2006.07.001 |
| [7] | Li XL, Aou S, Oomura Y, et al. Impairment of long-term potentiation and spatial memory in leptin receptor-deficient rodents[J]. Neuroscience , 2002, 113 (3) : 607–615. DOI:10.1016/S0306-4522(02)00162-8 |
| [8] | Yang Y, Zhang X, Fu Y, et al. Leptin and IL-8:two novel cytokines screened out in childhood lead exposure[J]. Toxicol Lett , 2014, 227 (3) : 172–178. DOI:10.1016/j.toxlet.2014.03.009 |
| [9] | 郑红, 王文, 刘渝, 等. 重复Morris水迷宫训练提高大鼠空间学习能力却不影响空间记忆能力[J]. 神经解剖学杂志 , 2007, 23 (6) : 599–603. |
| [10] | Karamanolis DG, Kyrlagkitsis I, Konstantinou K, et al. The Bcl-2/Bax system and apoptosis in ulcerative colitis[J]. Hepatogastroenterology , 2007, 54 (76) : 1085–1088. |
| [11] | Pérez-González R, Antequera D, Vargas T, et al. Leptin induces proliferation of neuronal progenitors and neuroprotection in a mouse model of Alzheimer's disease[J]. J Alzheimers Dis , 2011, 24 (Suppl 2) : 17–25. |
| [12] | Bouret SG. Neurodevelopmental actions of leptin[J]. Brain Res , 2010, 1350 : 2–9. DOI:10.1016/j.brainres.2010.04.011 |
| [13] | Harvey J, Shanley LJ, O'Malley D, et al. Leptin:a potential cognitive enhancer?[J]. Biochem Soc Trans , 2005, 33 (Pt 5) : 1029–1032. |
| [14] | Caron E, Sachot C, Prevot V, et al. Distribution of leptin-sensitive cells in the postnatal and adult mouse brain[J]. J Comp Neurol , 2010, 518 (4) : 459–476. DOI:10.1002/cne.v518:4 |
| [15] | Myers MG Jr, Olson DP. SnapShot:neural pathways that control feeding[J]. Cell Metab , 2014, 19 (4) : 732–732. DOI:10.1016/j.cmet.2014.03.015 |
| [16] | Mangoura D, Pelletiere C, Leung S, et al. Prolactin concurrently activates src-PLD and JAK/Stat signaling pathways to induce proliferation while promoting differentiation in embryonic astrocytes[J]. Int J Dev Neurosci , 2000, 18 (7) : 693–704. DOI:10.1016/S0736-5748(00)00031-9 |
| [17] | Zhao JB, Zhang Y, Li GZ, et al. Activation of JAK2/STAT pathway in cerebral cortex after experimental traumatic brain injury of rats[J]. Neurosci Lett , 2011, 498 (2) : 147–152. DOI:10.1016/j.neulet.2011.05.001 |
| [18] | Zhou Y, Rui L. Leptin signaling and leptin resistance[J]. Front Med , 2013, 7 (2) : 207–222. DOI:10.1007/s11684-013-0263-5 |
 2016, Vol. 18
2016, Vol. 18