新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是新生儿时期危害最大的常见病之一,可引起不可逆的脑损伤,导致一系列的神经系统后遗症,25%甚至更多的存活者留有脑性瘫痪、智力落后、癫癎等永久性神经精神缺陷,给社会和家庭带来了沉重的经济精神负担。新生儿HIBD 的发病机理目前尚未完全阐明,其传统治疗并不能完全阻止神经系统后遗症的发生,迄今尚无统一、有效的治疗方案。
最近,在肿瘤及心血管疾病领域的研究表明,有多个小RNA(microRNA,miRNA)与缺氧密切相关,miRNA-210 是其中一个多次出现而倍受关注的miRNA。miRNA-210 是缺氧诱导因子-1α(HIF-1α)的直接转录靶标[1],定位于一个可由缺氧诱导的转录本(AK123483)序列之内[2],而本课题组前期的研究表明miRNA-210 可能通过介导细胞凋亡机制参与新生儿HIBD 的发生发展进程[3-5],证明其在新生儿HIBD 中可能发挥重要作用。脑水肿是围生期HIBD 最基本和重要的病理生理机制之一,然而miRNA-210 与缺氧缺血性脑水肿的关系目前尚未见报道,以miRNA-210 为靶标的研究可能为新生儿缺氧缺血性脑水肿的阐明及防治提供新的理论线索。
1 材料与方法 1.1 材料清洁级健康7 日龄Sprague-Dawley(SD) 大鼠80 只,体重12~15 g,雌雄不限,由南京医科大学实验动物中心提供。miRNA-210 minic、miRNA-210 incubitor 购自Dharmacon 公司;TRIzol Reagent 购自Invitrogen 公司;RevertAid First Strand cDNA synthesis Kit 购自Fermentas 公司;Recombinant DNase Ⅰ(RNase-free)购自宝生物工程(大连)有限公司;Platinum SYBR Green qPCR SuperMix UDG购自Invitrogen 公司。
1.2 动物模型制备及分组新生大鼠随机分为对照组、生理盐水组、miRNA-210 表达抑制组及miRNA-210 过表达组,每组20 只;各组大鼠再随机分为假手术组及缺氧缺血(HI)组,每组10 只。模型制作参考文献[6]:假手术组仅切开颈部皮肤,暴露左侧颈总动脉,将缝合线从左颈总动脉下穿过,不做结扎和缺氧处理;HI 组新生大鼠乙醚吸入麻醉后切开颈部皮肤,游离、结扎左侧颈总动脉,1 h 后置入缺氧仓,以1~2 L/min 的速度输入含8% O2 和92% N2 的混合气体,持续2 h。HI 或假手术术后,使用脑立体定位仪选择人字缝向嘴侧2.0 mm、颞侧1.5 mm为进针点,用微量进样器垂直颅骨骨面进针2.0 mm;向生理盐水组注射生理盐水(2.5 mg/kg),向miRNA-210 表达抑制组注射miRNA-210 incubitor(2.5 mg/kg),向miRNA-210 过表达组注射miRNA-210 minic(2.5 mg/kg);于2 min 内缓缓注射完毕,留针30 s 后徐徐退出;对照组不注射。放回含常氧的鼠笼中由母鼠喂养,3 d 后断头取大脑组织,中央纵切开,5 只取左侧脑组织50 mg 置于液氮中保存,用于基因表达检测,其余脑组织置于中性甲醛和戊二醛中保存;5 只取左侧脑组织用做脑组织含水量检测。
1.3 荧光定量PCR 检测miRNA-210 表达水平取50 mg 脑组织,用TRIzol 一步法提取总RNA,经电泳显示28 s、18 s 清晰的2 条带,测定A260/A280 比值大于1.8,应用荧光定量PCR 法检测脑组织中miRNA-210 的表达水平。miRNA-210 上游引物序列:5'-ATTATACAATAGTGCAGGGTCCGAGGTATT-3',下游引物序列:5'-TAAAATATTACTGTGCGTGTGACAGCGG-3',片段长度77 bp; 内参照U6 上游引物序列:5'-CCTGCTTCGGCAGCACATAT-3',下游引物序列:5'-TTTGCGTGTCATCCTTGCG-3',片段长度81 bp。PCR 反应体系10 μL,包括cDNA 模板1 μL,上下游引物各0.3 μL,2×SYBR Green Master Mix5 μL,无RNA 酶水3.4 μL。PCR 扩增反应条件为:50 ℃ 3 min;95 ℃ 3.5 min;95 ℃ 15 s,61 ℃1 min,72℃ 30 s,循环40 次。采用相对定量法计算miRNA-210 的表达水平(Q),用内参(U6)校正样品初始量,定量公式为:Q=2- △△ Ct,Ct 值为每个反应管内的荧光信号到达设定的阈值时所经历的循环数。
1.4 脑组织含水量测定取完整左侧脑组织用电子天平精确称量湿重,置于烘箱内110℃烘烤至恒重,称取干重,用公式[(湿重- 干重)/ 湿重] 计算含水量。
1.5 苏木精- 伊红染色将脑组织固定于10% 福尔马林溶液内,常规取材、脱水、石蜡包埋、制片,行苏木精- 伊红染色,光学显微镜下观察脑组织形态改变。
1.6 统计学分析采用SPSS 18.0 统计软件对数据进行统计学分析,正态分布计量资料以均数± 标准差(x±s)表示,多组间比较采用方差分析,两组间比较采用t 检验,P<0.05 为差异有统计学意义。
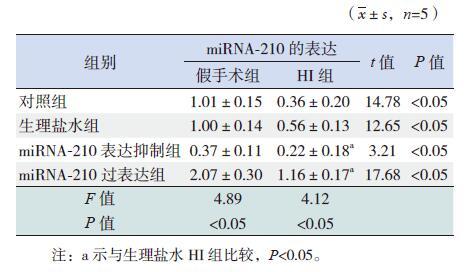
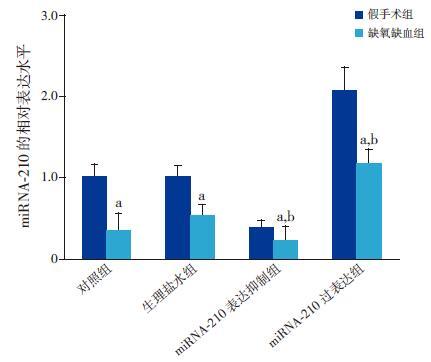
2 结果 2.1 各组脑组织中miRNA-210 的表达各组HI 新生大鼠脑组织中miRNA-210 的表达水平较相应假手术组均显著下调(P<0.05)。对照HI 组与生理盐水HI 组中miRNA-210 的表达水平比较差异无统计学意义(P>0.05);miRNA-210表达抑制HI 组中miRNA-210 的表达水平较生理盐水HI 组显著下调(P<0.05);miRNA-210 过表达HI 组中miRNA-210 的表达水平较生理盐水HI 组显著上调(P<0.05)。见图 1,表 1。
|
图 1 荧光定量PCR 检测各组脑组织中miRNA-210的表达情况(n=5) a 示与各自假手术组比较,P<0.05;b 示与生理盐水HI 组比较,P<0.05。 |
| 表 1 脑组织中miRNA-210 的表达情况 |
2.2 各组脑组织含水量
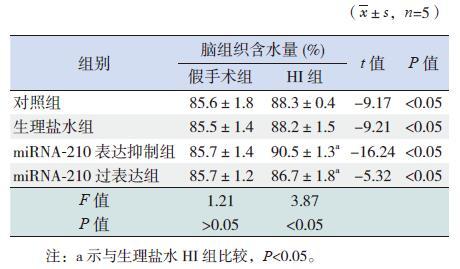
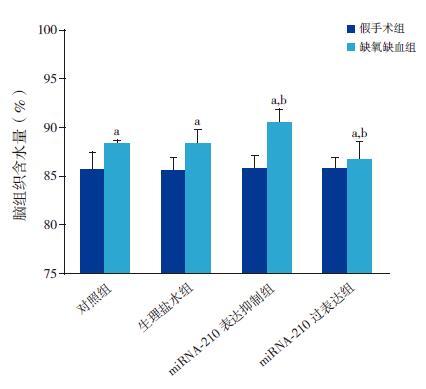
各组HI 新生大鼠脑组织含水量较相应假手术组均显著上调(P<0.05)。对照HI 组与生理盐水HI 组脑组织含水量比较差异无统计学意义(P>0.05);miRNA-210 表达抑制HI 组较生理盐水HI 组的脑组织含水量显著上调(P<0.05);miRNA-210 过表达HI 组较生理盐水HI 组的脑组织含水量显著下调(P<0.05)。见图 2,表 2。
|
图 2 miRNA-210 对新生大鼠脑组织含水量的影响(n=5) a 示与各自假手术组比较,P<0.05;b 示与生理盐水HI 组比较,P<0.05。 |
| 表 2 miRNA-210 对新生大鼠脑组织含水量的影响 |
2.3 脑组织形态学改变
对照假手术组与生理盐水假手术组光镜结果显示:脑组织由灰质及白质组成,各层次结构清晰,各部位神经细胞大小形态正常,无变性、坏死,胶质细胞无明显增生,间质无水肿及炎性细胞浸润,无血管袖套现象。对照HI 组及生理盐水HI 组可见神经元胞体肿胀、胶质细胞增生、细胞间隙增宽。miRNA-210 表达抑制两组可见细胞排列紊乱、结构不清、神经元变性,部分神经细胞核固缩变圆呈强嗜碱性、胞浆红染加深、核浓缩、胶质细胞增生活跃,miRNA-210 表达抑制HI 组较miRNA-210 表达抑制假手术组水肿改变更明显,肿胀神经元分布更广泛,可见到明显的梗死灶。而miRNA-210 过表达两组水肿改变明显改善。见图 3。
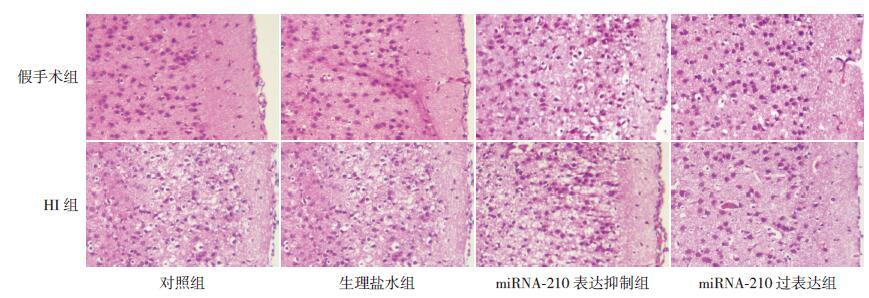
|
图 3 脑组织形态学改变(苏木精- 伊红染色,×200) miRNA-210 表达抑制HI 组水肿改变最明显,肿胀神经元分布广泛,可见明显梗死灶,miRNA-210 过表达HI 组水肿改变明显改善。 |
3 讨论
近年的报道显示,miRNA-210 在各种缺氧细胞[2, 7-8] 及急性脑缺血小鼠模型[9] 中表达上调,然而本研究结果表明miRNA-210 的表达在HI 后72 h 的脑组织中表达显著下调。据文献报道,miRNA-210 是HIF-1α 的直接转录靶标,而HIF-1α蛋白水平在大鼠脑HI 后3 h 达高峰,之后逐渐降低,6 h 时达基础水平[10];在大脑中动脉闭塞的狗模型中,HIF-1α 蛋白在大脑皮层中8 h 达高峰,之后逐渐下降[11]。因此,miRNA-210 的表达水平也可能在HI 损伤后先上升后下降。进一步检索发现,Liu 等[12] 报道miRNA-210 在脑缺血24 h 后在脑及血液中表达显著下调;动物及细胞的结果显示miRNA-210 在缺氧后立即升高,之后几天逐步下调[7, 13]。而本研究结果反映的是miRNA-210 在HIBD 后72 h 的表达情况,因此有必要进一步研究miRNA-210 在HIBD 后不同时间点的表达情况。
脑水肿是新生儿HIBD 病理生理机制中基本和重要的改变,脑水肿的发生会进一步加重脑组织的HI,从而形成恶性循环,最终造成脑组织不可逆的损伤,但目前有关HI 后脑水肿形成的机制尚未完全阐明。本研究脑组织含水量及形态学的结果提示miRNA-210 过表达可减轻HI 后的脑水肿,而miRNA-210 表达抑制导致脑水肿加重。由此,可以推断HI 后脑组织中miRNA-210 的表达下调可能是缺氧缺血性脑水肿病理损伤的分子机制之一,而miRNA-210 表达增加可能改善脑水肿,为新生儿缺氧缺血性脑水肿的治疗提供一个新的研究方向。
水通道蛋白-4(aquaporin-4,AQP-4)是分布在脑组织中的主要水通道蛋白,具有选择性的水转运功能,在组织器官水肿发生的分子机制中起着重要作用。近年的研究发现,AQP-4 的表达下调与新生儿HIBD 时脑水肿的形成有关,可能在其发生发展中起调控作用[14-15]。运用在线软件分析查询,发现AQP-4 的碱基序列“ACGCACA”与miRNA-210 的保守序列“UGCGUGU” 完全匹配,提示AQP-4 可能为miRNA-210 的靶标。检索文献发现目前尚无文献报道二者的关系,因此,进一步探索miRNA-210 是否通过调控AQP-4 的表达参与新生儿HIBD 脑水肿的发生发展有助于揭示miRNA-210改善新生儿缺氧缺血性脑水肿的机制。综上所述,新生大鼠HIBD 后miRNA-210 的表达下调,其下调可能参与了新生大鼠缺氧缺血性脑水肿的发生发展,过表达miRNA-210 可减轻脑水肿的发生,有望为新生儿HIBD 的预防和治疗提供新的途径。
| [1] | Ivan M, Harris AL, Martelli F, et al. Hypoxia response and microRNAs:no longer two separate worlds[J]. J Cell Mol Med , 2008, 12 (5A) : 1426–1431. DOI:10.1111/jcmm.2008.12.issue-5a |
| [2] | Camps C, Buffa FM, Colella S, et al. hsa-miR-210 is induced by hypoxia and is an independent prognostic factor in breast cancer[J]. Clin Cancer Res , 2008, 14 (5) : 1340–1348. DOI:10.1158/1078-0432.CCR-07-1755 |
| [3] | Qiu J, Zhou XY, Zhou XG, et al. Neuroprotective effects of microRNA-210 on hypoxic-ischemic encephalopathy[J]. Biomed Res Int , 2013, 2013 : 350419. |
| [4] | Qiu J, Zhou XY, Zhou XG, et al. MicroRNA-210 knockdown contributes to apoptosis caused by oxygen glucose deprivation in PC12 cells[J]. Mol Med Rep , 2015, 11 (1) : 719–723. |
| [5] | Qiu J, Zhou XY, Zhou XG, et al. Neuroprotective effects of microRNA-210 against oxygen-glucose deprivation through inhibition of apoptosis in PC12 cells[J]. Mol Med Rep , 2013, 7 (6) : 1955–1959. |
| [6] | Rice JE 3rd, Vannucci RC, Brierley JB. The influence of immaturity on hypoxic-ischemic brain damage in the rat[J]. Ann Neurol , 1981, 9 (2) : 131–141. DOI:10.1002/(ISSN)1531-8249 |
| [7] | Fasanaro P, D'Alessandra Y, Di Stefano V, et al. MicroRNA-210 modulates endothelial cell response to hypoxia and inhibits the receptor tyrosine kinase ligand Ephrin-A3[J]. J Biol Chem , 2008, 283 (23) : 15878–15883. DOI:10.1074/jbc.M800731200 |
| [8] | Giannakakis A, Sandaltzopoulos R, Greshock J, et al. miR-210 links hypoxia with cell cycle regulation and is deleted in human epithelial ovarian cancer[J]. Cancer Biol Ther , 2008, 7 (2) : 255–264. DOI:10.4161/cbt.7.2.5297 |
| [9] | Jeyaseelan K, Lim KY, Armugam A. MicroRNA expression in the blood and brain of rats subjected to transient focal ischemia by middle cerebral artery occlusion[J]. Stroke , 2008, 39 (3) : 959–966. DOI:10.1161/STROKEAHA.107.500736 |
| [10] | van den Tweel ER, Kavelaars A, Lombardi MS, et al. Bilateral molecular changes in a neonatal rat model of unilateral hypoxic-ischemic brain damage[J]. Pediatr Res , 2006, 59 (3) : 434–439. DOI:10.1203/01.pdr.0000200799.64038.19 |
| [11] | Mu D, Jiang X, Sheldon RA, et al. Regulation of hypoxia-inducible factor 1alpha and induction of vascular endothelial growth factor in a rat neonatal stroke model[J]. Neurobiol Dis , 2003, 14 (3) : 524–534. DOI:10.1016/j.nbd.2003.08.020 |
| [12] | Liu DZ, Tian Y, Ander BP, et al. Brain and blood microRNA expression profiling of ischemic stroke,intracerebral hemorrhage,and kainate seizures[J]. J Cereb Blood Flow Metab , 2010, 30 (1) : 92–101. DOI:10.1038/jcbfm.2009.186 |
| [13] | Zeng L, Liu J, Wang Y, et al. MicroRNA-210 as a novel blood biomarker in acute cerebral ischemia[J]. Front Biosci (Elite Ed) , 2011, 3 : 1265–1272. |
| [14] | 吕莹, 程春华, 姜伟, 等. 缺氧缺血脑损伤新生鼠脑组织AQP-4表达的研究[J]. 中国妇幼保健 , 2014, 29 (32) : 5307–5309. |
| [15] | 毛娟, 余加林, 付雪梅, 等. 新生大鼠缺氧缺血脑组织水肿及水通道蛋白-4的表达变化[J]. 四川大学学报(医学版) , 2014, 45 (3) : 386–389. |
 2016, Vol. 18
2016, Vol. 18