脑胶质瘤亦称为神经胶质细胞瘤,它起源于神经上皮细胞,主要包括星形胶质细胞瘤、少突胶质细胞瘤、室管膜细胞瘤、髓母细胞瘤等,占儿童颅内肿瘤的70%~86%[1]。尽管磁共振成像对诊断脑胶质瘤有着革命性推动[2],但最近20 年里儿童脑胶质瘤的治疗并未取得明显进展。儿童脑胶质瘤的临床治疗以手术切除为主,易复发,死亡率高。近年来,人们逐渐接受这样的观点:即肿瘤组织学特点有助于评估恶性肿瘤的侵袭性行为,故脑胶质瘤患儿术后是否放疗、化疗或生物治疗主要取决于其病理组织学诊断。随着分子生物学技术的发展,临床上对肿瘤的特点有了进一步认识,如何更加客观地综合评价小儿脑胶质瘤的恶性程度已经成为小儿神经外科医师关注的焦点。磷酸肌醇4磷酸(phosphatidylinositol 4-phosphate,PI4P)在高尔基体是含量相对丰富的磷脂酰肌醇。目前研究发现,PI4P 和PI4P 结合蛋白(GOLPH3)参与丙型肝炎病毒分泌过程[3],而GOLPH3 在多种实体肿瘤中高表达[4-7],并对癌细胞迁移及侵袭具有促进作用[8]。但PI4P 是否影响脑胶质瘤细胞的侵袭迁移,尚未见报道。本实验旨在通过建立过表达或沉默PI4P 细胞系,了解PI4P 对人脑胶质瘤U87 细胞侵袭迁移的影响,为脑胶质瘤的基础研究及临床治疗提供新的研究及治疗靶点。
1 材料与方法 1.1 材料人脑胶质瘤U87 细胞及人胚肾细胞(HEK293T) 均购自上海中科院细胞库; 质粒:LV-Helper1、LV-Helper2、pWPXLd-puro、pWPXLd-PI4P、pLL3.7-Scramble、pLL3.7-shPI4P购自Addgene 公司;DMEM 培养基购自杭州吉诺生物医药技术有限公司;胎牛血清购自杭州四季青公司;PI4P 一抗及兔二抗均购自碧云天生物技术研究所。
1.2 细胞培养37℃、5% CO2、饱和湿度条件下培养U87 细胞及HEK293T。待细胞处于对数生长期铺满80%培养瓶底时传代一次,该两种细胞每周约传2~3 代。
1.3 慢病毒包装慢病毒包装系统包括有效序列载体质粒pWPXLd-PI4P、包装质粒LV-Helper1 和包膜质粒LV-Helper2。根据质粒抽提试剂盒说明书提取3 种质粒的DNA,将DNA 溶于灭菌后的去离子水中,以紫外光吸收法测定其浓度及纯度,保证所提质粒的吸光度值在1.8~2.0 之间。转染前24 h 用胰蛋白酶消化对数生长期的HEK293T 细胞,加入到6孔板内,细胞密度为0.6×109/L。LV-Helper1、LVHelper2及pWPXLd-PI4P 质粒( 质量比1 : 1 : 2)中加入opti 500 μL,然后加入PolyJet 10 μL 立即混匀,室温静置30 min,将其转移至预先处理过的HEK293T 细胞中,12 h 后更换培养基,72 h 后收集上清,即pWPXLd-PI4P 慢病毒。pWPXLdpuro、pLL3.7-Scramble、pLL3.7-shPI4P 慢病毒包装同上。
1.4 分组用公司购买的过表达PI4P 质粒及沉默PI4P 质粒,包装pWPXLd-puro、pWPXLd-PI4P、pLL3.7-Scramble、pLL3.7-shPI4P 慢病毒,构建过表达PI4P 组及沉默PI4P 组细胞系。过表达PI4P 组,又分为过表达对照组(过表达pWPXLd-puro 空载体)、过表达实验组(过表达pWPXLd-PI4P 质粒);沉默PI4P 组分为沉默对照组( 过表达pLL3.7-Scramble 空载体)、沉默实验组(pLL3.7-shPI4P质粒)。
1.5 细胞系构建取包装后的pWPXLd-puro、pWPXLd-PI4P、pLL3.7-Scramble、pLL3.7-shPI4P 慢病毒各1 mL,加入到U87 细胞(U87 细胞胰酶消化后加入到6孔板内,密度为70%)中,然后加入polybrance5 μg,24 h 后换液,72 h 后荧光显微镜观察绿色荧光蛋白表达情况,加入polypuro 5 μL(质粒含有puro 标签,具有抗puro 性),构建成功的细胞呈绿色荧光,筛选后扩大培养。
1.6 细胞划痕实验将U87-GFP、U87-GFP-PI4P、U87-Scramble、U87-shPI4P 细胞铺于6 孔板中,贴壁后PBS 冲洗3 次,加入无血清培养基,继续培养5 h,倒置显微镜观察。用10 μL 微量移液头在6 孔板内垂直划痕,PBS 冲洗3 次后加入无血清培养基,于0 h(细胞划痕即为0 h)、24 h(细胞划痕后24 h)随机选择 5 个视野(100×),计算迁移到划痕空隙中的细胞。实验重复3 次。
1.7 细胞体外侵袭试验将无菌Transwell 小室置于24 孔板中,Transwell 小室内为上室,24 孔板内为下室,取稀释的Martrigel 胶加入上室中,50 μL/ 孔,37℃培养1 h。用200 μL/ 孔的无血清培养基水化基质胶,37℃,培养3 h。细胞计数,用无血清培养基将细胞最终稀释为3×104/mL。将上室水化的培养基洗净后加入200 μL 细胞悬液,下室加入500 μL 含10% 胎牛血清(FCS)的培养基(注意:操作过程中不能出现气泡),将24 孔板放入37℃培养箱培养40 h。取出24 孔板,将小室内细胞悬液洗净,用棉签轻轻拭去上室的非侵袭细胞,将Transwell小室倒置晾干,用4% 甲醛固定30 min。取一废用24 孔板,每孔加入500 μL、0.1% 结晶紫染液,将Transwell 小室置于其中,室温或37℃ 10 min,PBS 洗涤小室,风干,显微镜下观察拍照(拍带孔的层面)。
1.8 Western blot 检测PI4P 蛋白表达用RIPA 裂解液裂解细胞提取总蛋白,BCA试剂盒检测蛋白浓度。12% SDS-PAGE 电泳,恒流转膜,加入PI4P 一抗(1 : 2 000)封闭、4℃过夜,室温孵育2 h,TBST 洗膜后加入HRP 标记的羊抗兔二抗(1 : 6 000),室温1 h,TBST/PBS 洗膜,化学法曝光显影,冲洗胶片。Image J 软件分析条带灰度值,目的蛋白表达量以目的蛋白/β-actin 的比值表示。
1.9 统计学分析用Image J、IP 6.0、SPSS 13.0、Photoshop 软件进行统计分析及作图。数据以均数± 标准差(x±s)表示,两组之间比较采用t 检验。P<0.05为差异有统计学意义。
2 结果 2.1 包装慢病毒用pWPXLd-puro、pWPXLd-PI4P、pLL3.7-Scramble、pLL3.7-shPI4P 质粒及LV-Helper1,LV-Helper2 质粒转染HEK293T 细胞,包装pWPXLdpuro及pWPXLd-PI4P、pLL3.7-Scramble、pLL3.7-shPI4P 慢病毒,荧光显微镜下观察暗场(绿色荧光)与明场下细胞比值达占80% 以上,提示转染成功(图 1)。
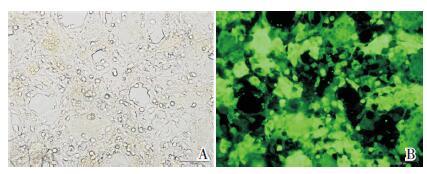
|
图 1 荧光显微镜观察转染情况(100×) A:荧光显微镜明场下观察HEK293T 细胞;B:暗场(绿色荧光)下观察HEK293T 细胞绿色荧光蛋白表达,提示病毒构建成功。 |
2.2 细胞系构建,并检测细胞中PI4P 蛋白表达
用包装好的慢病毒侵染U87 细胞,免疫荧光观察转染效率在80% 以上,构建U87-GFP、U87-GFP-PI4P、U87-Scramble、U87-shPI4P 细胞系成功(图 2A~B)。Western blot 检测出过表达PI4P 的U87-GFP-PI4P 细胞系中PI4P 表达较对照组U87-GFP 细胞系增高;而沉默PI4P 的U87-shPI4P 细胞系中PI4P 表达较对照组U87-Scramble 细胞系减少(图 2C~D)。
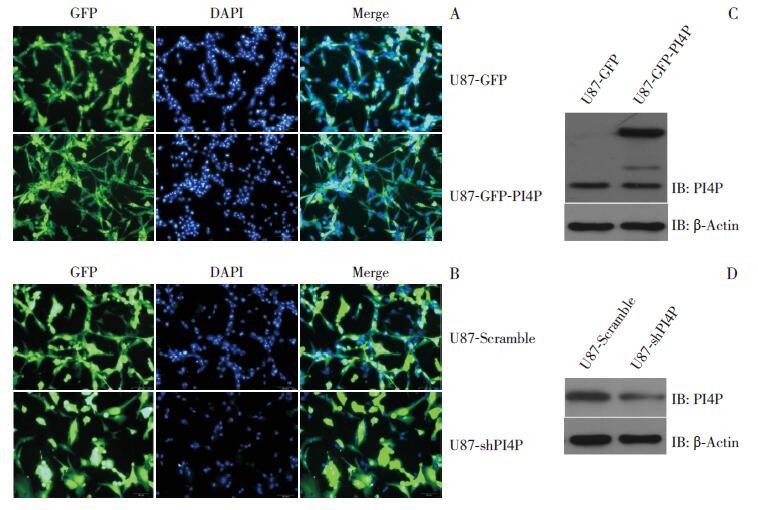
|
图 2 慢病毒侵染U87 细胞,构建细胞系 A:用包装成功的pWPXLd-puro 及pWPXLd-PI4P 慢病毒侵染U87 细胞,荧光显微镜(100×)暗场观察绿色荧光表达情况,GFP 即为表达目的蛋白 PI4P 的细胞,DAPI 为单个视野内所有细胞,Merge 后观察到总细胞中表达PI4P 的细胞数目(≥ 80% 的细胞都有绿色荧光蛋白表达),提示细胞系构建成功;B:用包装成功的pLL3.7-Scramble、pLL3.7-shPI4P 慢病毒侵染U87 细胞,荧光显微镜(100×)暗场观察表达绿色荧光,提示细胞系构建成功;C~D:Western blot 检测过表达和沉默PI4P 后的PI4P 蛋白表达情况。 |
2.3 细胞迁移能力改变
过表达PI4P 的U87-GFP-PI4P 细胞系较对照组U87-GFP 细胞系迁移能力增强,差异有统计学意义(t=33.15、P=0.001),见图 3A、3C; 沉默PI4P 的U87-shPI4P 细胞系较对照组U87-Scramble细胞系迁移能力减弱,差异有统计学意义(t=18.34,P=0.002),见3B、3D。

|
图 3 划痕实验检测PI4P 对胶质瘤细胞迁移的影响(n=6) A、C:荧光显微镜下(100×)观察过表达PI4P的U87-GFP-PI4P 细胞系垂直划痕24 h 后划痕愈合能力较对照组U87-GFP 强;a 示与对照组U87-GFP 细胞系比较,P<0.05。B、D:荧光显微镜下(100×)观察沉默PI4P 的细胞垂直划痕24 h 后划痕愈合能力较对照组U87-Scramble 细胞系差;a 示与对照组U87-Scramble 细胞系比较,P<0.05。 |
2.4 细胞侵袭能力的改变
过表达PI4P 的U87 细胞侵袭能力较对照组强,差异有统计学意义(t=15.35,P=0.01),见图 4A、4C;沉默PI4P 的U87-shPI4P 细胞系较对照组U87-Scramble 侵袭能力减弱,差异有统计学意义(t=13.26,P=0.01),见图 4B、4D。
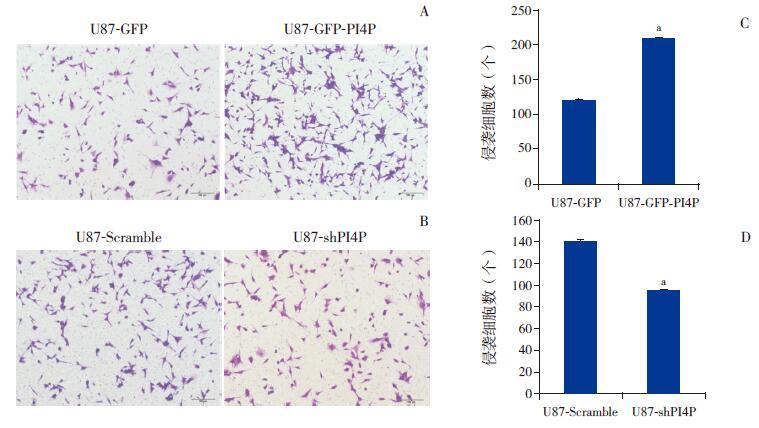
|
图 4 Transwell 检测过表达和沉默PI4P 后U87 细胞的侵袭能力(n=3) A、C:显微镜下(100×)过表达PI4P 组的细胞侵袭能力强于对照组U87-GFP 细胞系;a 示与对照组U87-GFP 细胞系比较,P<0.05。B、D:显微镜下(100×)沉默PI4P 的U87-shPI4P 细胞系较对照组U87-Scramble 细胞系侵袭能力减弱;a 示与对照组U87-Scramble 细胞系比较,P<0.05。 |
3 讨论
脑胶质瘤在颅内恶性肿瘤中占首位,脑胶质瘤细胞具有增殖能力强,凋亡率低,高侵袭迁移能力等特点,手术反而可能导致脑胶质瘤恶性程度提高、短期内再发,因此其难以通过手术治愈,死亡率极高[9-10]。
肿瘤细胞的侵袭与迁移是决定肿瘤细胞转移能力的两个重要因素。局部侵袭性生长的特性往往是胶质瘤难以根治和复发的根本原因,也是直接导致肿瘤难以全切、术后复发率高、预后差的主要原因。因此,有关胶质瘤的抗侵袭迁移治疗具有重要的研究意义。PI4P 是广泛存在于细胞膜中带负电荷的一种磷脂,虽然含量较低,却是生物膜中重要的组成部分,在膜的通透性、囊泡运输、膜的转移、细胞骨架调整及信号传导通路中均发挥着重要作用。PI4P 在高尔基体含量相对丰富。在肝炎中PI4P 与PI4P 结合蛋白(GOLPH3)相互作用[3],而GOLPH3 在多种实体肿瘤中高表达,并对癌细胞增殖、侵袭迁移具有促进作用[8, 11-14],而GOLPH3 在人脑胶质瘤中通过调节RhoA 调节胶质瘤细胞的侵袭迁移[15]。PI4P 下调可以诱导细胞凋亡[16];另有报道指出,PI4P 能够调节乳腺癌细胞的粘附与迁移,促进肿瘤的进展[17]。而PI4P 是否可以调节胶质瘤细胞侵袭迁移尚未见相关报道。
基于以上研究,我们通过慢病毒侵染U87 细胞,建立了过表达和沉默PI4P 的细胞系,通过Western blolt 检测到各细胞系中PI4P 表达,提示细胞系构建成功,我们分别通过细胞侵袭实验和划痕实验来了解PI4P 对U87 细胞的侵袭迁移能力的影响,得知PI4P 可以促进人脑胶质瘤U87 细胞的侵袭迁移,然而其相关机制尚需我们将进一步研究。
总之,本研究发现PI4P 可以促进人脑胶质瘤U87 细胞的侵袭迁移,为研究人类脑胶质瘤的发生机制提供了又一个基础平台,为进一步治疗脑胶质瘤提供了新的治疗靶点。
| [1] | Packer RJ. Brain tumors in children[J]. Arch Neurol , 1999, 56 (4) : 421–425. DOI:10.1001/archneur.56.4.421 |
| [2] | Albright AL, Packer RJ, Zimmerman R, et al. Magnetic resonance scans should replace biopsies for the diagnosis of diffuse brain stem gliomas:a report from the Children's Cancer Group[J]. Neurosurgery , 1993, 33 (6) : 1026–1029. DOI:10.1227/00006123-199312000-00010 |
| [3] | Bishé B, Syed GH, Field SJ, et al. Role of phosphatidylinositol 4-phosphate (PI4P) and its binding protein GOLPH3 in hepatitis C virus secretion[J]. J Biol Chem , 2012, 287 (33) : 27637–27647. DOI:10.1074/jbc.M112.346569 |
| [4] | Li H, Guo L, Chen SW, et al. GOLPH3 overexpression correlates with tumor progression and poor prognosis in patients with clinically N0 oral tongue cancer[J]. J Transl Med , 2012, 10 : 168. DOI:10.1186/1479-5876-10-168 |
| [5] | Wang JH, Chen XT, Wen ZS, et al. High expression of GOLPH3 in esophageal squamous cell carcinoma correlates with poor prognosis[J]. PLoS One , 2012, 7 (10) : e45622. DOI:10.1371/journal.pone.0045622 |
| [6] | Kunigou O, Nagao H, Kawabata N, et al. Role of GOLPH3 and GOLPH3L in the proliferation of human rhabdomyosarcoma[J]. Oncol Rep , 2011, 26 (5) : 1337–1342. |
| [7] | Scott KL, Kabbarah O, Liang MC, et al. GOLPH3 modulates mTOR signalling and rapamycin sensitivity in cancer[J]. Nature , 2009, 459 (7250) : 1085–1090. DOI:10.1038/nature08109 |
| [8] | Dai T, Zhang D, Cai M, et al. Golgi phosphoprotein 3(GOLPH3) promotes hepatocellular carcinoma cell aggressiveness by activating the NF-kappaB pathway[J]. J Pathol , 2015, 235 (3) : 490–501. DOI:10.1002/path.4479 |
| [9] | Dolecek TA, Propp JM, Stroup NE, et al. CBTRUS statistical report:primary brain and central nervous system tumors diagnosed in the United States in 2005-2009[J]. Neuro Oncol , 2012, 14 (Suppl 5) : v1–v49. DOI:10.1093/neuonc/nos218 |
| [10] | Chen J, McKay RM, Parada LF. Malignant glioma:lessons from genomics,mouse models,and stem cells[J]. Cell , 2012, 149 (1) : 36–47. DOI:10.1016/j.cell.2012.03.009 |
| [11] | Zhang Y, Ma M, Han B. GOLPH3 high expression predicts poor prognosis in patients with resected non-small cell lung cancer:an immunohistochemical analysis[J]. Tumour Biol , 2014, 35 (11) : 10833–10839. DOI:10.1007/s13277-014-2357-3 |
| [12] | Peng J, Fang Y, Tao Y, et al. Mechanisms of GOLPH3 associated with the progression of gastric cancer:a preliminary study[J]. PLoS One , 2014, 9 (10) : el07362. |
| [13] | Ma Y, Ren Y, Zhang X, et al. High GOLPH3 expression is associated with a more aggressive behavior of epithelial ovarian carcinoma[J]. Virchows Archiv , 2014, 464 (4) : 443–452. DOI:10.1007/s00428-014-1536-3 |
| [14] | JianXin J, Cha Y, ZhiPeng L, et al. GOLP3 is a predictor of survival in patients with hepatocellular carcinoma[J]. Clin Invest Med , 2014, 37 (4) : E233–E242. |
| [15] | Zhou X, Zhan W, Bian W, et al. GOLPH3 regulates the migration and invasion of glioma cells though RhoA[J]. Biochem Biophys Res Commun , 2013, 433 (3) : 338–344. DOI:10.1016/j.bbrc.2013.03.003 |
| [16] | Chu KME, Minogue S, Hsuan JJ, et al. Differential effects of the phosphatidylinositol 4-kinases,PI4KⅡalpha and PI4KⅢbeta,on Akt activation and apoptosis[J]. Cell Death Dis , 2010, 1 (12) : el06. |
| [17] | Tokuda E, Itoh T, Hasegawa J, et al. Phosphatidylinositol 4-phosphate in the Golgi apparatus regulates cell-cell adhesion and invasive cell migration in human breast cancer[J]. Cancer Res , 2014, 74 (11) : 3054–3066. DOI:10.1158/0008-5472.CAN-13-2441 |
 2016, Vol. 18
2016, Vol. 18

 , 王磊
, 王磊