自发现同源性磷酸酶张力蛋白诱导的激酶1 (phosphatase and tensin homolog deleted on chromosome ten induced kinase 1,PINK1)与帕金森病相关以来,研究者一直在探究其生物学功能。PINK1 位于线粒体外膜,具有激酶活性,在高能耗的器官如心脏、脑、肝、肌肉等组织高表达[1-2]。PINK1蛋白在帕金森疾病领域中研究最为广泛[3-4],但随着对其功能研究的深入,在其他疾病领域也逐渐受到关注。
1 PINK1 的结构PINK1 基因由8 个外显子组成,编码产生一个由581 个氨基酸残基组成的PINK1 蛋白。成熟PINK1 蛋白是由其前体蛋白经胞质转运至线粒体中剪切而成的核编码线粒体蛋白,具有激酶活性,可以与细胞质中的蛋白质作用。PINK1 蛋白跨膜区(101~107 位氨基酸)是保证PINK1 蛋白激酶功能区位于细胞质的关键[5],其存在表明PINK1蛋白是一个膜内在蛋白。PINK1 蛋白C 末端定位于线粒体的双膜间隙。N 末端存在一个线粒体锚定序列,是PINK1 蛋白定位在线粒体的标志。PINK1蛋白35 位及77 位氨基酸分别存在1 个酶切位点,在156~509 位氨基酸存在1 个丝氨酸/ 苏氨酸激酶区域[5-6]。研究表明,PINK1 基因的突变将严重影响其蛋白激酶活性,这与帕金森疾病发病密切相关[2, 7]。
2 PINK1 蛋白的激酶活性PINK1 具有丝氨酸/ 苏氨酸激酶活性(图 1)。研究提示PINK1 基因p.K219A、p.G309D、p.G409V、p.E417G 等的突变降低PINK1 的激酶活性[8-11]。PINK1 蛋白的C 末端被认为与激酶活性相关,尽管其相关性尚不明确,但C 末端氨基酸序列的突变往往导致患者出现帕金森病早期症状[12]。PINK1的激酶特性是它的主要功能:PINK1 与肿瘤坏死因子受体相关蛋白1(tumor necrosis factor receptorassociated protein 1,TRAP1)共同位于线粒体外膜,PINK1 可以磷酸化TRAP1 后抑制细胞色素C 的释放及H2O2 诱导的细胞凋亡,而TRAP1 的缺失,将使PINK1 失去保护细胞的作用[13];作为帕金森相关蛋白Parkin 的上游分子,PINK1 通过磷酸化Parkin,使后者转位至线粒体,并维持其连接酶活性,进一步促进IKKγ(inhibitior of kappa-B kinaseγ)的泛素化,激活核转录因子NF-κB,实现保护细胞的功能[14-15],这在维持线粒体形态和功能中发挥重要作用[16];PINK1 还能够间接磷酸化一种线粒体丝氨酸蛋白酶Omi/HtrA2,Omi/HtrA2 被激活后可以诱发细胞发生凋亡[17];mTORC2,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)两种多蛋白复合物的一种,可以被过量表达的PINK1 磷酸化,mTORC2 可以激活磷脂酰肌醇3- 激酶(PI3K)/ 蛋白激酶B(Akt)通路,发挥细胞保护作用[18]。

|
图 1 PINK1 的激酶活性 PINK1 通过磷酸化作用激活 多种蛋白,调节细胞功能。 |
3 PINK1 的线粒体调节功能 3.1 对线粒体功能的影响
体外实验发现PINK1 可以提升线粒体对线粒体毒性物质(如星孢菌素、鱼藤酮)的拮抗作用[19-20],以避免小鼠多巴胺能神经元受损[21]。应用RNA 干扰技术降低PINK1 的表达将加重星孢菌素或鱼藤酮对细胞的损伤[22]。类似于Parkin 基因敲除果蝇,PINK1 基因敲除果蝇表现为飞行肌肉的退化以及多巴胺能神经元的退化[23]。这些PINK1 基因敲除模型表现为线粒体膜电位、线粒体DNA、复合体Ⅰ、ATP 的下降以及肿胀线粒体的增加,并且多巴胺能神经元细胞表现为更加容易凋亡,以及突触功能的缺陷[23]。以上研究结果提示,PINK1 基因的敲除使得线粒体功能障碍从而导致多巴胺能神经元死亡。随着研究的深入,发现PINK1 的基因缺失将导致神经元细胞内钙离子浓度升高,活性氧簇(reactive oxygen species,ROS)产物增多,葡萄糖的利用率下降,线粒体膜电位的丢失以及ATP浓度的下降[24]。线粒体电子漏并没有随着PINK1基因的敲除而发生变化,而线粒体呼吸链的活性明显下降。这说明膜电位的下降可能是由呼吸链活性受损导致的[25-26]。
3.2 对线粒体形态的影响研究表明,PINK1 基因的敲除将导致哺乳动物细胞内线粒体碎片化[27-28]。利用慢病毒在人神经母细胞瘤细胞沉默PINK1 后,动力相关蛋白将去磷酸化,并影响线粒体形态的改变[29]。果蝇转基因实验研究发现PINK1 可能通过线粒体分裂蛋白促进线粒体分裂[30]。在压力刺激下PINK1 基因敲除小鼠皮层神经元线粒体分裂减少,融合增加[31]。在PINK1 基因敲除鼠的神经元中,可以观察到线粒体的长度减少及碎片增加[32]。线粒体的分裂及融合是线粒体维护的重要环节。而分裂与融合的不平衡与神经退行性病变密切相关[33]。
3.3 对线粒体自噬的影响PINK1 基因与线粒体自噬的发生密切相关(图 2)。研究发现Parkin 蛋白在线粒体的转位将引导线粒体被自噬清除(线粒体自噬)[34]。膜电位的降低可导致PINK1 的蓄积,去极化的线粒体PINK1含量增加[35]。Parkin 蛋白转位至线粒体依赖于PINK1,敲除PINK1 基因后,Parkin 蛋白无法转位至线粒体从而导致线粒体自噬受阻[35-36]。以上发现提示,PINK1 是Parkin 蛋白转位至去极化线粒体必不可少的因子,PINK1 的增加促进Parkin 蛋白转位至去极化线粒体,并使其被线粒体自噬清除。PINK1 及Parkin 基因的突变将使得PINK1/Parkin自噬通路受阻,从而使得功能障碍的线粒体清除障碍。Parkin 蛋白标记的线粒体自噬途径能被自噬相关基因Atg5、Atg7 敲除所阻断[36-37]。PINK1/Parkin 介导的线粒体自噬参与了多聚泛素链的形成以及泛素自噬配体p62/SQSTM1 的形成[37-38](一种多功能的泛素化结合的折叠蛋白,在自噬、蛋白酶体、NF-κB 等信号通路中起重要作用)。电压依赖阴离子通道1(voltage-dependent anion channel1,VDAC1)的泛素化依赖于功能性的Parkin 蛋白,而VDCA1 是线粒体膜通透性转运孔道(membrane permeability transport channel,mPTP)的组成部分。mPTP 可以阻止线粒体释放细胞色素C、Bax(抗凋亡蛋白BCL-2 家族中研究最广泛的一种促凋亡蛋白)和凋亡诱导因子等促进细胞凋亡的物质[39-40]。Parkin 被募集到线粒体上后能通过介导VDAC1 的泛素化参与线粒体的自噬,在这个过程中p62 也被募集到线粒体上,启动了线粒体自噬。也有研究显示,p62 只参与了Parkin 介导的线粒体聚集而与线粒体自噬没有关系。关于VDAC1 在线粒体自噬中的作用尚有争论。在果蝇的研究中,Parkin和PINK1 能介导和线粒体融合蛋白(mitofusin,MFN)的泛素化,而MFN 的泛素化也可能是线粒体自噬的信号,泛素化的MFN 被清除后,线粒体的融合功能丧失,随后通过自噬被降解,这可以防止受损的线粒体与功能正常的线粒体发生融合。在Parkin 或PINK1 缺失的情况下,MFN 的蛋白量增加,从而促进了线粒体的融合[41]。PINK1/Parkin可能介导了线粒体发生选择性分裂及融合,从而更好地清除受损线粒体,保留完好的线粒体[42]。但是这个理念尚存在争议,需要更加深入的研究。
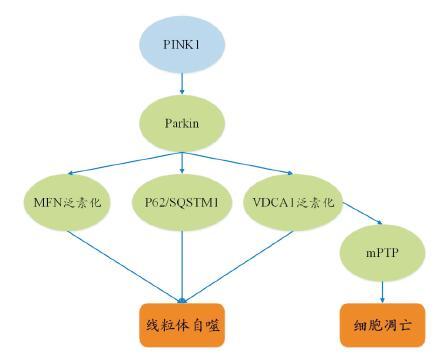
|
图 2 PINK1 对线粒体自噬的调节作用 PINK1 通过多条途径调节线粒体的自噬,从而影响线粒体功能,并间接调节细胞凋亡。 |
4 PINK1 与其他疾病的关系 4.1 PINK1 与肿瘤
PINK1 是PTEN 诱导的蛋白激酶,随着PTEN的表达增高而增高。而PTEN 是重要的抑癌基因,PINK1 在肿瘤中发挥的作用尚存在争议,一方面在小鼠具有转移能力的肿瘤细胞中发现PINK1 表达升高,另一方面PINK1 是受抑癌基因调控。大部分的研究支持PINK1 是肿瘤促进因素,而且在肿瘤药物抵抗中起关键作用[43-46]。也有观点认为PINK1 发挥抗肿瘤或者促进肿瘤的作用取决于细胞所处的环境[47]。PINK1 的这种特性可能是由于它促进线粒体自噬所导致的,因为线粒体自噬在不同环境及不同肿瘤的作用各不相同。同时PINK1还能通过PI3K/Akt 通路调控肿瘤细胞生长[48]。推测,PINK1 可能成为肿瘤干预靶点或者肿瘤预测指标,尤其是那些与自噬或者能量代谢相关的肿瘤。
4.2 PINK1 与新生儿缺氧缺血性脑病研究提示多种死亡机制参与了脑缺血后神经元损伤[49-50]。细胞坏死、细胞凋亡及细胞自噬性死亡是神经元细胞死亡的主要方式。本课题组的研究发现敲除PINK1 基因对新生小鼠正常脑组织中细胞凋亡及自噬均无影响,但可以明显抑制新生小鼠缺氧缺血性脑损伤中细胞凋亡及细胞自噬的发生,敲除PINK1 基因对10 日龄新生小鼠缺氧缺血性脑损伤可能具有神经元保护作用[51],但其具体机制尚需进一步研究。
4.3 PINK1 与2 型糖尿病PINK1 蛋白参与了糖代谢过程。PINK1 基因敲除后,胰岛β 细胞通过增加还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)活性增加了活性氧簇(ROS)的产生,进而使胰岛β 细胞对葡萄糖刺激的摄取反应降低,而使用NADPH 抑制剂二亚苯基碘和ROS 清除剂,细胞对葡萄糖的摄取反应有所改善,尽管未恢复至对照组胰岛β 细胞对葡萄糖刺激的正常反应水平[52]。在2 型糖尿病患者的骨骼肌细胞中,PINK1 的转录水平较正常人下降。这一系列的研究说明PINK1参与了糖代谢的调控,而且可能与2 型糖尿病有关,是2 型糖尿病的一个潜在研究靶点。
4.4 PINK1 与肺气肿最新研究发现,PINK1 基因的缺失对小鼠吸烟引起的慢性阻塞性肺疾病模型具有保护作用,这种作用与线粒体自噬抑制剂类似[53]。该研究还发现,自噬的激活将加重线粒体损伤及去极化,提示特定环境诱导的线粒体自噬对机体具有损伤作用。因此推测线粒体自噬可以加重吸烟诱导的线粒体损伤,进而发生细胞损伤。PINK1 基因敲除对线粒体自噬的抑制作用可能是减轻吸烟诱导的肺气肿的主要机制。
5 结语PINK1 功能较为复杂,本综述对其主要的作用方式和途径,以及其在多种疾病中的作用机制进行了小结。PINK1 在帕金森疾病中研究较多,但是由于其在组织中广泛表达,且是线粒体膜蛋白,参与了线粒体功能、形态、自噬等过程,提示PINK1 可能与其他疾病的发生、发展密切相关,特别是缺血性疾病、肿瘤、创伤愈合等与能量代谢、自噬相关的疾病。目前这方面的研究相对薄弱,尚需要进一步的深入研究。探讨PINK1 的生物学功能不仅可以为帕金森疾病的靶向性治疗带来可能,对其他疾病领域也会产生积极影响。
| [1] | Kawajiri S, Saiki S, Sato S, et al. Genetic mutations and functions of PINK1[J]. Trends Pharmacol Sci , 2011, 32 (10) : 573–580. DOI:10.1016/j.tips.2011.06.001 |
| [2] | Pickrell AM, Youle RJ. The roles of PINK1,parkin,and mitochondrial fidelity in Parkinson's disease[J]. Neuron , 2015, 85 (2) : 257–273. DOI:10.1016/j.neuron.2014.12.007 |
| [3] | Durcan TM, Fon EA. The three ‘P’s of mitophagy:PARKIN,PINK1,and post-translational modifications[J]. Genes Dev , 2015, 29 (10) : 989–999. DOI:10.1101/gad.262758.115 |
| [4] | Puschmann A. Monogenic Parkinson's disease and parkinsonism:clinical phenotypes and frequencies of known mutations[J]. Parkinsonism Relat Disord , 2013, 19 (4) : 407–415. DOI:10.1016/j.parkreldis.2013.01.020 |
| [5] | Zhou C, Huang Y, Shao Y, et al. The kinase domain of mitochondrial PINK1 faces the cytoplasm[J]. Proc Natl Acad Sci U S A , 2008, 105 (33) : 12022–12027. DOI:10.1073/pnas.0802814105 |
| [6] | Trempe JF, Fon EA. Structure and function of parkin,PINK1,and DJ-1,the three musketeers of neuroprotection[J]. Front Neurol , 2013, 4 : 38. |
| [7] | Sim CH, Gabriel K, Mills RD, et al. Analysis of the regulatory and catalytic domains of PTEN-induced kinase-1(PINK1)[J]. Hum Mutat , 2012, 33 (10) : 1408–1422. DOI:10.1002/humu.v33.10 |
| [8] | Wust R, Maurer B, Hauser K, et al. Mutation analyses and association studies to assess the role of the presenilin-associated rhomboid-like gene in Parkinson's disease[J]. Neurobiol Aging , 2016, 39 : 217. |
| [9] | Bandres-Ciga S, Mencacci NE, Duran R, et al. Analysis of the genetic variability in Parkinson's disease from Southern Spain[J]. Neurobiol Aging , 2016, 37 : 210. |
| [10] | Ye M, Zhou D, Zhou Y, et al. Parkinson's disease-associated PINK1 G309D mutation increases abnormal phosphorylation of Tau[J]. IUBMB Life , 2015, 67 (4) : 286–290. DOI:10.1002/iub.1367 |
| [11] | Rub C, Schroder N, Voos W. Biochemical properties of the kinase PINK1 as sensor protein for mitochondrial damage signalling[J]. Biochem Soc Trans , 2015, 43 (2) : 287–291. DOI:10.1042/BST20150005 |
| [12] | Roth JA. Correlation between the biochemical pathways altered by mutated parkinson-related genes and chronic exposure to manganese[J]. Neurotoxicology , 2014, 44 : 314–325. DOI:10.1016/j.neuro.2014.08.006 |
| [13] | Kim H, Yang J, Kim MJ, et al. Tumor necrosis factor receptor-associated protein 1(TRAP1) mutation and TRAP1 inhibitor gamitrinib-triphenylphosphonium (G-TPP) induce a forkhead box O (FOXO)-dependent cell protective signal from mitochondria[J]. J Biol Chem , 2016, 291 (4) : 1841–1853. DOI:10.1074/jbc.M115.656934 |
| [14] | Fiesel FC, Ando M, Hudec R, et al. (Patho-) physiological relevance of PINK1-dependent ubiquitin phosphorylation[J]. EMBO Rep , 2015, 16 (9) : 1114–1130. DOI:10.15252/embr.201540514 |
| [15] | Sauve V, Lilov A, Seirafi M, et al. A Ubl/ubiquitin switch in the activation of Parkin[J]. EMBO J , 2015, 34 (20) : 2492–2505. DOI:10.15252/embj.201592237 |
| [16] | Luz AL, Rooney JP, Kubik LL, et al. Mitochondrial morphology and fundamental parameters of the mitochondrial respiratory chain are altered in caenorhabditis elegans strains deficient in mitochondrial dynamics and homeostasis processes[J]. PLoS One , 2015, 10 (6) : e0130940. DOI:10.1371/journal.pone.0130940 |
| [17] | Yacobi-Sharon K, Namdar Y, Arama E. Alternative germ cell death pathway in Drosophila involves HtrA2/Omi,lysosomes,and a caspase-9 counterpart[J]. Dev Cell , 2013, 25 (1) : 29–42. DOI:10.1016/j.devcel.2013.02.002 |
| [18] | Murata H, Sakaguchi M, Jin Y, et al. A new cytosolic pathway from a Parkinson disease-associated kinase,BRPK/PINK1:activation of AKT via mTORC2[J]. J Biol Chem , 2011, 286 (9) : 7182–7189. DOI:10.1074/jbc.M110.179390 |
| [19] | Haque ME, Mount MP, Safarpour F, et al. Inactivation of Pink1 gene in vivo sensitizes dopamine-producing neurons to 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) and can be rescued by autosomal recessive Parkinson disease genes,Parkin or DJ-1[J]. J Biol Chem , 2012, 287 (27) : 23162–23170. DOI:10.1074/jbc.M112.346437 |
| [20] | Martella G, Madeo G, Maltese M, et al. Exposure to low-dose rotenone precipitates synaptic plasticity alterations in PINK1 heterozygous knockout mice[J]. Neurobiol Dis , 2016, 91 : 21–36. DOI:10.1016/j.nbd.2015.12.020 |
| [21] | Haque ME, Thomas KJ, D'Souza C, et al. Cytoplasmic Pink1 activity protects neurons from dopaminergic neurotoxin MPTP[J]. Proc Natl Acad Sci U S A , 2008, 105 (5) : 1716–1721. DOI:10.1073/pnas.0705363105 |
| [22] | Deng H, Jankovic J, Guo Y, et al. Small interfering RNA targeting the PINK1 induces apoptosis in dopaminergic cells SH-SY5Y[J]. Biochem Biophys Res Commun , 2005, 337 (4) : 1133–1138. DOI:10.1016/j.bbrc.2005.09.178 |
| [23] | Park J, Lee SB, Lee S, et al. Mitochondrial dysfunction in Drosophila PINK1 mutants is complemented by parkin[J]. Nature , 2006, 441 (7097) : 1157–1161. DOI:10.1038/nature04788 |
| [24] | Morais VA, Verstreken P, Roethig A, et al. Parkinson's disease mutations in PINK1 result in decreased Complex I activity and deficient synaptic function[J]. EMBO Mol Med , 2009, 1 (2) : 99–111. DOI:10.1002/emmm.200900006 |
| [25] | Amo T, Sato S, Saiki S, et al. Mitochondrial membrane potential decrease caused by loss of PINK1 is not due to proton leak,but to respiratory chain defects[J]. Neurobiol Dis , 2011, 41 (1) : 111–118. DOI:10.1016/j.nbd.2010.08.027 |
| [26] | Amo T, Saiki S, Sawayama T, et al. Detailed analysis of mitochondrial respiratory chain defects caused by loss of PINK1[J]. Neurosci Lett , 2014, 580 : 37–40. DOI:10.1016/j.neulet.2014.07.045 |
| [27] | Dai H, Deng Y, Zhang J, et al. PINK1/Parkin-mediated mitophagy alleviates chlorpyrifos-induced apoptosis in SH-SY5Y cells[J]. Toxicology , 2015, 334 : 72–80. DOI:10.1016/j.tox.2015.06.003 |
| [28] | Akundi RS, Zhi L, Sullivan PG, et al. Shared and cell type-specific mitochondrial defects and metabolic adaptations in primary cells from PINK1-deficient mice[J]. Neurodegener Dis , 2013, 12 (3) : 136–149. DOI:10.1159/000345689 |
| [29] | van der Merwe C, van Dyk HC, Engelbrecht L, et al. Curcumin rescues a PINK1 knock down SH-SY5Y cellular model of Parkinson's disease from mitochondrial dysfunction and cell death[J]. Mol Neurobiol , 2016 . |
| [30] | van der Merwe C, Jalali Sefid Dashti Z, Christoffels A, et al. Evidence for a common biological pathway linking three Parkinson's disease-causing genes:parkin,PINK1 and DJ-1[J]. Eur J Neurosci , 2015, 41 (9) : 1113–1125. DOI:10.1111/ejn.2015.41.issue-9 |
| [31] | Norris KL, Hao R, Chen LF, et al. Convergence of parkin,PINK1,and alpha-synuclein on stress-induced mitochondrial morphological remodeling[J]. J Biol Chem , 2015, 290 (22) : 13862–13874. DOI:10.1074/jbc.M114.634063 |
| [32] | Lutz AK, Exner N, Fett ME, et al. Loss of parkin or PINK1 function increases Drp1-dependent mitochondrial fragmentation[J]. J Biol Chem , 2009, 284 (34) : 22938–22951. DOI:10.1074/jbc.M109.035774 |
| [33] | Zhao Y, Chen F, Chen S, et al. The Parkinson's disease-associated gene PINK1 protects neurons from ischemic damage by decreasing mitochondrial translocation of the fission promoter Drp1[J]. J Neurochem , 2013, 127 (5) : 711–722. DOI:10.1111/jnc.2013.127.issue-5 |
| [34] | Okatsu K, Oka T, Iguchi M, et al. PINK1 autophosphorylation upon membrane potential dissipation is essential for Parkin recruitment to damaged mitochondria[J]. Nat Commun , 2012, 3 : 1016. DOI:10.1038/ncomms2016 |
| [35] | Lazarou M, Sliter DA, Kane LA, et al. The ubiquitin kinase PINK1 recruits autophagy receptors to induce mitophagy[J]. Nature , 2015, 524 (7565) : 309–314. DOI:10.1038/nature14893 |
| [36] | Nezich CL, Wang C, Fogel AI, et al. MiT/TFE transcription factors are activated during mitophagy downstream of Parkin and Atg5[J]. J Cell Biol , 2015, 210 (3) : 435–450. DOI:10.1083/jcb.201501002 |
| [37] | Vincow ES, Merrihew G, Thomas RE, et al. The PINK1-Parkin pathway promotes both mitophagy and selective respiratory chain turnover in vivo[J]. Proc Natl Acad Sci U S A , 2013, 110 (16) : 6400–6405. DOI:10.1073/pnas.1221132110 |
| [38] | Rakovic A, Shurkewitsch K, Seibler P, et al. Phosphatase and tensin homolog (PTEN)-induced putative kinase 1(PINK1)-dependent ubiquitination of endogenous Parkin attenuates mitophagy:study in human primary fibroblasts and induced pluripotent stem cell-derived neurons[J]. J Biol Chem , 2013, 288 (4) : 2223–2237. DOI:10.1074/jbc.M112.391680 |
| [39] | Okatsu K, Saisho K, Shimanuki M, et al. p62/SQSTM1 cooperates with Parkin for perinuclear clustering of depolarized mitochondria[J]. Genes Cells , 2010, 15 (8) : 887–900. |
| [40] | Narendra D, Kane LA, Hauser DN, et al. p62/SQSTM1 is required for Parkin-induced mitochondrial clustering but not mitophagy;VDAC1 is dispensable for both[J]. Autophagy , 2010, 6 (8) : 1090–1106. DOI:10.4161/auto.6.8.13426 |
| [41] | Gegg ME, Cooper JM, Chau KY, et al. Mitofusin 1 and mitofusin 2 are ubiquitinated in a PINK1/parkin-dependent manner upon induction of mitophagy[J]. Hum Mol Genet , 2010, 19 (24) : 4861–4870. DOI:10.1093/hmg/ddq419 |
| [42] | Zhang HT, Mi L, Wang T, et al. PINK1/Parkin-mediated mitophagy play a protective role in manganese induced apoptosis in SH-SY5Y cells[J]. Toxicol In Vitro , 2016, 34 : 212–219. DOI:10.1016/j.tiv.2016.04.006 |
| [43] | Garber K. Parkinson's disease and cancer:the unexplored connection[J]. J Natl Cancer Inst , 2010, 102 (6) : 371–374. DOI:10.1093/jnci/djq081 |
| [44] | Morris LG, Veeriah S, Chan TA. Genetic determinants at the interface of cancer and neurodegenerative disease[J]. Oncogene , 2010, 29 (24) : 3453–3464. DOI:10.1038/onc.2010.127 |
| [45] | Plun-Favreau H, Lewis PA, Hardy J, et al. Cancer and neurodegeneration:between the devil and the deep blue sea[J]. PLoS Genet , 2010, 6 (12) : el001257. |
| [46] | Tabares-Seisdedos R, Rubenstein JL. Inverse cancer comorbidity:a serendipitous opportunity to gain insight into CNS disorders[J]. Nat Rev Neurosci , 2013, 14 (4) : 293–304. DOI:10.1038/nrn3464 |
| [47] | Berthier A, Navarro S, Jimenez-Sainz J, et al. PINK1 displays tissue-specific subcellular location and regulates apoptosis and cell growth in breast cancer cells[J]. Hum Pathol , 2011, 42 (1) : 75–87. DOI:10.1016/j.humpath.2010.05.016 |
| [48] | O'Flanagan CH, Morais VA, Wurst W, et al. The Parkinson's gene PINK1 regulates cell cycle progression and promotes cancer-associated phenotypes[J]. Oncogene , 2015, 34 (11) : 1363–1374. DOI:10.1038/onc.2014.81 |
| [49] | Puyal J, Vaslin A, Mottier V, et al. Postischemic treatment of neonatal cerebral ischemia should target autophagy[J]. Ann Neurol , 2009, 66 (3) : 378–389. DOI:10.1002/ana.v66:3 |
| [50] | Wang JY, Xia Q, Chu KT, et al. Severe global cerebral ischemia-induced programmed necrosis of hippocampal CA1 neurons in rat is prevented by 3-methyladenine:a widely used inhibitor of autophagy[J]. J Neuropathol Exp Neurol , 2011, 70 (4) : 314–322. DOI:10.1097/NEN.0b013e31821352bd |
| [51] | 黄阳, 陈洪菊, 朱将虎, 等. PINK1基因对缺氧缺血性脑损伤新生小鼠细胞凋亡及自噬的影响[J]. 中国当代儿科杂志 , 2016, 18 (3) : 263–269. |
| [52] | Deas E, Piipari K, Machhada A, et al. PINK1 deficiency in beta-cells increases basal insulin secretion and improves glucose tolerance in mice[J]. Open Biol , 2014, 4 : 140051. DOI:10.1098/rsob.140051 |
| [53] | Mizumura K, Cloonan SM, Nakahira K, et al. Mitophagy-dependent necroptosis contributes to the pathogenesis of COPD[J]. J Clin Invest , 2014, 124 (9) : 3987–4003. DOI:10.1172/JCI74985 |
 2016, Vol. 18
2016, Vol. 18
