细菌耐药是全球面临的一个严峻问题,特别是在发展中国家,近年来有越来越多关于多重耐药菌感染的报道[1-2]。而抗生素过度使用与细菌耐药密切相关[3]。我国是抗生素过度使用尤其严重的国家之一[4]。我国抗生素临床应用监测网显示,2005~2010年住院患者抗生素使用强度为70~80累计限定日剂量(defined daily doses, DDDs),高于多数欧洲国家(20~30 DDDs)。因此,为加强抗生素临床应用管理、控制细菌耐药、保障医疗质量和医疗安全,卫生部进行了抗生素临床应用整治。重庆医科大学附属儿童医院于2012年8月正式实施《抗菌药物临床应用管理办法》。
新生儿是感染高发危险人群,新生儿感染性疾病的发病率和病死率占新生儿疾病首位[5-6]。据联合国2013千年发展目标报道,目前新生儿死亡人数为290万,占所有儿童死亡人数的44%,其中约1/3为感染性疾病所致[7]。早期合理抗感染治疗是改善新生儿预后的关键。然而,大多新生儿感染性疾病的症状和体征无特异性,而实验室检查需要一定的时间,使早期、准确的诊断成为难题[8],因此,为了早期控制新生儿感染、防止严重并发症发生,临床医生往往在感染尚不明确的情况下即使用抗生素[9]。既往有报道认为,严格控制抗生素的临床应用,可能使感染性疾病病情加重或增加院内感染的发生率[10-11],而近年来的研究表明,不合理地预防性应用抗生素可引起菌群失调及耐药菌株产生,增加院内感染的机会[12]。严格控制抗生素的临床应用,是否会影响新生儿感染性疾病的病情转归及院内感染发生率,目前研究极少。本研究选取抗生素临床应用控制前后(2010年vs 2013年)我院新生儿败血症、化脓性脑膜炎、急性血源性骨髓炎等血源性感染病例进行回顾性研究,以评价抗生素临床应用控制对新生儿感染性疾病病原学及临床特点的影响。
1 资料与方法 1.1 研究对象本研究以2010年和2013年重庆医科大学附属儿童医院新生儿病房的住院患儿为总体研究对象,其中2010年总收治病人6 045例、2013年7 265例,将其中确诊为新生儿败血症、化脓性脑膜炎、急性血源性骨髓炎(统称“血源性感染”)的病例纳入研究:2010年168例、2013年470例,对其病原菌及耐药情况、抗生素使用情况、出院转归、院内感染等进行深入分析。新生儿败血症、化脓性脑膜炎、急性血源性骨髓炎诊断符合《实用新生儿学》、《小儿外科学》相应疾病标准[5, 13]。
1.2 抗生素使用强度抗生素使用强度=(抗生素累计DDD/同期收治患者人天数)×100
注:同期收治患者人天数=同期出院患者人数×同期患者平均住院天数。
1.3 统计学分析采用SPSS 17.0 统计软件进行分析处理。计数资料用百分率表示,非正态分布计量资料用中位数(四分位间距)[M(P25, P75)]表示。计数资料的比较采用χ2检验,非正态分布计量资料的比较采用秩和检验。P<0.05 为差异有统计学意义。
2 结果 2.1 2010年与2013年患者总体情况比较2010年总收治新生儿6 045例、2013年7 265例。2013年的早产儿和极低出生体重儿收治率(24.01%,2.84%)均显著高于2010年(22.10%,2.13%),差异有统计学意义(P<0.05);经外周静脉穿刺中心静脉置管术(peripherally inserted central catheter, PICC)应用率(2.51%)高于2010年(0.79%),差异有统计学意义(P<0.01)。2013年合并肺炎者429例(91.28%),2010年147例(87.5%),差异无统计学意义(P>0.05)。2013年的血源性感染收治率、血源性院内感染发生率(6.47%,0.70%)均高于2010年(2.78%,0.30%),差异有统计学意义(P<0.01)。2013年的抗生素使用率(79.25%)低于2010年(91.83%)(P<0.01),抗生素使用强度(8.37 DDDs)亦低于2010年(10.65 DDDs)。发生血源性院内感染的患者中,2013年预防性抗生素使用率为78%,低于2010年(100%),差异有统计学意义(P<0.05)。
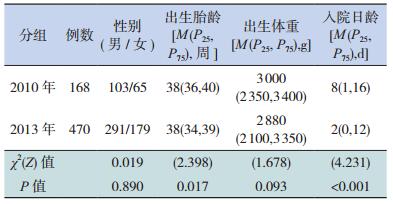
2.2 2010年与2013年的血源性感染情况比较血源性感染2010年168例、2013年470例,其中2013年的出生胎龄[38(34,39)周]小于2010年[38(36,40)周](P<0.05);2013年的入院日龄 [2(0,12)d]小于2010年[8(1,16)d](P<0.01);两组性别、出生体重的差异均无统计学意义(P>0.05)。见表 1。
| 表 1 2010年与2013年血源性感染病例的基本情况比较 |
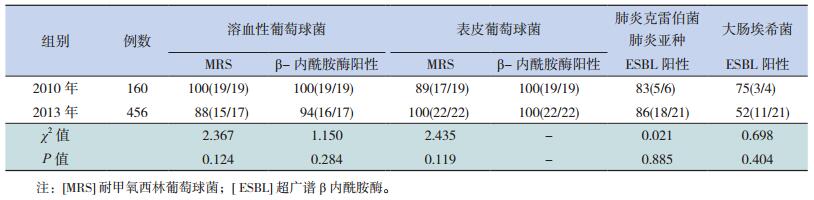
血源性感染病例中,2010年的新生儿败血症160例(95.2%),其中血培养阳性者77例(48.1%);2013年的新生儿败血症456例(97.0%),其中血培养阳性者144例(31.6%)。2013年革兰阳性菌感染率(52.1%)低于2010年(75.3%),革兰阴性菌感染率(41.0%)高于2010年(24.7%),真菌感染率(6.9%)高于2010年(0.0%),差异均有统计学意义(P<0.05)。
2010年、2013年血培养检出率前4位的病原菌均为溶血性葡萄球菌、表皮葡萄球菌、肺炎克雷伯菌肺炎亚种、大肠埃希菌。2013年的溶血性葡萄球菌和表皮葡萄球菌感染率(3.7%、5.0%)较2010年(14.4%、13.1%)降低(P<0.01);肺炎克雷伯菌肺炎亚种和大肠埃希菌感染率(5.3%、4.6%)与2010年(5.0%、2.5%)比较,差异均无统计学意义(P>0.05)。
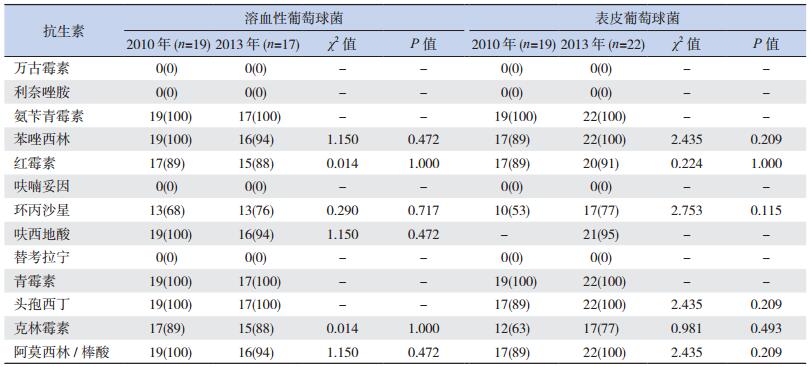
2013年与2010年耐甲氧西林葡萄球菌(methicillin resistant Staphylococcus, MRS)或β-内酰胺酶阳性的溶血性葡萄球菌、表皮葡萄球菌的检出率差异无统计学意义(P>0.05);对万古霉素、利奈唑胺、呋喃妥因、替考拉宁均无耐药;对氨苄青霉素、苯唑西林、青霉素、头孢西丁、阿莫西林棒酸、红霉素、克林霉素耐药率均>75%,差异也无统计学意义(P>0.05)。见表 2~3。
| 表 2 2010 年与2013年新生儿败血症血培养检出率前4位病原菌的耐药情况比较[%(n/N)] |
| 表 3 2010年与2013年溶血性葡萄球菌和表皮葡萄球菌耐药情况比较[例(%)] |
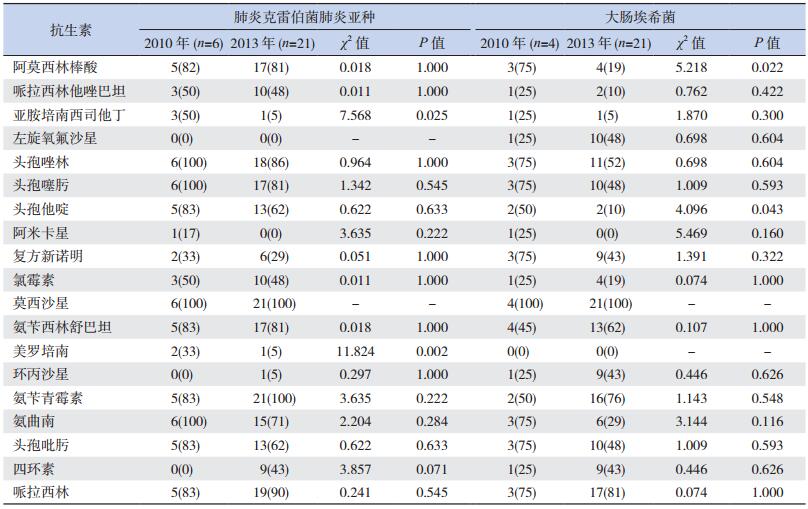
2013年与2010年超广谱β内酰胺酶(extended-spectrum beta-lactamase, ESBL)阳性的肺炎克雷伯菌肺炎亚种或大肠埃希菌检出率差异无统计学意义(P>0.05)。2013年与2010年肺炎克雷伯菌肺炎亚种对阿莫西林棒酸、氨苄西林舒巴坦、氨苄青霉素、头孢唑林、头孢噻肟、莫西沙星的耐药率均>75%,对头孢他啶、头孢吡肟的耐药率均>50%,两组比较差异均无统计学意义(P>0.05);对亚胺培南西司他丁、美罗培南的耐药率,2013年均较2010年显著下降,差异有统计学意义(P<0.05)。2013年与2010年大肠埃希菌对亚胺培南西司他丁、美罗培南、哌拉西林他唑巴坦耐药率均<30%,对头孢唑林、头孢噻肟、头孢吡肟耐药率均>40%,两组比较差异均无统计学意义(P>0.05);对阿莫西林棒酸、头孢他啶的耐药率,2013年较2010年显著降低,差异有统计学意义(P<0.05)。见表 2、表 4。
| 表 4 2010年与2013年肺炎克雷伯菌肺炎亚种和大肠埃希菌耐药情况比较[例(%)] |
2013年470例血源性感染病例中诊断为化脓性脑膜炎的55例(11.7%),其中脑脊液培养阳性者7例(13%),大肠埃希菌4例(7%),脑膜炎败血性黄杆菌2例(4%),单核细胞增生李斯特菌1例(2%)。2010年168例血源性感染病例中诊断为化脓性脑膜炎的11例(6.5%),其中脑脊液培养阳性者只有1例(9%),为革兰氏阳性杆菌,具体菌种不详;两组脑脊液培养阳性率比较差异无统计学意义(P>0.05)。2013年与2010年诊断为急性血源性骨髓炎的各1例,骨髓培养均阴性,其血培养均为金黄色葡萄球菌。
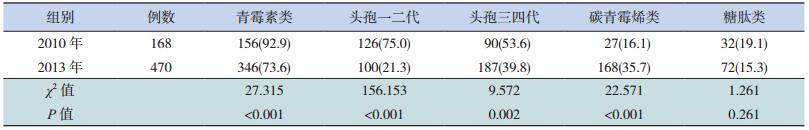
2013年的青霉素类、头孢菌素类第一二代及头孢菌素类第三四代的使用率(73.6%、21.3%、39.8%)均低于2010年(92.9%、75.0%、53.6%),差异有统计学意义(P<0.01);碳青霉烯类使用率(35.7%)高于2010年(16.1%),差异有统计学意义(P<0.01);两组糖肽类抗生素使用率(15.3% vs 19.1%)比较,差异无统计学意义(P=0.261)。见表 5。
| 表 5 2010年与2013年血源性感染病例的抗生素使用情况比较[例(%)] |
2013年碳青霉烯类和/或糖肽类等特殊级抗生素的使用率(51.7%)较2010年(34.5%)高。2013年特殊级抗生素使用率前3位的依次为帕尼培南倍他米隆(77.8%)、亚胺培南西司他丁(31.7%)、替考拉宁(30.9%),而2010年为万古霉素(53.5%)、帕尼培南倍他米隆(39.7%)、亚胺培南西司他丁(15.5%)。
2013年抗生素以单用为主,单用率(59.9%)高于2010年(8.3%),差异有统计学意义(P<0.01);2010年抗生素以二联为主,二联使用率高于2013年(85.7% vs 38.4%),差异有统计学意义(P<0.01);2013年与2010年的三联、四联抗生素使用率比较,差异均无统计学意义(P>0.05)。2013年的抗生素更换次数 [1(1,0) 次]少于2010年[1(2,0)次],差异有统计学意义(P<0.01),抗生素使用时间[13(7,20)d]长于2010年[11(5,16)d],差异有统计学意义(P<0.01)。
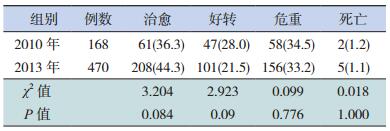
2.3 2010年和2013年血源性感染病例的出院转归情况2013年血源性感染病例的平均住院日 [12(6,19)d]高于2010年[10(4,15)d],差异有统计学意义(P<0.01);但两组间的治愈、好转、危重、死亡4种出院转归情况比较,差异均无统计学意义(P>0.05),其中好转、危重均为家属要求出院(未治愈)。见表 6。
| 表 6 2010年与2013年血源性感染病例出院转归比较[例(%)] |
3 讨论
为加强医疗机构抗生素临床应用管理,控制细菌耐药,卫生部开展了一系列抗生素临床应用整治活动。本研究旨在探讨抗生素临床应用控制对新生儿血源性感染病原学及临床特点的影响,发现抗生素临床应用控制执行过程中的问题及其利弊,为进一步地规范抗生素用药提供依据。
我院新生儿科2013年抗生素使用率及DDDs均较2010年降低。同时,血源性感染病例的抗生素更换次数、联用情况也有显著下降,提示2013年抗生素临床应用控制得到有效实施。
本研究2013年血源性院内感染发生率高于2010年,可能与2013年早产儿、极低出生体重儿收治率及PICC应用率高于2010年有关,这3者均为新生儿院内感染的高危因素[14-16];并且2013年、2010年的抗生素应用率均较高,院内感染的发生也可能与抗生素过多应用导致患儿体内菌群失调有关[12]。2013年血源性感染患者的出院转归与2010年比较并无显著差异,说明虽然2013年高危患者增多,但加强抗生素管理是有利于感染恢复的。2013年革兰阴性菌感染率较2010年增加,而革兰阳性菌感染率降低,考虑与纳入病例绝大部分合并肺炎、侵入性操作增加、手卫生更加规范等因素有关。据我院新生儿病房统计,自2011年推行手卫生以来,医务人员手卫生依从率从53.49%升至83.33%。
本研究2013年与2010年血培养检出率前4位的病原菌均为溶血葡萄球菌、表皮葡萄球菌、肺炎克雷伯菌肺炎亚种、大肠埃希菌,这与同类报道相仿[17-19],且与我院2012年统计的病原菌分布一致:肺炎克雷伯菌肺炎亚种和大肠埃希菌感染率居前列。
抗生素临床应用控制后,2013年的新生儿血源性感染常见病原菌及其耐药情况与2010年比,差异无统计学意义;且2013年肺炎克雷伯菌肺炎亚种对亚胺培南西司他丁和美罗培南、大肠埃希菌对阿莫西林棒酸和头孢他啶的耐药情况有所好转,提示细菌耐药的遏制初见成效。然而,细菌耐药是由基因突变或从其它微生物获得耐药基因而形成,经历了较长的过程[20-21]。因此,进一步延长研究时间,可更好地了解细菌耐药的变迁。
总体来讲,自抗菌药物临床应用控制实施以来,新生儿血源性感染的病原菌种类及其耐药情况无显著变化。严格控制抗生素的临床应用可以促进血源性感染患者的病情恢复,且可能成为防治血源性院内感染的重要措施。
| [1] | Okeke IN, Laxminarayan R, Bhutta ZA, et al. Antimicrobial resistance in developing countries. Part I:recent trends and current status[J]. Lancet Infect Dis , 2005, 5 (8) : 481–493. DOI:10.1016/S1473-3099(05)70189-4 |
| [2] | Belkina T, Al Warafi A, Hussein Eltom E, et al. Antibiotic use and knowledge in the community of Yemen, Saudi Arabia, and Uzbekistan[J]. J Infect Dev Ctries , 2014, 8 (4) : 424–429. |
| [3] | Franco BE, Altagracia Martínez M, Sánchez Rodríguez MA, et al. The determinants of the antibiotic resistance process[J]. Infect Drug Resist , 2009, 2 : 1–11. |
| [4] | Li Y. China's misuse of antibiotics should be curbed[J]. BMJ , 2014, 348 : g1083. DOI:10.1136/bmj.g1083 |
| [5] | 余加林, 吴仕孝. 细菌感染[M]//邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学. 第4版. 北京:人民卫生出社, 2011:307-351. |
| [6] | Liu L, Johnson HL, Cousens S, et al. Global, regional, and national causes of child mortality:an updated systematic analysis for 2010 with time trends since 2000[J]. Lancet , 2012, 379 (9832) : 2151–2161. DOI:10.1016/S0140-6736(12)60560-1 |
| [7] | UNDP. The millennium development goals report 2013[DB/OL]. (2014-06-05). http://www.undp.org/content/undp/en/home/librarypage/mdg/the-millennium-development-goalsreport-2013.html. |
| [8] | Radulova P. Neonatal infections. Diagnostic markers of infection[J]. Akush Ginekol (Sofiia) , 2010, 49 (5) : 42–51. |
| [9] | Yang YN, Tseng HI, Yang SN, et al. A strategy for reduction of antibiotic use in new patients admitted to a neonatal intensive care unit[J]. Pediatr Neonatol , 2012, 53 (4) : 245–251. DOI:10.1016/j.pedneo.2012.06.009 |
| [10] | Yurdakök M. Antibiotic use in neonatal sepsis[J]. Turk J Pediatr , 1998, 40 (1) : 17–33. |
| [11] | Fanos V, Dall'Agnola A. Antibiotics in neonatal infections:a review[J]. Drugs , 1999, 58 (3) : 405–427. DOI:10.2165/00003495-199958030-00003 |
| [12] | Lopes JM, Goulart EM, Siqueira AL, et al. Nosocomial infections in Brazilian pediatric patients:using a decision tree to identify high mortality groups[J]. Braz J Infect Dis , 2009, 13 (2) : 111–117. |
| [13] | 楼跃. 骨与关节化脓性感染[M]//施诚仁, 金先庆, 李仲智. 小儿外科学[M]. 第4版. 北京:人民卫生出版社, 2009:434-436. |
| [14] | Leistner R, Piening B, Gastmeier P, et al. Nosocomial infections in very low birthweight infants in Germany:current data from the National Surveillance System NEO-KISS[J]. Klin Padiatr , 2013, 225 (2) : 75–80. DOI:10.1055/s-00000034 |
| [15] | Babazono A, Kitajima H, Nishimaki S, et al. Risk factors for nosocomial infection in the neonatal intensive care unit by the Japanese Nosocomial Infection Surveillance (JANIS)[J]. Acta Med Okayama , 2008, 62 (4) : 261–268. |
| [16] | van der Zwet WC, Kaiser AM, van Elburg RM, et al. Nosocomial infections in a Dutch neonatal intensive care unit:surveillance study with definitions for infection specifically adapted for neonates[J]. J Hosp Infect , 2005, 61 (4) : 300–311. DOI:10.1016/j.jhin.2005.03.014 |
| [17] | Fahmey SS. Early-onset sepsis in a neonatal intensive care unit in Beni Suef, Egypt:bacterial isolates and antibiotic resistance pattern[J]. Korean J Pediatr , 2013, 56 (8) : 332–337. DOI:10.3345/kjp.2013.56.8.332 |
| [18] | Morkel G, Bekker A, Marais BJ, et al. Bloodstream infections and antimicrobial resistance patterns in a South African neonatal intensive care unit[J]. Paediatr Int Child Health , 2014, 34 (2) : 108–114. DOI:10.1179/2046905513Y.0000000082 |
| [19] | 陈默蕊, 杨立业, 杨惠, 等. 2012年广东省潮州市中心医院细菌耐药性检测[J]. 中国感染与化疗杂志 , 2014, 14 (1) : 22–28. |
| [20] | Tenover FC. Mechanisms of antimicrobial resistance in bacteria[J]. Am J Infect Control , 2006, 34 (5) : S3–S10. DOI:10.1016/j.ajic.2006.05.219 |
| [21] | Guilhelmelli F, Vilela N, Albuquerque P, et al. Antibiotic development challenges:the various mechanisms of action of antimicrobial peptides and of bacterial resistance[J]. Front Microbiol , 2013, 4 : 353. |
 2016, Vol. 18
2016, Vol. 18