新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome, NRDS)是由于肺表面活性物质(pulmonary surfactant, PS)缺乏或不成熟所致,多见于早产儿,是一种多因素参与的疾病[1-2]。遗传因素对NRDS的发生有重要的作用[3]。研究表明NRDS中存在多种基因变异[4],其中肺表面活性蛋白B(surfactant protein B, SP-B)的减少、缺失和基因结构变异与NRDS有关,SP-B基因变异多位于其前9个外显子区域,其中以外显子2、4和7最为多见。目前国内外研究多集中在外显子2和4上,对外显子7的研究相对较少。仅少数国外学者研究发现外显子7位点基因多态性与NRDS发病有关,例如Ballard等[5]发现在第7外显子上存在点突变可使SP-B含量减少,导致NRDS发生。而目前国内尚无相关报道。本研究利用临床病例和基础研究相结合的思路寻找内蒙古地区SP-B基因第7外显子区域有无基因突变,以及SP-B外显子7(R236C)位点基因多态性的比较,以期探寻我区NRDS发病的分子遗传学机制和防治的新策略。
1 资料与方法 1.1 研究对象选取2013年7月至2015年10月在内蒙古医科大学附属医院新生儿病房住院治疗的汉族NRDS患儿(祖上三代都居住在内蒙古西部地区的汉族)47例为病例组,NRDS诊断符合欧洲颁布的NRDS诊断标准[1]。另选取同期住院的汉族非NRDS患儿47例为对照组,胸片提示无明确肺部感染和NRDS表现,血常规和超敏C反应蛋白检查回报无明确感染者。本研究获得医院伦理委员会批准及家属知情同意。
1.2 诊断及排除标准诊断标准 NRDS的诊断标准[1]:生后当时或很快发病,并在生后2 d内进行性恶化,生后早期出现呼吸窘迫如紫绀、呻吟、吸凹和呼吸急促,随后发展为呼吸衰竭,吸入空气时PaO2<50 mm Hg,有中心性发绀或需要吸氧才能维持PaO2>50 mm Hg,肺部X线典型表现为毛玻璃样改变和支气管充气征等特异性表现。
排除标准:(1)严重先天性疾病,如复杂型先天性心脏病、膈疝和脑发育不良等;(2)遗传代谢性疾病,如苯丙酮尿症、先天性甲状腺功能低下和糖尿病等;(3)母亲孕后期明确感染史; (4)多胎;(5)出生时及生后窒息。
1.3 研究方法 1.3.1 样本采集及处理生后24 h内分别抽取两组患儿静脉血各1 mL,放于EDTAK2管中抗凝,在-80℃的低温冰箱中保存备用。
1.3.2 样本基因组DNA提取及其浓度测定严格按照TIANamp Blood DNA Kit血液基因组DNA提取试剂盒(离心柱型-目录号:DP318)进行基因组DNA提取。使用Thermo(NANODROP 2000)仪器检测所提取DNA的浓度。
1.3.3 SP-B基因PCR扩增由北京安美生医药科技有限公司合成SP-B基因的上下游引物,上游的引物是:5'-GAGGCAGAGCCGGGAAGGTG-3',下游的引物是:5'-CACCTCCATACAGTGGGGGCT-TAATG-3'。从样本所提取出的DNA总量中取出部分作为待扩增的基因。严格按照TAKARA PCR Amplification Kit(Code No.:DR011)使用说明进行PCR实验。
1.3.4 DNA目的片段的序列测定及分析取待测序样本干冰保存寄送至北京安美生医药科技有限公司进行序列测定,寻找SP-B基因是否存在突变及SP-B基因外显子7(R236C)位点基因多态性。
1.4 统计学方法应用SPSS13.0软件作统计分析。计量资料数据以均数±标准差(x±s)表示,组间比较用t检验,基因突变频率用直接计数法,组间比较采用χ2检验。P<0.05为差异有统计学意义。
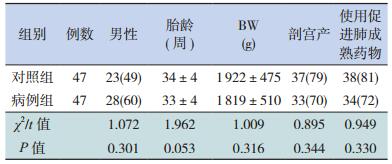
2 结果 2.1 两组患儿一般情况比较病例组47例患儿中,男28例,女19例,剖宫产33例(70%),经产道娩出14例(30%);胎龄29周~40周(29~33+6周30例,34~36+6周10例,37~40周7例),其中在34周~40周NRDS患儿中选择性剖宫产9例、母亲糖尿病5例、妊娠期高血压3例。出生体重1 050 g~3 150 g(<1 500 g 21例,1 500 g~17例,2 500 g~4 000 g 9例),使用促肺成熟药物34例(72%)。对照组47例患儿中,男23例,女24例,剖宫产37例(79%),经产道娩出10例(21%),胎龄29周~ 40周(29~33+6周30例,34~36+6周10例,37~40周7例),其中在34~40周非NRDS中,选择性剖宫产9例、母亲糖尿病5例、妊娠期高血压3例,出生体重1 115 g~3 100 g(<1 500 g 23例,1 500 g~16例,2 500 g~4 000 g 8例),使用促肺成熟药物38例(81%);病例组与对照组患儿在胎龄、性别、出生方式、出生体重以及是否合理使用皮质激素促肺成熟等方面比较,差异均无统计学意义(P>0.05)。见表 1。
| 表 1 两组患儿一般情况的对比[(x±s)或n(%)] |
2.2 NRDS患儿SP-B基因序列突变分析
实验通过基因测序法对SP-B外显子7进行基因测序,未发现基因突变现象。见图 1。
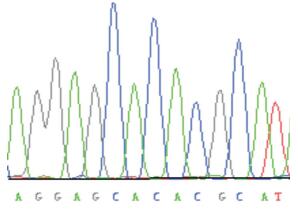
|
图 1 SP-B基因外显子7 |
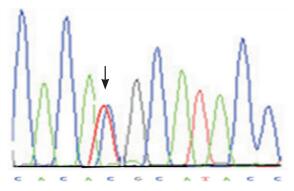
SP-B基因外显子7(R236C)位点基因多态性碱基序列图。见图 2、3。
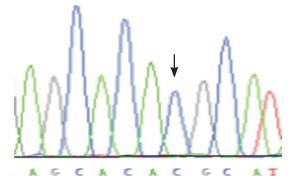
|
图 2 SP-B 基因外显子7(R236C)位点CC基因型 |
|
图 3 SP-B 基因外显子7(R236C)位点CT基因型 |
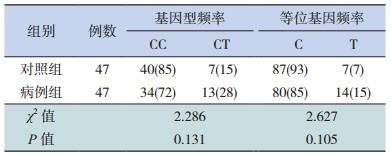
2.3 两组患儿SP-B基因外显子7(R236C)位点基因多态性比较
两组患儿SP-B基因外显子7(R236C)位点基因型均可检出两种基因型:即CC、CT型。两组中均未检出TT型。其中,病例组此两种基因型频率分别为:72%、28%,C等位基因频率为85%,T等位基因频率为15%。对照组此两种基因型分别为85%、15%,C等位基因频率为93%,T等位基因频率为7%。SP-B基因外显子7(R236C)位点等位基因及基因型的比较两组之间无统计学差异(P<0.05)。见表 2。
| 表 2 SP-B外显子7(R236C)等位基因及基因型在两组的分布比较[例(%)] |
3 讨论
NRDS作为一种与多种因素相关的疾病,其近几年的研究逐渐集中在肺表面活性蛋白基因突变及多态性的方向[6]。目前许多学者研究已证明SP-B基因缺陷与NRDS发病密切相关[7]。而SP-B基因的缺陷多由SP-B基因突变引起[8]。迄今为止,已发现多个位点的突变可引起部分或全部SP-B表达缺失。Nogee等[9]发现15个SP-B基因突变位点与NRDS相关联,这些突变位点主要分布在肺表面活性蛋白B基因的前9个外显子区域,以外显子2、4、7分布最为显著,而在不同种族、研究群体及疾病种类中,SP-B基因的种类和分布频率不尽相同[10]。张费通等[11]对我国南方汉族人极低出生体重儿的SP-B基因进行研究,发现RDS患儿SP-B基因的外显子2和外显子5相应位点变异率明显高于对照组。除SP-B基因突变可导致SP-B含量异常外,SP-B基因单核苷酸多态性也对SP-B的含量有重要影响[12]。基因多态性较基因突变范围更广泛,基因多态性为探索NRDS的发生、发展开辟了一个全新的领域[13]。Ballard等[5]发现在第7外显子上存在点突变,这种突变降低了SP-B的翻译效率和(或)改变了初始翻译产物的加工,从而使SP-B含量减少。Wegner等[14]学者研究发现NRDS导致的呼吸衰竭可能与SP-B外显子7缺失有关。
目前我国对SP-B外显子7基因突变的相关研究较少。本研究选取内蒙古西部地区汉族NRDS患儿为研究对象,寻找SP-B基因外显子7区域是否存在基因突变,结果显示:SP-B外显子7(R236C)位点基因型均可检出两种基因类型(CC和CT)。病例组与对照组相比此位点基因多态性等位基因及基因型频率的差异无统计学意义,提示SP-B外显子7(R236C)位点多态性可能未参与内蒙古西部地区汉族NRDS的发生,这可能与样本量少、位点选择、民族差异、地理环境等因素相关;本研究虽然对研究样本的胎龄、性别、体重、出生方式及是否促肺进行了匹配,但是仍不能排除其他潜在的混杂因素可能导致的结果偏倚,需对结论进一步探讨。
同时,本研究发现,无论是病例组还是对照组均未发现纯合子TT基因型,考虑该事件的发生可能是由于纯合子TT基因型胎儿出生后由于SP-B分泌明显减少,致使肺功能明显异常,易发生严重肺部疾病,存活率低。国外Nogee等[9]研究发现,1例外显子7(R236C)位点纯合子变异的TT基因型患儿因合并严重呼吸系统疾病,在生后9个月左右死亡。余未见相关报道,故有待进一步证实。
综上,本研究发现SP-B外显子7(R236C)位点多态性可能未参与内蒙古西部地区汉族NRDS的发生。可进一步扩大样本量、选择不同民族之间对比、不同地域以及不同基因位点等对NRDS与SP-B基因相关性进行研究。
| [1] | Sweet DG, Carnielli V, Greisen G, et al. European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants-2010 update[J]. Neonatology , 2010, 97 (4) : 402–417. DOI:10.1159/000297773 |
| [2] | Albert RK. The role of ventilation-induced surfactant dysfunction and atelectasis in causing acute respiratory distress syndrome[J]. Am J Respir Crit Care Med , 2012, 185 (7) : 702–708. DOI:10.1164/rccm.201109-1667PP |
| [3] | Hamvas A, Heins HB, Guttentag SH, et al. Developmental and genetic regulation of human surfactant protein B in vivo[J]. Neonatology , 2009, 95 (2) : 117–124. DOI:10.1159/000153095 |
| [4] | Glasser JR, Mallampalli RK. Surfactant and its role in the pathobiology of pulmonary infection[J]. Microbes Infect , 2012, 14 (1) : 17–25. DOI:10.1016/j.micinf.2011.08.019 |
| [5] | Ballard PL, Nogee LM, Beers MF, et al. Partial deficiency of surfactant protein B in an infant with chronic lung disease[J]. Pediatrics , 1995, 96 (6) : 1046–1052. |
| [6] | Akella A, Deshpande SB. Pulmonary surfactants and their role in pathophysiology of lung disorders[J]. Indian J Exp Biol , 2013, 51 (1) : 5–22. |
| [7] | Mailaparambil B, Krueger M, Heizmann U, et al. Genetic and epidemiological risk factors in the development of bronchopulmonary dysplasia[J]. Dis Markers , 2010, 29 (1) : 1–9. DOI:10.1155/2010/925940 |
| [8] | Wilder MA. Surfactant protein B deficiency in infants with respiratory failure[J]. J Perinat Neonatal Nurs , 2004, 18 (1) : 61–67. DOI:10.1097/00005237-200401000-00006 |
| [9] | Nogee LM. Alterations in SP-B and SP-C expression in neonatal lung disease[J]. Annu Rev Physiol , 2004, 66 : 601–623. DOI:10.1146/annurev.physiol.66.032102.134711 |
| [10] | Clark H, Clark LS. The genetics of neonatal respiratory disease[J]. Semin Fetal Neonatal Med , 2005, l0 (3) : 271–282. |
| [11] | 张费通, 崔其亮. 极低出生体质量早产儿80例肺泡表面活性物质蛋白B外显子测序分析[J]. 中华实用儿科临床杂志 , 2016, 31 (2) : 97–100. |
| [12] | Boggaram V. Regulation of lung surfactant protein gene expression[J]. Front Biosci , 2003, 8 : d751–d764. DOI:10.2741/1062 |
| [13] | Dahmer MK, O'cain P, Patwari PP, et al. The influence of genetic variation in surfactant protein B on severe lung injury in African American children[J]. Crit Care Med , 2011, 39 (5) : 1138–1144. DOI:10.1097/CCM.0b013e31820a9416 |
| [14] | Wegner DJ, Hertzberg T, Heins HB, et al. A major deletion in the surfactant protein-B gene causing lethal respiratory distress[J]. Acta Paediatr , 2007, 96 (4) : 516–520. DOI:10.1111/j.1651-2227.2006.00188.x |
 2016, Vol. 18
2016, Vol. 18