肺炎是儿童常见病,其中7%~13%属于重症肺炎[1]。发展中国家5岁以下儿童的重症肺炎占儿童危重症疾病的首位,发病率为10%~15%,病死率高达21%[2]。重症肺炎起病急,进展快,病死率高,心力衰竭是其最常见的并发症之一。国内的一些研究使用传统的超声心动图检查发现重症肺炎患儿存在左心室及右心室功能损害[3-4]。因此,临床上对重症肺炎患儿进行心功能监护以评估其心血管功能并给予血流动力学支持,是判断治疗效果及预后的关键。以多普勒超声技术为基础发展而来的便携式超声心输出量监护仪(ultrasonic cardiac output monitor, USCOM)是一种新型无创的心功能监护仪,可以在床旁快速监测患儿心功能变化,具有简便、快速、连续监测的优点[5]。由于传统的超声心动图检查不能对患儿心功能进行快速连续监测,在临床上对重症肺炎患儿心功能的动态变化不能更好的了解。而使用USCOM可以弥补这一不足[6]。2014年国内研究发现,应用USCOM可以准确、实时的了解肺炎合并心力衰竭患儿心功能状态[7]。但对于重症肺炎患儿在出现心力衰竭之前如何快速动态的了解患儿心功能的变化,以便及时采取措施防止心力衰竭的发生,目前国内尚无使用USCOM来监测这类患儿心功能变化的研究。因此本研究拟利用USCOM床旁实时连续监重症肺炎患儿心功能,动态了解患儿的心脏泵功能及整体循环状态,旨在早期发现重症肺炎患儿心功能改变并及时应用改善心功能的治疗措施,为临床提供依据。
1 资料与方法 1.1 研究对象选取2015年1月至8月我院儿科监护室收治的29例重症肺炎患儿为观察组,男19例,女10例,年龄1~11月,平均(6.5±1.3)月;另选取同期诊断为轻症肺炎的患儿43例为对照组,男24例,女19例,年龄1~10月,平均(6.1±1.7)月。轻症、重症肺炎定义依据我国第8版《儿科学》中的诊断标准[8],轻症肺炎:除呼吸系统外,其他系统仅轻微受累,无全身中毒症状。重症肺炎:除呼吸系统出现呼吸衰竭外其他系统亦可严重受累,可有酸碱平衡失调,水、电解质紊乱,全身中毒症状明显,甚至危及生命。
1.2 研究方法用USCOM(Pty Ltd, Coifs Har-bour, NSW, Australia)分别测定两组患儿治疗前后心功能(左心室)相关指标:包括每搏心输出量(systolic volume, SV)、心输出量(cardiac output, CO)、主动脉峰流速(aortic peak velocity, Vpk)、心率(heart rate, HR)、外周血管阻力(systemic vascular resistance, SVR)、心指数(cardiac index, CI)。探头频率2.2 MHz。对照组治疗措施包括一般治疗、抗感染治疗及对症治疗;观察组在肺炎的基础治疗上根据患儿病情使用相关治疗措施,如第一次USCOM检查显示外周血管阻力增高时使用血管活性药物酚妥拉明,如出现心力衰竭给予呋塞米、地高辛、酚妥拉明;根据USCOM检查结果调整液体量,如出现缺氧中毒性脑病给予相应的脱水、改善通气、止痉、糖皮质激素抗炎等治疗。所有病例未使用呼吸机辅助通气。存在心功能异常的患儿在治疗4~8 h后复查心功能,如治疗仍需调整或继续,则4~8 h后再行复查。
检查方法:(1)将患儿身长值、体重值输入USCOM。(2)患儿平躺,将探头置于胸骨上窝或胸骨左缘2~4肋间贴于皮肤并轻轻转动探头,当探头方向与血流方向相同时信号最强,此时超声频谱图形符合标准(三角形外形,顶点尖锐,线条平滑),机器可显示出CO、CI、HR、Vpk、SVR、SV数值,留取数据。每次测量持续约30 s,共测量3次,取平均值。1~12月龄婴儿USCOM测得的心功能指标正常参考值如下:CO 1.49~2.16 L/min,CI 3.7~5.1 L/min·m2,HR 103~145次/min,Vpk 1.12~1.50 m/s,SVR 2 111~3 666 d·s·cm-5,SV 12.9~16.6 cm3[9-11]。
1.3 统计学分析采用SPSS 11.5软件进行分析,计量资料以均数±标准差(x±s)表示,计数资料用率(%)表示,组间比较采用t检验或χ2检验,P<0.05为差异有统计学意义。
2 结果 2.1 一般情况两组患儿年龄、性别差异均无统计学意义(t值分别为1.034和0.680,均P>0.05)。观察组有2例患儿在治疗过程中出现心力衰竭。
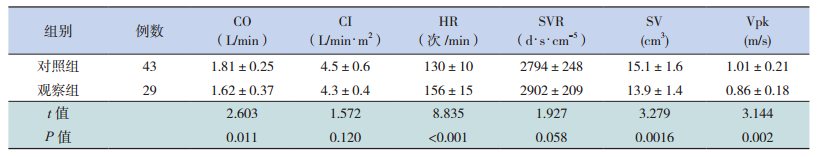
2.2 两组治疗前心功能比较治疗前对照组患儿心功能指标均正常,而观察组中有24例患儿存在心功能异常。观察组HR明显高于对照组,CO,SV,Vpk明显低于对照组,差异有统计学意义(P<0.05)。两组CI,SVR差异无统计学意义(P>0.05)。见表 1。
| 表 1 两组治疗前心功能比较(x±s) |
2.3 观察组治疗前后心功能变化
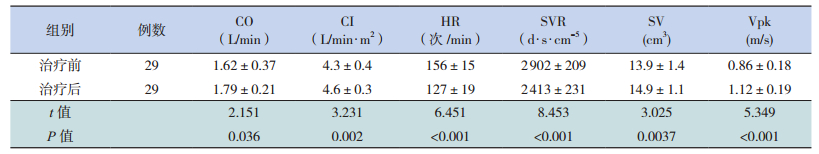
将观察组治疗前结果与治疗后最末次检查结果进行比较,发现观察组治疗后HR较治疗前降低,CO,CI,SVR,SV,Vpk较治疗前改善,差异有统计学意义(P<0.05),观察组治疗后各项指标均恢复到正常范围。见表 2。
| 表 2 观察组治疗前后心功能相关指标变化比较(x±s) |
3 讨论
重症肺炎所致的缺氧、酸中毒、肺动脉高压,以及在病原体毒素侵袭、炎症介质作用下常可引起患儿心肌损伤,甚至出现以心率增快、心音低钝等表现为主的心力衰竭。重症肺炎合并心力衰竭患儿存在肺动脉高压,右室负荷加重,左室射血分数,CI均下降,左室负荷加重,如病情不能得到有效控制易致患儿死亡[12-13]。故早期发现心功能改变并有效治疗心肌损伤,防止心功能障碍和循环衰竭的发生和发展,有助于改善病情的进展和预后,对重症患儿的救治有重要的临床意义。
USCOM工作原理是经皮测量经主动脉或肺动脉离心的血流速度,精确测定每次心脏搏动时血流动力,可实时监测患儿的心脏泵功能及整体循环状态[14-15]。相对于传统的超声心动图检查,该仪器体型轻巧,具有简便、快速、实时床旁连续监测等优点。国外一项关于USCOM准确度和精密度的Meta分析显示USCOM在测定患者心输出量方面其结果与热稀释法是相一致的,对检测患者心输出量有很重要的作用[16]。Chand等[17]的研究也表明,USCOM与热稀释法在测定血流动力学不稳定的成人患者CO、CI、SV方面有较好的相关性。Wongsirimetheekul等[18]的研究显示USCOM与超声心动图在测量重症患儿的CO及CI结果相比差异无统计学意义。这些研究都提示USCOM对患儿心功能的测定具有一定的可靠性。
本研究发现重症肺炎患儿与普通肺炎患儿的HR、CO、SV、Vpk差异有统计学意义。分析原因,重症肺炎时由于气体交换面积减少,可发生严重呼吸功能障碍引起低氧血症及酸中毒导致心肌损害,此外还存在在严重的微循环障碍,肺炎病原体及其毒素、大量炎症介质的作用也会引起心肌损伤[19]。重症肺炎患儿病情重,在缺氧、酸中毒、病原微生物毒素、炎症介质作用下心肌细胞膜完整性破坏,心肌细胞受损导致心肌收缩力下降,肺动脉压力增高,右室前负荷增加,右心输出量减少,左心房前负荷减少,加之重症肺炎患儿多存在少食及吐泻等体液丢失使心脏前负荷不足,从导致HR代偿性增快,SV、CO及Vpk下降。心肌收缩力差和补液是否过多是治疗重症患儿时常常面临的问题[20-21]。本研究通过应用USCOM随时监测危重患儿的SV、CO、SVR、HR,及时掌握患儿整体循环状态,使用正性肌力药物、血管活性药物、补充液量等多种措施改善循环状态,并对有治疗措进行评估发现及时应用正性肌力药物、血管活性药物,并调整补充液量,重症肺炎患儿治疗后心功能较治疗前改善。
综上,应用USCOM具有无创、快速、简便,实时连续监测有点,可准确、实时了解重症肺炎患儿的心功能状态及患儿整体循环状态,评估病情并为进一步诊断、治疗及判断预后提供依据,故床旁USCOM动态监测,具有很强的实用性。
| [1] | Rudan I, O'Brien KL, Nair H, et al. Epidemiology and etiology of childhood pneumonia in 2010:estimates of incidence, severe morbidity, mortality, underlying risk factors and causative pathogens for 192 countries[J]. J Glob Health , 2013, 3 (1) : 010401. |
| [2] | Scott JA, Brooks WA, Peiris JS, et al. Pneumonia research to reduce childhood mortality in the developing world[J]. J Clin Invest , 2008, 118 (4) : 1291–1300. DOI:10.1172/JCI33947 |
| [3] | 李小丽, 叶彩霞, 唐海霞, 等. 彩色双功能超声对婴幼儿重症肺炎的右心功能评价及临床价值[J]. 中外健康文摘 , 2013, 10 (8) : 10–11. |
| [4] | 刘继红, 龚小倩, 王芳. 脉冲多普勒Tei指数在评价小儿重症肺炎心功能的研究[J]. 国际医药卫生导报 , 2013, 19 (21) : 3274–3277. |
| [5] | Dhanani S, Barrowman NJ, Ward RE, et al. Intra-and interobserver reliability using a noninvasive ultrasound cardiac output monitor in healthy anesthetized children[J]. Paediatr Anaesth , 2011, 21 (8) : 858–864. DOI:10.1111/pan.2011.21.issue-8 |
| [6] | Beltramo F, Menteer J, Razavi A, et al. Validation of an Ultrasound Cardiac Output Monitor as a Bedside Tool for Pediatric Patients[J]. Pediatr Cardiol , 2016, 37 (1) : 177–183. DOI:10.1007/s00246-015-1261-y |
| [7] | 韩英, 刘涛, 耿荣, 等. 便携式超声心输出量监护仪在肺炎合并心力衰竭患儿心功能状态评价中的意义[J]. 中国小儿急救医学 , 2014, 21 (5) : 285–287. |
| [8] | 王卫平, 毛萌. 儿科学[M].8版. 北京: 人民卫生出版社, 2014 : 277 -278. |
| [9] | He SR, Zhang C, Liu YM, et al. Accuracy of the ultrasonic cardiac output monitor in healthy term neonates during postnatal circulatory adaptation[J]. Chin Med J (Engl) , 2011, 124 (15) : 2284–2289. |
| [10] | Kanmaz HG, Sarikabadayi YU, Canpolat E, et al. Effects of red cell transfusion on cardiac output and perfusion index in preterm infants[J]. Early Hum Dev , 2013, 89 (9) : 683–686. DOI:10.1016/j.earlhumdev.2013.04.018 |
| [11] | He SR, Sun X, Zhang C, et al. Measurement of systemic oxygen delivery and inotropy in healthy term neonates with the Ultrasonic Cardiac Output Monitor (USCOM)[J]. Early Hum Dev , 2013, 89 (5) : 289–294. DOI:10.1016/j.earlhumdev.2012.10.006 |
| [12] | Feldman C, Anderson R. Community-acquired pneumonia:pathogenesis of acute cardiac events and potential adjunctive therapies[J]. Chest , 2015, 148 (2) : 523–532. DOI:10.1378/chest.15-0484 |
| [13] | Hu D, Liu Y, Tao H, et al. Clinical value of plasma B-type natriuretic peptide assay in pediatric pneumonia accompanied by heart failure[J]. Exp Ther Med , 2015, 10 (6) : 2175–2179. |
| [14] | Gregory SD, Cooney H, Diab S, et al. In vitro evaluation of an ultrasonic cardiac output monitoring (USCOM) device[J]. J Clin Monit Comput , 2016, 30 (1) : 69–75. DOI:10.1007/s10877-015-9685-8 |
| [15] | Zorko DJ, Choong K, Gilleland J, et al. Urgent ultrasound guided hemodynamic assessments by a pediatric medical emergency team:a pilot study[J]. PLoS One , 2013, 8 (6) : e66951. DOI:10.1371/journal.pone.0066951 |
| [16] | Chong SW, Peyton PJ. A meta-analysis of the accuracy and precision of the ultrasonic cardiac output monitor (USCOM)[J]. Anaesthesia , 2012, 67 (11) : 1266–1271. DOI:10.1111/j.1365-2044.2012.07311.x |
| [17] | Chand R, Mehta Y, Trehan N. Cardiac output estimation with a new Doppler device after off-pump coronary artery bypass surgery[J]. J Cardiothorac Vasc Anesth , 2006, 20 (3) : 315–319. DOI:10.1053/j.jvca.2005.05.024 |
| [18] | Wongsirimetheekul T, Khositseth A, Lertbunrian R. Noninvasive cardiac output assessment in critically ill paediatric patients[J]. Acta Cardiol , 2014, 69 (2) : 167–173. |
| [19] | Minneci PC, Kilbaugh TJ, Chandler HK, et al. Factors associated with mortality in pediatric patients requiring extracorporeal life support for severe pneumonia[J]. Pediatr Crit Care Med , 2013, 14 (1) : e26–e33. DOI:10.1097/PCC.0b013e31826e7254 |
| [20] | 李援越. 心输出量监测系统在儿童危重症中的应用研究[J]. 中国小儿急救医学 , 2012, 19 (6) : 607–609. |
| [21] | Chang AC. Determination of cardiac output in critically ill children:are we any closer to the ideal methodology?[J]. Pediatr Crit Care Med , 2012, 13 (1) : 99. DOI:10.1097/PCC.0b013e31822882d8 |
 2016, Vol. 18
2016, Vol. 18