化脓性脑膜炎(purulent meningitis, 简称化脑)是由细菌感染引起的大脑或(及)脊髓周围炎症,为一种严重且有生命危险的常见小儿中枢神经系统感染性疾病,为婴儿及儿童死亡的重要原因之一。常见的感染病原包括肺炎球菌、B型流感嗜血杆菌和脑膜炎双球菌[1]。全球每年120万新发化脑患者,儿童病死率5%~15%[2-3];流感嗜血杆菌以及脑膜炎双球菌引起的化脑病死率低于B族肺炎链球菌所致化脑者[4]。23%的患儿可遗留严重的神经系统后遗症[5]。随着疫苗的应用,各个指标有所好转,但仍然是儿童健康的重要杀手。近年来,越来越多的关于脓毒症免疫机制的研究指出,在严重感染过程中机体的免疫激活与免疫抑制同时存在,并且感染越重免疫抑制的表现就越明显[6]。CD4+CD25+调节性T细胞(CD4+CD25+ regulatory T cells,简称Tregs)因具有强大的免疫抑制功能而成为研究的热点,可能主要通过直接接触和分泌抑制性细胞因子两大途径发挥免疫功能。其在重症化脑早期患儿血液中的改变尚未见明确报道。本研究通过检测重症化脑患儿早期外周血Tregs水平并且分析其临床特征,探讨重症儿童化脑早期Tregs改变与临床表现、炎性指标、脑脊液变化和转归的关系。
1 资料与方法 1.1 研究对象2014年8月至2015年12月入住中国医科大学附属盛京医院PICU的39例严重化脑患儿为研究对象,其中男23例,女16例。患儿年龄1~144个月(中位年龄5个月)。
1.2 纳入与排除标准纳入标准:(1)首次发病;(2)临床表现符合化脑诊断,如发热、惊厥、意识改变、颅内压增高、脑膜刺激征阳性等;(3)实验室检查符合严重细菌感染表现,如外周血WBC改变、CRP和/或降钙素原(PCT)升高,脑脊液外观浑浊、WBC>100×106/L,或WBC 在10~100×106/L之间而蛋白>1.0 g/L或葡萄糖<2.25 mmol/L;(4)脑脊液不能完全符合以上表现而脑脊液培养出致病性细菌;(5)患儿有中重度意识障碍(Glasgow昏迷评分<8分)持续时间48 h以上,或合并其他重要脏器功能障碍(肝脏、肾脏、胃肠道、肺脏、循环系统),或抽搐、发热、肢体活动障碍1周以上。
排除标准:(1)原发免疫缺陷患儿;(2)典型颅脑外伤或者手术患儿;(3)仅有脑脊液培养阳性,而临床表现和其他实验室检查不符合诊断者;(4)在院外正规治疗超过3 d的患儿。
1.3 研究方法回顾性分析所有入选患儿的临床特点和Tregs细胞的变化,分析患儿主要实验室检查和预后。根据患儿入院后12 h内血Tregs细胞的变化将患儿分为2组:(1)无Tregs降低组:Tregs细胞计数≥410个/mm3;(2)Tregs降低组:Tregs细胞计数<410个/mm3。分析患儿的年龄、性别、体温、住院时间、28 d病死率、血液炎性指标、脑脊液改变在两组患儿中的分布和差异。
1.4 Tregs淋巴细胞的检测取100 μL肝素抗凝血,加入20 mL PerCP标记的鼠抗人CD4抗体,20 μL FITC标记的鼠抗人CD25抗体。用流式细胞仪按规程操作,检测T淋巴细胞中Tregs占CD4+ T细胞的比例。以流式细胞仪双色、三色、四色分析法分别分析以及磁珠分选法筛选Tregs并给予计数。
1.5 统计学分析应用 SPSS 13.0 统计软件处理和分析数据。计数指标以率(%)表示,组间比较采用卡方检验。连续变量指标以均值±标准差(x±s)或者以中位数(范围)表示,组间比较采用成组t检验或非参数检验。P<0.05为差异有统计学意义。
2 结果 2.1 一般临床特征39例患儿中,Tregs比例为9%~61%(参考值:31%~60%),其中13例(33%)明显下降(<31%)。Tregs绝对计数为83~1 870个/mm3(参考值:410~1 590个/mm3),平均679±547个/mm3。18例(46%)Tregs绝对计数下降(<410个/mm3),仅有3例(8%)患儿血中Tregs绝对计数高于正常范围高值。
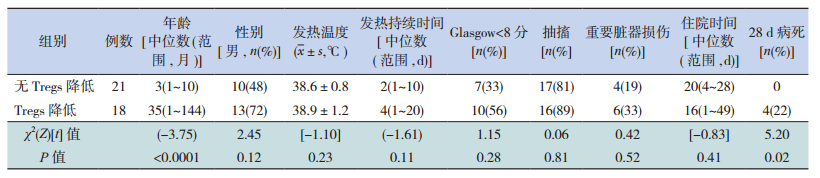
所有患儿均有发热,最高体温38~41℃,平均38.7±1.0℃,热程1~20 d,平均4 d。明显意识障碍35例(90%),其中Glasgow昏迷评分<8分17例(44%),8~12分18例(46%)。抽搐33例(85%);住院时间1~49 d,中位时间19 d。起病28 d内病死4例(10%)。Tregs降低组患儿平均年龄明显大于无Tregs降低组(P<0.05)。两组间性别、发热最高温度、发热持续时间及住院天数的比较差异无统计学意义。患儿出现严重意识障碍、抽搐及重要脏器功能障碍的发生几率在两组间比较差异也无统计学意义。4例(29%)28 d内死亡患儿均来自Tregs降低组,年龄均在1岁以内。有无Tregs降低两组一般资料的比较见表 1。
| 表 1 有无Tregs降低两组一般资料的比较 |
2.2 外周血白细胞、CRP及PCT的变化
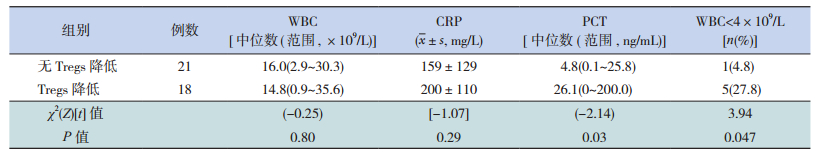
39例患儿血WBC计数为(0.9~35.6)×109/L,其中 25例(64%)升高(>11×109/L),8例(21%)在正常范围内[(4~11)×109/L],6例(15%)明显下降(<4×109/L)。39例(100%)患儿血CRP含量均高于正常值(8 mg/L),范围12~458 mg/L之间。39例(100%)患儿血PCT含量均高于正常值(0.05 ng/mL),范围0.1~55.2 mg/L之间。
有无Tregs降低两组外周血WBC计数及CRP水平比较差异无统计学意义。Tregs降低组血清PCT升高明显,显著高于无Tregs降低组(P<0.05)。Tregs降低组外周血WBC<4×109/L患儿比例亦显著高于无Tregs降低组(P<0.05)。见表 2。
| 表 2 有无Tregs降低两组血WBC、CRP及PCT水平的比较 |
2.3 脑脊液的变化
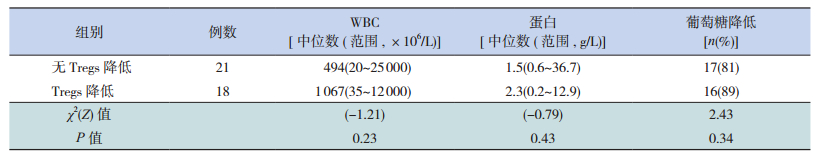
39例患儿脑脊液均有改变。脑脊液WBC数在(20~25 000)×106/L之间,其中>1 000×106/L者19例(49%),<100×106/L者7例(18%),其余介于两者之间。若和即时血糖对照,脑脊液中葡萄糖含量低于血糖值的50%者为39例(100%)。有无Tregs降低两组脑脊液WBC、蛋白水平及脑脊液葡萄糖降低的比例差异均无统计学意义,见表 3。
| 表 3 有无Tregs降低两组脑脊液改变的比较 |
3 讨论
儿童重症化脑仍是PICU中的重要疾病之一,患儿起病迅速,早期表现不典型,病情进展很快,可累及脑实质,甚至脑干部位;有些患儿伴有严重的血流感染和其他脏器的损伤甚至循环衰竭、呼吸衰竭,可致患儿病情迅速恶化而死亡。本研究中患儿均有脑实质受累表现,其中4例患儿死亡,病死率与其他报道[1-2]相当。作为严重感染性疾病,在疾病早期机体损伤程度与机体对感染的反应密不可分。1996年国外学者Bone等[7]指出,机体的免疫炎症反应取决于促炎/抗炎机制平衡,重症感染患儿在病程早期因促炎机制占优势,往往呈现过度炎症反应,但在病程中后期则转化为抗炎机制占优势而导致免疫抑制出现。但是近来的大量研究表明,全身炎症反应往往贯穿于脓毒症的全部过程,且免疫抑制在早期就已经存在[8-9]。本研究中所有39例患儿各指标的检测均在发病早期(病程3 d之内)进行,18例患儿Tregs绝对计数低于正常值,接近半数患儿的免疫状态出现异常,与全身感染相关的免疫机制的改变相一致,如果动态监测这一部分患儿的免疫状态,是否随着病程的进展会有更多的患儿出现免疫抑制有待进一步研究。
但关于Tregs在动物实验和患者的临床研究的结果却与整体免疫抑制有所不同。Tregs是一群对天然免疫和获得性免疫具有广泛抑制作用的细胞亚群。根据其产生来源可分为天然发生的调节性T 细胞(naturally occurring regulatory T cells, nTregs)和诱导性(或称适应性)调节性T细胞(induced regulatory T cells, iTregs)。Tregs与多种免疫性疾病的发病机制或免疫状态密切相关。有学者发现,脓毒症休克患者存在Tregs百分含量的增加,同时这一变化趋势与病人的预后密切相关[10]。进一步研究发现,循环中Tregs百分含量只是相对提高,而不是绝对数量的增加[11],提示与Tregs相比,可能其他T 细胞亚群对于脓毒症损伤时的凋亡信号更加敏感,其大量凋亡间接导致了Tregs百分含量的增加。在创伤病人以及小鼠脓毒症模型中,可以得到相似的结论[12-13]。这些研究结果说明Tregs在脓毒症及脓毒性休克中发挥了重要的作用。在儿童化脑这种特殊严重细菌感染性疾病中,对Tregs的变化研究甚少,国内尚未见明确报道。本组病例均为临床确诊为化脑,而外周血中早期Tregs细胞改变明显,除有3例患儿的结果高于正常值,大多数患儿正常或者低下,这与以上的脓毒性休克患者的免疫状态在感染早期多被激活呈现过度免疫不相符合。
本研究中Tregs细胞降低组患儿年龄明显高于Tregs正常组,目前尚无明确理论依据,根据对化脑的流行病学以及相关炎症反应的研究[14-17]推测,年龄越小的患儿因其整体机体的屏障功能、炎症的局限能力、原发和继发免疫反应的低下以及血脑屏障发育不完善等因素使其易于患化脑;而随着年龄的增长以上因素在逐渐发育,而感染因素包括感染的细菌种类、细菌量、细菌毒力、侵袭能力等更加突出成为主要易感因素,多数免疫功能正常的患儿可将感染局限在初始感染部位,如呼吸道、消化道、泌尿道或者皮肤,一旦感染所致的免疫损伤加重可能成为促进化脑的重要因素。儿童时期的淋巴细胞各个亚群的发育与多种因素相关,随着肠道菌群的建立,细胞免疫能力也日趋完善,感染发生后,成熟的T淋巴细胞更容易发挥免疫细胞作用,在与感染发生作用中年龄较大、免疫发育正常的儿童免疫紊乱更明显,故而在Tregs降低组的患儿平均年龄更大些。
外周血WBC计数升高特别是中性粒细胞升高是细菌感染的重要标志之一,而在严重感染患者中,外周血WBC的降低却意味着病情的凶险,伴发循环衰竭以及死亡的风险明显增高[18]。本研究中Tregs的降低与外周血WBC总数的变化趋势无明显相关性,但对于每组中WBC计数低于正常低值的重度感染,Tregs降低组其比例显著高于无Tregs降低组,提示化脑患儿早期全血Tregs的降低和感染的严重程度有关。同时Tregs的降低趋势和严重化脓性感染的另一个指标PCT也密切相关,在Tregs降低组中血清PCT水平显著高于无Tregs降低组。而PCT也是反映重要脏器损伤的指标,这一结果是否提示Tregs的降低伴随过高的PCT预示患儿脑损伤严重,或者预后不好呢?机体的免疫系统时刻发生着凋亡,它在维持免疫稳态和自身免疫耐受方面起着决定性作用,但全身炎症反应能够导致多种免疫细胞凋亡程序发生改变,后者反过来又进一步造成和加剧了免疫炎症反应紊乱,因此,炎症反应的转归取决于患者免疫炎症反应的平衡。早期的免疫功能抑制,对炎症反应的影响尚不明确[6, 19],不过本研究中所有4例死亡患者均有Tregs绝对计数的降低,提示免疫抑制与炎症反应强烈、脏器损伤严重、病变不易局限等相关。
综上,本研究显示儿童重症化脑患儿早期全血Tregs可能受到抑制,其与患儿炎症反应更重、病死率更高有关系。但是,贯穿于脓毒症整个病程中的免疫和炎症反应复杂多变,大样本动态系统研究细胞免疫的变化与疾病过程和转归的关系十分必要,临床诊治中更应该针对患病个体的实际状态给予个体化的判断和干预。
| [1] | van de Beek D. Progress and challenges in bacterial meningitis[J]. Lancet , 2012, 380 (9854) : 1623–1624. DOI:10.1016/S0140-6736(12)61808-X |
| [2] | Snelling TL, McIntyre PB. Assessing the effect of meningitis prevention and treatment[J]. Lancet Infect Dis , 2014, 14 (9) : 780–781. DOI:10.1016/S1473-3099(14)70873-4 |
| [3] | Briand C, Levy C, Baumie F, et al. Outcomes of bacterial meningitis in children[J]. Med Mal Infect , 2016, 46 (4) : 177–187. DOI:10.1016/j.medmal.2016.02.009 |
| [4] | van de Beek D, de Gans J, Spanjaard L, et al. Clinical features and prognostic factors in adults with bacterial meningitis[J]. N Engl J Med , 2004, 351 (18) : 1849–1859. DOI:10.1056/NEJMoa040845 |
| [5] | Lucas MJ, Brouwer MC, van de Beek D. Neurological sequelae of bacterial meningitis[J]. J Infect , 2016, 73 (1) : 18–27. DOI:10.1016/j.jinf.2016.04.009 |
| [6] | Chiswick EL, Mella JR, Bernardo J, et al. Acute-phase deaths from murine polymicrobial sepsis are characterized by innate immune suppression rather than exhaustion[J]. J Immunol , 2015, 195 (8) : 3793–802. DOI:10.4049/jimmunol.1500874 |
| [7] | Bone RC. Sir Isaac Newton, sepsis, SIRS, and CARS[J]. Crit Care Med , 1996, 24 (7) : 1125–1128. DOI:10.1097/00003246-199607000-00010 |
| [8] | Huo R, Wang L, Wang X, et al. Removal of regulatory T cells prevents secondary chronic infection but increases the mortality of subsequent sub-acute infection in sepsis mice[J]. Oncotarget , 2016, 7 (10) : 10962–10975. |
| [9] | Delano MJ, Ward PA. Sepsis-induced immune dysfunction:can immune therapies reduce mortality?[J]. J Clin Invest , 2016, 126 (1) : 23–31. DOI:10.1172/JCI82224 |
| [10] | Yadav M, Stephan S, Bluestone JA. Peripherally induced Tregss-role in immune homeostasis and autoimmunity[J]. Front Immunol , 2013, 4 : 232. |
| [11] | Markwart R, Condotta SA, Requardt RP, et al. Immunosuppression after sepsis:systemic inflammation and sepsis induce a loss of naïve T-cells but no enduring cell-autonomous defects in T-cell function[J]. PLoS One , 2014, 9 (12) : e115094. DOI:10.1371/journal.pone.0115094 |
| [12] | 万健, 单怡, 张冬青, 等. 脓毒症小鼠CD4+CD25+Foxp3+ T细胞变化及其意义[J]. 中华临床医师杂志(电子版) , 2012, 6 (15) : 249–253. |
| [13] | 冷凤英. 脓毒症患者CD4+CD25+Foxp3+调节性T细胞及可溶性CD25分子水平研究[D]. 上海:上海交通大学, 2010. |
| [14] | Takada H, Ishimura M, Takimoto T, et al. Invasive bacterial infection in patients with interleukin-1 receptor-associated Kinase 4 deficiency:case report[J]. Medicine (Baltimore) , 2016, 95 (4) : e2437. DOI:10.1097/MD.0000000000002437 |
| [15] | Savva A, Brouwer MC, Roger T, et al. Calandra functional polymorphisms of macrophage migration inhibitory factor as predictors of morbidity and mortality of pneumococcal meningitis[J]. Proc Natl Acad Sci U S A , 2016, 113 (13) : 3597–3602. DOI:10.1073/pnas.1520727113 |
| [16] | Elenga N, Sicard S, Cuadro-Alvarez E, et al. Pediatric bacterial meningitis in French Guiana[J]. Med Mal Infect , 2015, 45 (11-12) : 441–445. DOI:10.1016/j.medmal.2015.10.003 |
| [17] | Gensollen T, Iyer SS, Kasper DL, et al. How colonization by microbiota in early life shapes the immune system[J]. Science , 2016, 352 (6285) : 539–544. DOI:10.1126/science.aad9378 |
| [18] | van Vught LA, Klein Klouwenberg PM, Spitoni C, et al. Incidence, risk factors, and attributable mortality of secondary infections in the intensive care unit after admission for sepsis[J]. JAMA , 2016, 315 (14) : 1469–1479. DOI:10.1001/jama.2016.2691 |
| [19] | Yang WY, Shao Y, Lopez-Pastrana J, et al. Pathological conditions re-shape physiological Tregs into pathological Tregs[J]. Burns Trauma , 2015, 3 (1) : pii:1. DOI:10.1186/s41038-015-0001-0 |
 2016, Vol. 18
2016, Vol. 18