急性淋巴细胞白血病(acute lymphocytic leukemia, ALL)是儿童时期最常见的恶性肿瘤,占儿童恶性肿瘤的35%[1],近年来呈上升趋势,其发病机制尚不完全清楚。大量研究表明,Wnt/β-连环蛋白(β-catenin)通路的异常激活在多种恶性肿瘤的发生发展中起重要作用[2-5],但在儿童急性淋巴细胞白血病发病中的作用如何罕有报道。本文通过对Wnt通路抑制因子1(Wnt inhibitor factor 1, Wif-1)及β-catenin在儿童急性淋巴细胞白血病中的表达及相关性研究,探讨Wnt/β-catenin通路在儿童急性淋巴细胞白血病发病中的作用。
1 资料与方法 1.1 研究对象收集徐州医科大学附属医院儿科血液组和徐州市儿童医院血液科2013年7月至2015年9月期间初发的急性淋巴细胞白血病住院患儿。入组条件:经醋酸泼尼松窗口治疗7 d后予VDLP方案诱导治疗,诱导治疗第33天骨髓达完全缓解者。符合入组条件的共35例,其中男20例、女15例,年龄1~14岁,平均年龄5.1±2.8岁;低危14例,中危11例,高危10例;T系急性淋巴细胞白血病(T-cell acute lymphocytic leukemia, T-ALL)8例,B系急性淋巴细胞白血病(B-cell acute lymphocytic leukemia, B-ALL)27例。以治疗前作为初发组,诱导治疗第33天达完全缓解者作为缓解组。15例同期住院无心、肝、肺、肾等重要脏器损害的非恶性血液系统疾病患儿作为对照组,包括血小板减少性紫癜10例、营养性贫血5例,其中男6例、女9例,年龄1~11岁,平均年龄4±3岁。各组年龄和性别构成比差异无统计学意义(P>0.05)。本研究获得医院伦理委员批准及研究对象监护人书面知情同意。
ALL诊断、分型及疗效判断符合儿童急性淋巴细胞白血病诊疗建议(第三次修订)标准[6],经骨髓细胞形态学、免疫学分型、细胞遗传学、分子生物学确诊。
1.2 主要试剂和器材淋巴细胞分离液购自美国MP Biomedicals;Trizol总RNA提取试剂、cDNA第一链合成试剂盒、2×Taq PCR MasterMix均购自北京天根生化科技有限公司;相关引物由上海生工合成,HAP纯化;人Wif-1 ELISA试剂盒购自上海西唐生物科技有限公司;PCR扩增仪购自美国MJ Research;Gel Doc XR+成像系统购自上海柏辰生物科技有限公司;酶标仪,型号DENLEY DRAGON Wellscan MK 3,购自Thermo公司。
1.3 标本制备分别于初诊行白血病免疫分型同时以及诱导治疗第33天采集骨髓2~3 mL,肝素抗凝,密度梯度离心法分离单个核细胞,PBS液洗涤2次,将单个核细胞和血浆分别移至不同EP管,-80℃冰箱冻存待用。
1.4 RT-PCR半定量检测Wif-1和β-catenin mRNA表达水平Trizol反复吹打单个核细胞,提取总RNA。逆转录cDNA:5 μL总RNA加2 μL oligo(dT)15 Primer、2 μL Super Pure dNTPs,RNase-Free ddH2O定容至14.5 μL,70℃加热5 min,冰上冷却2 min,加4 μL 5×First-Strand Buffer、0.5 μL RNasin、1 μL TIANScript M-MLV,混匀,42℃温浴50 min,95℃加热5 min终止反应。
PCR扩增:取上一步骤样品3 μL,上下游引物各1 μL(β-catenin上游引物:5'-GCTGATTTGATGGAGTTGGACATGG-3'、下游引物:5'-GCCAAACGCTGGACATTAGTGG-3';β-actin上游引物:5'-GACAACGGCTCCGGCATGTG-3'、下游引物:5'-TGAGGATGCCTCTCTTGCTC-3',扩增产物长度分别为565 bp和166 bp;Wif-1上游引物:5'-GGGTGTTTTATTGGGTGTATTGT-3'、下游引物:5'-AAAAAAACTAACACAAACAAAATACAAAC-3';β-actin上游引物:5'-GGCACCACACCTTCTACAA-TG-3'、下游引物:5'-GTGGTGGTGAAGCTGTAG-3',扩增产物长度分别154 bp和369 bp),2×Taq PCR MasterMix 12.5 μL,补RNase-Free ddH2O至25 μL体系,94℃预变性3 min,然后94℃变性30 s,55℃退火30 s,72℃延伸1 min,共30个循环,最后72℃延伸5 min。
取目的产物5 μL加内参产物5 μL,于琼脂糖凝胶120 V电泳40 min,留取图像样本,Image J软件进行图像分析,计算Wif-1和β-catenin与内参灰度值之比,作为Wif-1和β-catenin mRNA相对含量。
1.5 ELISA法测定血浆Wif-1蛋白表达参照人Wif-1 ELISA试剂盒说明书,采用双抗体夹心法检测各血浆样本中Wif-1蛋白的表达。
1.6 统计学分析采用SPSS16.0统计软件进行统计处理。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两独立样本比较采用t检验,相关性分析采用Spearman检验。以P<0.05为差异有统计学意义。
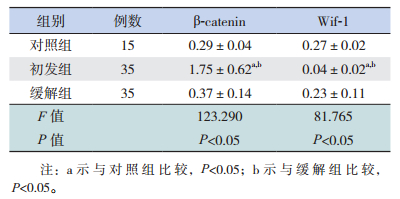
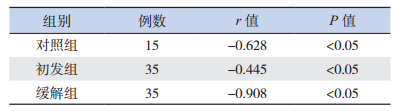
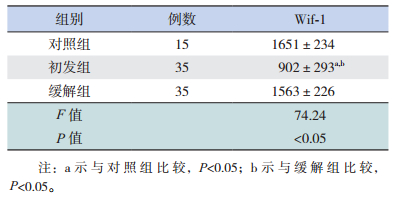
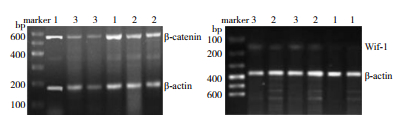
2 结果 2.1 各组β-catenin和Wif-1 mRNA表达结果及相关性分析初发组β-catenin mRNA相对表达量明显高于缓解组和对照组,Wif-1 mRNA相对表达量明显低于缓解组和对照组,差异均有统计学意义(P<0.05);缓解组与对照组之间比较,β-catenin和Wif-1 mRNA表达差异无统计学意义(P>0.05)。见图 1、表 1。各组β-catenin mRNA和Wif-1 mRNA相对表达量呈负相关。见表 2。
|
图 1 RT-PCR检测各组β-catenin mRNA(左)和Wif-1 mRNA(右)表达 1为初发组,2为缓解组,3为对照组,marker为标准参照物。 |
| 表 1 各组β-catenin mRNA和Wif-1 mRNA表达水平(x±s) |
| 表 2 各组β-catenin mRNA和Wif-1 mRNA的相关性分析 |
2.2 不同临床分型的ALL患儿β-catenin mRNA和Wif-1 mRNA表达比较
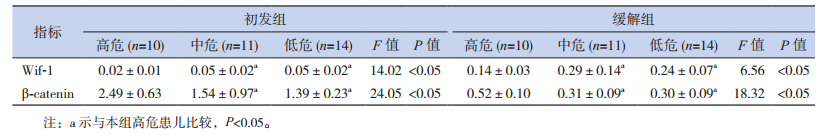
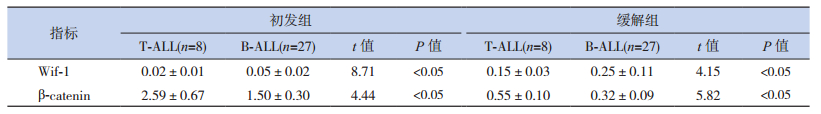
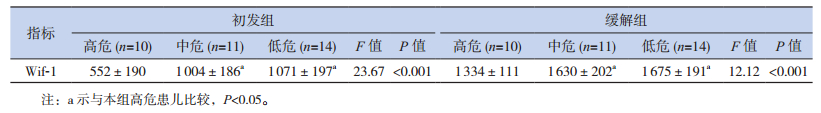
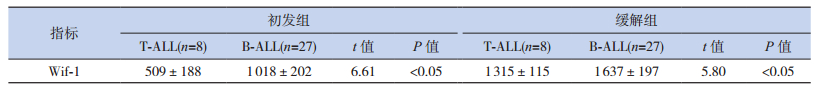
在初发组和缓解组中,高危患儿的β-catenin mRNA均高于中危和低危患儿,Wif-1 mRNA表达低于中危和低危患儿,差异均有统计学意义(P<0.05);β-catenin和Wif-1的mRNA表达在中危患儿和低危患儿之间差异无统计学意义(P>0.05);初发组、缓解组T-ALL患儿的β-catenin mRNA表达高于B-ALL患儿,Wif-1mRNA表达低于B-ALL,差异有统计学意义(P<0.05)。见表 3~4。
| 表 3 不同危险度ALL患儿的β-catenin和Wif-1 mRNA相对表达(x±s) |
| 表 4 不同免疫分型ALL患儿的β-catenin和Wif-1 mRNA相对表达(x±s) |
2.3 Wif-1蛋白的表达比较
初发组血浆Wif-1蛋白表达明显低于缓解组和对照组,差异有统计学意义(P<0.05);缓解组和对照组之间的Wif-1蛋白表达差异无统计学意义(P>0.05)。见表 5。
| 表 5 各组血浆Wif-1蛋白的表达(x±s,pg/mL) |
在初发组和缓解组中,高危患儿血浆Wif-1蛋白表达均明显低于中危及低危患儿,差异有统计学意义(P<0.05),而中危、低危患儿之间差异无统计学意义(P>0.05);T-ALL患儿Wif-1蛋白表达明显低于B-ALL患儿,差异有统计学意义(P<0.05)。见表 6~7。
| 表 6 不同危险度ALL患儿的血浆Wif-1蛋白表达(x±s,pg/mL) |
| 表 7 不同免疫分型ALL患儿的血浆Wif-1蛋白表达(x±s,pg/mL) |
3 讨论
Wnt信号转导通路是一条多环节、多作用位点的开放式途径,研究表明,Wnt通路有两大类,经典Wnt信号通路即 Wnt/β-catenin通路,非经典Wnt通路,包括Wnt/Ca2+途径、极性通路等[7],对Wnt/β-catenin通路目前研究较为深入,其具体机制为: Wnt蛋白和细胞表面特异性受体卷曲蛋白受体及辅助受体低密度脂蛋白受体相关蛋白结合后,受体激活,抑制下游蛋白质复合物,包括轴蛋白(Axin)、糖原合成酶激酶3β(glycogen synthesis kinase3β, GSK-3β)、大肠腺瘤息肉蛋白(adenomatous polyposis coli, APC)及酪蛋白激酶1α(casein kinase 1α, CK-1α),而Axin/GSK-3β/APC/CK1α蛋白复合物可通过磷酸化作用促进细胞内信号分子β-catenin的降解[8],β-catenin是Wnt信号经典通路具有调控转录活性的关键成员,其大量累积进入细胞核后可激活c-myc、cyclin等一系列靶基因的转录,最终导致肿瘤的形成[7]。Wif-1为Wnt通路抑制因子之一,在胞质内合成,是一种分泌型糖蛋白 [9-10],其在细胞膜表面与Wnt配体竞争结合受体从而阻断Wnt信号传导,防止Wnt通路异常激活[11],当Wif-1表达降低时,Wnt通路抑制作用减弱,下游蛋白质复合物对β-catenin磷酸化作用减弱,从而β-catenin在胞质中大量累积,有报道,在肾上腺皮质瘤、结直肠、肺癌等肿瘤中Wif-1低表达,β-catenin高表达[3-4, 12],但在儿童ALL中少有报道。
本研究显示,初发ALL组Wif-1 mRNA和蛋白表达降低,β-catenin mRNA表达增高,Wif-1和β-catenin mRNA表达呈负相关。我们认为,在儿童ALL中,Wif-1基因启动子通过甲基化作用失活,使Wif-1降低[13],对Wnt通路的抑制作用减弱,下游蛋白质复合物对β-catenin磷酸化降解作用降低,细胞质中β-catenin大量累积并进入细胞核中,促进核内c-myc、cyclin等癌基因的转录[7, 14],从而导致儿童ALL的发生。化疗药物可通过去甲基化恢复Wif-1的表达[15],因此,诱导缓解治疗后,缓解组与非肿瘤性血液病患儿的Wif-1 mRNA和蛋白、β-catenin mRNA的表达差异无统计学意义。
本研究发现T-ALL β-catenin的表达高于B-ALL,Wif-1表达低于B-ALL,高危患儿β-catenin表达高于中危、低危患儿,Wif-1表达低于中危、低危患儿,这是由于在T-ALL和高危患儿中Wnt通路的抑制作用减弱,最终导致T-ALL和高危ALL患儿细胞核内c-myc、cyclin等癌基因转录过高;T细胞亚型作为ALL高危因素,Wif-1的低表达是其原因之一,这也许与Wif-1 CpG岛甲基化表型有关[16]。
综合本研究结果,我们认为,Wnt通路中Wif-1和β-catenin参与了儿童ALL的发病,它们的表达高低可以作为儿童ALL预后的重要因素,Wif-1和β-catenin定量分析对儿童ALL治疗和预后判断有重要的临床意义,寻找新的治疗方法恢复Wif-1的表达,可能成为儿童ALL治疗的手段之一。
| [1] | Kuo FC, Wang SM, Shen CF, et al. Bloodstream infections in pediatric patients with acute leukemia:Emphasis on gramnegative bacteria infections[J]. J Microbiol Immunol Infect , 2015, 103 (17) : 1033–1039. |
| [2] | Wang R, Geng N, Zhou Y, et al. Aberrant Wnt-1/beta-catenin signaling and WIF-1 deficiency are important events which promote tumor cell invasion and metastasis in salivary gland adenoid cystic carcinoma[J]. Biomed Mater Eng , 2015, 26 (Suppl 1) : S2145–2153. |
| [3] | Mitsui Y, Yasumoto H, Nagami T, et al. Extracellular activation of Wnt signaling through epigenetic dysregulation of Wnt inhibitory factor-1(Wif-1) is associated with pathogenesis of adrenocortical tumor[J]. Oncotarget , 2014, 5 (8) : 2198–2207. DOI:10.18632/oncotarget |
| [4] | 方园, 王鲁平, 张玉萍, 等. 结直肠锯齿状病变的Wif-1基因甲基化状态及β连环蛋白的表达[J]. 中华病理学杂志 , 2014, 43 (1) : 15–19. |
| [5] | Zhang J, Zhou B, Liu Y, et al. Wnt inhibitory factor-1 functions as a tumor suppressor through modulating Wnt/β-catenin signaling in neuroblastoma[J]. Cancer Lett , 2014, 348 (1-2) : 12–19. DOI:10.1016/j.canlet.2014.02.011 |
| [6] | 吴敏媛, 李志刚, 崔蕾, 等. 儿童急性淋巴细胞白血病诊疗建议(第四次修订)[J]. 中华儿科杂志 , 2014, 52 (9) : 641–644. |
| [7] | 袁媛, 王前, 司维柯. Wnt信号转导通路及其与肿瘤相关的调节因素研究进展[J]. 实用医药杂志 , 2014, 31 (10) : 943–945. |
| [8] | Krieghoff E, Behrens J, Mayr B. Nucleo-cytoplasmic distribution of β-catenin is regulated by retention[J]. J Cell Sci , 2006, 119 (Pt7) : 1453–1463. |
| [9] | 李凤立, 靳卫国. Wnt蛋白分泌机制的研究进展[J]. 泰山医学院学报 , 2013, 34 (11) : 884–886. |
| [10] | 张义灵, 冯英明. WIF-1启动子甲基化与肿瘤[J]. 现代肿瘤医学 , 2011, 19 (11) : 2345–2348. |
| [11] | Liepinsh E, Bányai L, Patthy L, et al. NMR structure of the WIF domain of the human Wnt-inhibitory factor-1[J]. J Mol Biol , 2006, 357 (3) : 942–950. DOI:10.1016/j.jmb.2006.01.047 |
| [12] | Xu JH, Yang HP, Zhou XD, et al. Role of Wnt inhibitory factor-1 in inhibition of Bisdemethoxycurcumin mediated epithelial-tomesenchymal transition in highly metastatic lung cancer 95D cells[J]. Chin Med J (Engl) , 2015, 128 (10) : 1376–1383. DOI:10.4103/0366-6999.156795 |
| [13] | 王焱, 朱传升, 毕可红, 等. 急性白血病患者WIF-1基因启动子甲基化及β连环蛋白表达的研究[J]. 中华医学杂志 , 2011, 91 (40) : 2858–2860. |
| [14] | He TC, Sparks AB, Rago C, et al. Identification of c-MYC as a target of the APC pathway[J]. Science , 1998, 281 (5382) : 1509–1512. DOI:10.1126/science.281.5382.1509 |
| [15] | 胡曼, 戴立里, 曾维政. 普鲁卡因与5'-氮杂-2'-脱氧胞苷对人肝肿瘤细胞株HepG2中Wif-1基因启动子甲基化影响的比较研究[J]. 四川大学学报(医学版) , 2013, 44 (1) : 27–30. |
| [16] | Roman-Gomez J, Jimenez-Velasco A, Agirre X, et al. Lack of CpG island methylator phenotype defines a clinical subtype of T-cell acute lymphoblastic leukemia associated with good prognosis[J]. J Clin Oncol , 2005, 23 (28) : 7043–7049. DOI:10.1200/JCO.2005.01.4944 |
 2016, Vol. 18
2016, Vol. 18