2. 潍坊医学院临床学院眼科, 山东 潍坊 261053
新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)严重威胁新生儿的生命,可以导致脑瘫、癫痫、智力低下等严重后遗症[1]。新生儿HIBD的发病机制尚不完全明确,而凋亡是HIBD后期脑神经细胞损伤与功能障碍的主要原因[2],因此,减轻神经细胞的凋亡将有利于新生儿HIBD的恢复。研究发现腹腔注射脐血单个核细胞(umbilical cord blood mononuclear cells, UCBMC)可降低HIBD脑组织神经细胞的活性Caspase-3表达[3],侧脑室移植UCBMC亦可减轻HIBD,并可改善大鼠的远期行为学[4-5],但HIBD新生大鼠侧脑室移植UCBMC能否减少神经元的活性Caspase-3表达并抑制脑神经元凋亡目前尚不清楚。本研究采用NeuN(成熟神经元标记物)/活性Caspase-3免疫荧光双标以及TUNEL法观察UCBMC侧脑室移植对HIBD新生大鼠脑组织神经细胞凋亡的影响,并采用Western blot法观察UCBMC移植对脑组织Bcl-2、Bax蛋白表达的影响,以探讨UCBMC移植治疗新生大鼠HIBD的机制,以期为UCBMC治疗的临床应用提供理论依据。
1 材料与方法 1.1 主要试剂与设备人全血单个核细胞分离液(天津TBD公司);兔抗Bax、Bcl-2一抗(美国Abcam公司);小鼠抗NeuN一抗(美国Chemicon公司);兔抗活性Caspase-3一抗(美国CST公司);荧光防淬灭剂(含DAPI,美国sigma公司);常压氧舱(武汉七0一研究所);大鼠脑立体定位仪(深圳瑞奥德公司);5 μL微量注射器(上海生物工程有限公司);正置荧光显微镜(日本OLYMPUS公司);石蜡切片机(英国Shanton公司);电子分析天平(美国梅特勒公司);垂直电泳仪、转移电泳仪(北京六一仪器厂)。
1.2 实验动物及分组健康7 d龄Sprague-Dawley(SD)新生大鼠(购自山东省中医药大学动物中心)64只,雌雄不限,体重11.9~15.2 g,平均13.6±1.8 g,随机分为4组:①正常对照(normal, N)+生理盐水(normal saline, NS)组,SD大鼠生后第8天侧脑室注射2 μL NS;② HIBD+NS组,HIBD造模24 h后侧脑室注射2 μL NS;③ N+UCBMC组,SD大鼠生后第8天侧脑室注射2 μL(3×106个细胞)UCBMC;④ HIBD+UCBMC组,HIBD造模24 h后侧脑室注射2 μL UCBMC。每组16只。
1.3 HIBD模型的制作7 d龄新生大鼠采用经典Rice-Vannucci方法[6]制成HIBD模型,乙醚吸入麻醉,颈部正中切口,分离左侧颈总动脉,电凝笔电凝后缝合皮肤,并置于(8.00±0.01)%低氧舱内缺氧2 h,舱内温度控制在(36±1)℃,湿度为(70±5)%。
1.4 UCBMC的采集、分离与移植经得产妇同意,取健康足月新生儿脐血约50 mL,0.01 mol/L灭菌磷酸盐缓冲液等体积稀释,灭菌离心管中先加入单个核细胞分离液,缓慢加入稀释后的脐带血(稀释脐血与单个核细胞分离液的体积比约为2:1),2 000转/min离心20 min,吸取中间白膜界面层的单个核细胞,生理盐水洗涤,制成单个核细胞悬液,用生理盐水调整细胞浓度至1.5×106 /μL,置冰上备用。
HIBD后24 h,HIBD+UCBMC组与N+UCBMC组大鼠分别置于大鼠立体定位仪,坐标:前后位(AP)-0.5 mm、中线(ML)-2 mm、深度(DV)-2 mm,左侧侧脑室缓慢注入(持续2 min以上)UCBMC悬液,并留针5 min、拔针2 min以上,每只大鼠注入2 μL脐血单个核细胞。移植后缝合头皮,复温苏醒后回笼饲养。
1.5 标本的采集各组大鼠于移植后7 d分两部分处死,一部分(n=10)心脏灌注后断头取脑,4%多聚甲醛后固定过夜,常规石蜡包埋,于前囟前1.0 mm至前囟后0.8 mm处行冠状位非连续切片(侧脑室平面,每隔5片取1片),制成4 μm厚的石蜡切片,用于免疫荧光双标染色及TUNEL染色;另一部分(n=6)大鼠腹腔麻醉后断头,取损伤侧大脑半球的前囟前1.0 mm至前囟后5.0 mm处脑组织,液氮冷冻,置-86℃超低温冰箱保存,用于Western blot检测。所有动物无中途死亡,全部纳入实验结果分析。
1.6 NeuN/活性Caspase-3免疫荧光双标染色石蜡切片脱蜡至水,热修复抗原,37℃正常山羊血清封闭1 h,弃去血清,分别加入小鼠抗NeuN一抗(1:100,Chemicon,美国)与兔活性Caspase-3一抗(1:100,Cell signaling technology, 美国),湿盒内4℃冰箱过夜,弃去一抗,0.01 mol/L的PBS漂洗3次,滴加Cy3标记的山羊抗大鼠IgG(1:100,北京中杉金桥生物试剂有限公司)与FITC标记的山羊抗兔IgG(1:100,北京中杉金桥生物试剂有限公司),37℃避光孵育1 h,DAPI封片剂封片(F6057, Sigma,美国),正置荧光显微镜(BX-51,Olympus,日本)观察并拍照,计数NeuN+活性Caspase-3+DAPI+细胞(Olympus荧光显微镜自带软件Cellsense 1.6),每张切片取5个视野并计算其平均数。
1.7 TUNEL染色石蜡切片常规脱蜡至水,3% H2O2室温孵育20 min灭活内源性过氧化物酶,洗涤后加入0.01 mol/L Tris-HCl缓冲盐溶液(TBS)新鲜稀释的Proteinase K(1:20),37℃消化10 min,含0.1% Triton X-100的磷酸盐缓冲液洗涤,加入标记缓冲液,湿盒中37℃孵育1 h,TBS冲洗,加入生物素化地高辛FITC抗体(1:100),37℃孵育30 min,TBS清洗后用含DAPI的封片剂封片,TUNEL阳性细胞计数方法同1.6。
1.8 Western blot检测脑组织Bax与Bcl-2蛋白的表达取脑组织置于液氮研磨,加入全细胞裂解液提取总蛋白,采用考马斯亮蓝染色法进行蛋白定量,取60 μg蛋白,10%的聚丙烯酰胺分离胶分离,电压300 V湿转膜1 h,室温封闭液封闭1~2 h,分别加入兔抗Bcl-2(1:1 000)、兔抗Bax(1:1 000)、小鼠抗GAPDH(1:1 000)一抗,4℃孵育过夜。洗膜,加入二抗室温孵育2 h,采用ECL化学发光试剂盒显影,化学发光凝胶成像系统拍照、分析目的蛋白的光密度值,并计算其与GAPDH光密度值的比值。
1.9 统计学分析采用SPSS 18.0统计软件进行统计学处理。计量资料用均数±标准差(x±s)表示,方差齐性资料采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
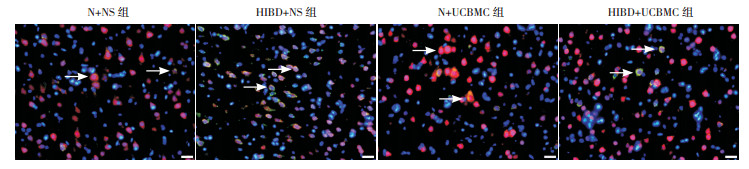
2 结果 2.1 脑组织NeuN/Caspase-3免疫荧光双标染色结果NeuN是成熟神经元的标记物,N+NS组与N+UCBMC组均可见大量NeuN+细胞和少量NeuN+活性Caspase-3+DAPI+细胞,二组比较差异无统计学意义(P > 0.05);HIBD+NS组的NeuN+细胞明显减少,NeuN+活性Caspase-3+DAPI+细胞显著多于N+NS组与N+UCBMC组,差异有统计学意义(均P < 0.01);HIBD+UCBMC组可见较多NeuN+细胞,NeuN+活性Caspase-3+DAPI+细胞数显著少于HIBD+NS组(P < 0.01),但仍多于N+NS组与N+UCBMC组(均P < 0.01)。见图 1。
|
图 1 脑组织NeuN/Caspase-3/DAPI免疫荧光染色结果(400×,n=10)NeuN+细胞,胞核染为红色;活性Caspase-3+细胞,胞浆与核周均染为绿色,细胞核被DAPI染色为蓝色。箭头所指为NeuN+活性Caspase-3+DAPI+细胞,细胞核为红、绿、蓝3种颜色的混合色,部分胞浆为绿色。N+NS及N+UCBMC组,仅见少量NeuN+活性Caspase-3+DAPI+细胞,HIBD+NS组可见大量NeuN+活性Caspase-3+DAPI+细胞,HIBD+UCBMC组的NeuN+活性Caspase-3+DAPI+细胞明显少于HIBD+NS组。 |
2.2 脑组织TUNEL/DAPI染色结果
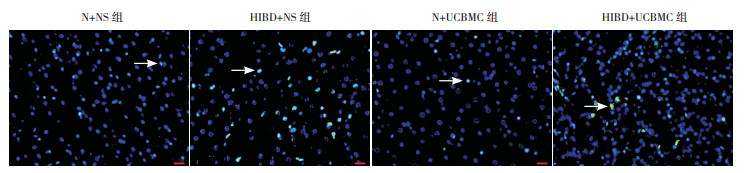
TUNEL法是检测细胞凋亡的经典方法。N+NS组与N+UCBMC组仅可见少量TUNEL+DAPI+细胞,二者差异无统计学意义(P > 0.05);HIBD+NS组可见大量TUNEL+DAPI+细胞,高于N+NS组与N+UCBMC组,差异具有统计学意义(均P < 0.01);HIBD+UCBMC组TUNEL+DAPI+细胞数少于HIBD+NS组(P < 0.01),但高于N+NS组(P < 0.01)和N+UCBMC组(P < 0.01)。见图 2。
|
图 2 TUNEL/DAPI免疫荧光染色结果(400×,n=10)TUNEL+细胞的胞核染为绿色;DAPI+细胞的胞核染为蓝色。箭头所指为TUNEL+DAPI+细胞(胞核为绿色与蓝色的混合色)。N+NS与N+UCBMC组,仅见少量TUNEL+DAPI+细胞;HIBD+NS组可见大量TUNEL+DAPI+细胞;HIBD+UCBMC组的TUNEL+DAPI+细胞明显少于HIBD+NS组。 |
2.3 Bax与Bcl-2蛋白表达
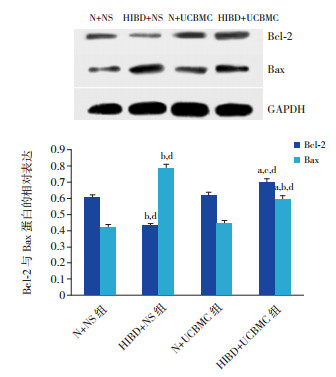
移植7 d后N+NS与N+UCBMC组的Bax与Bcl-2蛋白表达,二组比较差异无统计学意义(P > 0.05)。HIBD+NS组的Bax蛋白表达高于N+NS(P < 0.01)和N+UCBMC组(P < 0.01),Bcl-2蛋白表达低于N+NS(P < 0.01)与N+UCBMC组(P < 0.01);HIBD+UCBMC组的Bax蛋白表达较HIBD+NS组显著降低(P < 0.01),但仍高于N+NS(P < 0.01)与N+UCBMC组(P < 0.01),其Bcl-2蛋白浓度高于HIBD+NS组(P < 0.01)、N+NS组(P < 0.05)及N+UCBMC组(P < 0.05)。见图 3。
|
图 3 Western blot检测各组Bcl-2与Bax蛋白表达(n=6)a示与HIBD+NS组比较,P < 0.01;b示与N+UCBMC组比较,P < 0.01;c示与N+UCBMC组比较,P < 0.05;d示与N+NS组比较,P < 0.01。 |
3 讨论
UCBMC是一种含有多种前体细胞的异质性群体[7-8],具有来源丰富、易于采集及保存、低免疫原性与移植耐受性好等独特优势。研究已表明侧脑室移植UCBMC可减轻新生大鼠HIBD,其机制可能与减轻神经细胞凋亡有关[3]。神经细胞主要包括神经元、星形胶质细胞及少突胶质细胞,其中神经元是神经系统结构与功能的基本单位。目前,UCBMC移植对神经元凋亡的影响尚不清楚,本研究在此基础上采用NeuN/活性Caspase-3双标观察UCBMC移植对神经元凋亡的影响并探讨其相关机制。Caspase-3又称死亡蛋白,活性Caspase-3在凋亡过程中起重要作用,本研究采用成熟神经元的标记物NeuN与活性Caspase-3双重免疫荧光染色,发现HIBD新生大鼠的脑组织NeuN+活性Caspase-3+DAPI+细胞明显增加,提示HIBD新生大鼠脑组织大量神经元发生凋亡;N+UCBMC与N+NS组脑组织内NeuN+活性Caspase-3+DAPI+细胞数差异无统计学意义,提示UCBMC并不导致神经元的凋亡;而HIBD+UCBMC组脑组织的NeuN+活性Caspase-3+DAPI+细胞数少于HIBD+NS组,但仍高于N+NS及N+UCBMC组,提示UCBMC侧脑室移植可以减轻神经元凋亡,但其疗效有待于进一步提高。
为了进一步研究UCBMC移植对HIBD新生大鼠保护作用的机制,本研究采用TUNEL法检测UCBMC移植对HIBD新生大鼠的影响,结果表明HIBD+NS组脑组织TUNEL+DAPI+细胞数高于N+NS组,进一步证明细胞凋亡是新生大鼠HIBD的重要原因;而HIBD+UCBMC组大鼠脑组织TUNEL+DAPI+细胞数少于HIBD+NS组,提示UCBMC移植可减轻HIBD新生大鼠脑组织神经细胞凋亡,与NeuN/活性Caspase-3双重免疫荧光染色结果一致。
细胞凋亡是HIBD新生大鼠神经细胞死亡的重要形式,而细胞凋亡受多种基因的调控,其中Bcl-2家族与神经细胞凋亡的调控密切相关[9-10]。Bcl-2家族成员中,Bcl-2是重要的凋亡抑制基因之一,可稳定线粒体膜,抑制Cyto-c从线粒体向胞浆流动及Capase-3的激活,从而抑制凋亡;而Bax是促凋亡基因,Bcl-2和Bax的比例可决定细胞对凋亡信号的敏感性,调节凋亡的发生,即Bcl-2蛋白表达占优势时抑制凋亡,Bax蛋白表达占优势时促进凋亡[11-12],因此,如果能调控Bcl-2家族的抑凋亡基因与促凋亡基因对于凋亡的调控具有重要意义。本研究发现HIBD新生大鼠的损伤侧脑组织Bax蛋白表达增加,而Bcl-2蛋白表达水平较低,而且该侧脑组织的TUNEL阳性细胞及神经元活性Caspase-3阳性细胞表达增加,提示HIBD可通过促进Bax蛋白的表达,促进新生大鼠脑内神经元的凋亡;而HIBD+UCBMC组Bcl-2蛋白高于HIBD+NS组、Bax蛋白表达则低于HIBD+NS组,提示UCBMC移植可通过促进Bcl-2蛋白表达、抑制Bax蛋白表达,从而减轻HIBD新生大鼠脑内神经细胞的凋亡。但本研究HIBD+UCBMC组的脑组织神经元凋亡仍高于N+NS及N+UCBMC组,是否可能通过增加UCBMC移植的细胞数量或者次数以进一步调控Bcl-2和Bax,进而进一步减轻HIBD脑组织神经元的凋亡,有待于进一步研究。有报道人脐带血细胞移植治疗大鼠缺血性脑卒中的疗效与移植细胞数相关[13]。UCBMC移植的临床应用还存在许多有待解决的问题,首先要达到治疗效果所需的细胞数量尚无明确的标准,亦尚未得到临床验证。此外,新生儿HIBD为弥漫性脑损伤,常需多点多次立体定位注射,可能因此造成新的损伤。相信随着移植技术的改进,细胞移植治疗的深入研究,有望促进UCBMC移植的临床转换。
总之,HIBD新生大鼠UCBMC侧脑室移植可通过上调Bcl-2蛋白、下调Bax蛋白,减轻神经元及神经细胞的凋亡,从而减轻脑损伤。
| [1] | Gill MB, Bockhorst K, Narayana P, et al. Bax shuttling after neonatal hypoxia-ischemia:hyperoxia effects[J]. J Neurosci Res , 2008, 86 (16) : 3584–3604. DOI:10.1002/jnr.v86:16 |
| [2] | Northington FJ, Chavez-Valdez R, Martin LJ. Neuronal cell death in neonatal hypoxia-ischemia[J]. Ann Neurol , 2011, 69 (5) : 743–758. DOI:10.1002/ana.v69.5 |
| [3] | Rosenkranz K, Kumbruch S, Tenbusch M, et al. Transplantation of human umbilical cord blood cells mediated beneficial effects on apoptosis, angiogenesis and neuronal survival after hypoxicischemic brain injury in rats[J]. Cell Tissue Res , 2012, 348 (3) : 429–438. DOI:10.1007/s00441-012-1401-0 |
| [4] | Wang XL, Zhao YS, Hu MY, et al. Umbilical cord blood cells regulate endogenous neural stem cell proliferation via hedgehog signaling in hypoxic ischemic neonatal rats[J]. Brain Res , 2013, 1518 : 26–35. DOI:10.1016/j.brainres.2013.04.038 |
| [5] | 胡明英, 邓进巍, 王晓莉. 脐血单个核细胞移植后缺氧缺血性脑损伤新生鼠组织学及远期行为学的改善[J]. 中国组织工程研究与临床康复 , 2008, 12 (34) : 6648–6652. |
| [6] | Rice JE 3rd, Vannucci RC, Brierley JB. The influence of immaturity on hypoxic-ischemic brain damage in the rat[J]. Ann Neurol , 1981, 9 (2) : 131–141. DOI:10.1002/(ISSN)1531-8249 |
| [7] | El-Badri NS, Hakki A, Saporta S, et al. Cord blood mesenchymal stem cells:Potential use in neurological disorders[J]. Stem Cells Dev , 2006, 15 (4) : 497–506. DOI:10.1089/scd.2006.15.497 |
| [8] | Buzańska L, Jurga M, Stachowiak EK, et al. Neural stem-like cell line derived from a nonhematopoietic population of human umbilical cord blood[J]. Stem Cells Dev , 2006, 15 (3) : 391–406. DOI:10.1089/scd.2006.15.391 |
| [9] | Zhang H, Li Q, Li Z, et al. The protection of Bcl-2 overexpression on rat cortical neuronal injury caused by analogous ischemia/reperfusion in vitro[J]. Neurosci Res , 2008, 62 (2) : 140–146. DOI:10.1016/j.neures.2008.07.002 |
| [10] | Liu W, Yue W, Wu R. Overexpression of Bcl-2 promotes survival and differentiation of neuroepithelial stem cells after transplantation into rat aganglionic colon[J]. Stem Cell Res Ther , 2013, 4 (1) : 7. DOI:10.1186/scrt155 |
| [11] | Wang YC, Feng GY, Xia QJ, et al. Knockdown of α-synuclein in cerebral cortex improves neural behavior associated with apoptotic inhibition and neurotrophin expression in spinal cord transected rats[J]. Apoptosis , 2016, 21 (4) : 404–420. DOI:10.1007/s10495-016-1218-5 |
| [12] | Yin F, Guo L, Meng CY, et al. Transplantation of mesenchymal stem cells exerts anti-apoptotic effects in adult rats after spinal cord ischemia-reperfusion injury[J]. Brain Res , 2014, 1561 : 1–10. DOI:10.1016/j.brainres.2014.02.047 |
| [13] | Vendrame M, Cassady J, Newcomb J, et al. Infusion of human umbilical cord blood cells in a rat model of stroke dosedependently rescues behavioral deficits and reduces infarct volume[J]. Stroke , 2004, 35 (10) : 2390–2395. DOI:10.1161/01.STR.0000141681.06735.9b |
 2016, Vol. 18
2016, Vol. 18


