支气管肺发育不良(bronchopulmonary dysplasia, BPD)是威胁早产儿,特别是小早产儿生存及生活质量的常见呼吸系统疾病。高浓度氧治疗是早产儿BPD主要原因之一[1],但具体发病机制尚不十分清楚。肺泡Ⅱ型上皮细胞(type Ⅱ alveolar epithelial cell, AECⅡ)是肺内主要干细胞,研究发现[2],AECⅡ高氧损伤及凋亡在BPD形成中起重要作用。AECⅡ内质网丰富,具有发生内质网应激(endoplasmic reticulum stress, ERS)的结构基础。内质网应激相关凋亡是近年研究热点,与多种肺部疾病有关[3-4]。我们前期利用早产大鼠BPD模型研究已发现[5],高氧暴露后早产大鼠肺组织C/EBP同源蛋白(CHOP)表达明显增高,CHOP途径参与BPD中肺细胞凋亡。需肌醇酶1(inositol-requiring kinase 1, IRE1)是ERS感受信号之一,ERS状态下IRE1剪切X盒结合蛋白1(X-box binding protein-1, XBP1)前体mRNA生成编码XBP1s的mRNA,XBP1s可诱导下游ERS特异CHOP凋亡蛋白表达。已有研究指出[6],IRE1-XBP1-CHOP途径与非小细胞肺癌细胞凋亡密切相关。而IRE1-XBP1-CHOP途径与AECⅡ凋亡的关系目前研究甚少。本实验拟建立原代培养早产大鼠AECⅡ细胞高氧损伤模型,进一步从细胞层面探讨IRE1-XBP1-CHOP通路是否与AECⅡ凋亡相关。
1 材料与方法 1.1 材料IV胶原酶(Sigma公司,美国);D/F12培养基(Hyclone公司,美国);胰蛋白酶(Invitrogen公司,美国);胎牛血清(Serpro公司,德国);双抗(Invitrogen公司,美国);SDS-PAGE配胶试剂盒(长沙艾佳生物技术有限公司);TRIzol(Invitrogen公司,美国);Prime-Script RT reagent Kit试剂盒、SYBR Premix Ex TaqTM试剂盒(TaKaRa公司,日本);兔抗大鼠β-actin、葡萄糖调节蛋白78(GRP78)、IRE1、XBP1s及CHOP单克隆抗体(CST公司,美国);辣根过氧化物酶标记山羊抗兔IgG(CST公司,美国);山羊抗兔IgG、FITC(北京康为世纪生物技术有限公司);FITC AnnexinV/PI流式试剂盒(BD公司,美国);ECL(Millipore公司,美国);引物由上海生工生物工程公司设计及合成(表 1);CYS-1数字式测氧仪(上海嘉定学联仪表厂)。
| 表 1 引物序列 |
1.2 AECⅡ高氧损伤模型建立及分组
雌性清洁级Sprague-Dawley(SD)大鼠,体重200~220 g,雄性清洁级SD大鼠,体重220~250 g,由江苏大学实验动物中心提供。SD雌雄鼠按3:1合笼交配,次日晨取雌鼠阴道分泌物涂片,镜检见精子,当日记为妊娠第1天。孕19~20 d SD大鼠,无菌条件下剖腹取出胎鼠,并取胎鼠肺组织进行AECⅡ原代培养,按前期已报道方法进行[7]。AECⅡ接种15 h贴壁后,更换培养液并随机分为空气组和高氧组。高氧组按3 L/min通入95% O2+5% CO2 10 min,置于37℃、5% CO2培养箱中培养,空气组直接置于37℃、5% CO2培养箱中培养。每隔24 h更换培养液,高氧组重复以上操作。分别于给氧后24、48及72 h收获各组细胞,CYS-1数字式测氧仪检测培养瓶中O2浓度,低于900 mL/L O2浓度标本舍弃。
1.3 倒置相差显微镜观察AECⅡ形态变化在各时间点吸弃各组培养基,以PBS液洗涤细胞2遍,倒置相差显微镜观察细胞形态变化。
1.4 Annexin V/PI双染流式细胞术检测细胞凋亡每组分别在24、48及72 h,各取8瓶细胞,吸弃培养基,以PBS液洗涤细胞2遍,用不含EDTA胰酶消化,每瓶细胞平均分3份收集于EP管中。严格按照FITC Annexin V/PI流式试剂盒说明处理细胞。处理后1 h内用Accuri C6流式机(BD公司,美国)检测各样本细胞凋亡率。
1.5 RT-PCR检测相关因子mRNA表达每组分别在24、48及72 h,各取8瓶细胞,TRIzol试剂提取AECⅡ总RNA,紫外分光光度计(Thermo公司,美国)测定RNA纯度和含量,严格按照试剂盒说明书反转录合成cDNA,将每个样本平均分成3份在PCR扩增仪(Roche公司,美国)上进行扩增。PCR反应体系:12.5 μL SYBR Premix Ex TaqTM;PCR上下游引物(10 μM)各0.5 μL;0.5 μL ROX Reference Dye Ⅱ(×50);2.0 μL DNA模板;9.0 μL ddH2O;合计25 μL。PCR反应条件:95℃ 30 s;95℃ 5 s,60℃ 30 s,40个循环。以β-actin为内参照,采用2-△CT相对定量法进行分析。
1.6 Western blot检测相关因子蛋白表达每组分别在24、48及72 h,各收集8瓶细胞,Ripa裂解液(含PMSF)提取各组细胞总蛋白。按每泳道取20 μg总蛋白进行SDS-PAGE凝胶电泳,湿式电转移至PVDF膜上,5%脱脂奶粉37℃封闭1 h后,以兔抗大鼠β-actin、GRP78、IRE1、XBP1s及CHOP IgG(1:1 000)4℃孵育过夜。第2天洗膜后,以辣根过氧化物酶标记的山羊抗兔单克隆IgG(1:5 000)孵育1 h,ECL化学发光显色。每次跑胶重复上样3次,GDS-8000型凝胶成像分析系统扫描并分析。以目的蛋白与β-actin条带积分吸光度的比值表示目的基因的相对表达水平。
1.7 CHOP免疫荧光检测各时间点各组样本以PBS液洗涤3遍,4%多聚甲醛固定20 min,0.5% Triton通透化30 min,37℃封闭1 h,以兔抗大鼠CHOP IgG(1:200)4℃孵育过夜。第2天以FITC标记山羊抗兔IgG(1:300)37℃避光孵育1 h。DAPI染核2 min后荧光显微镜(Olympus公司,日本)观察拍照。
1.8 统计学分析采用SPSS 18.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,两组样本间比较采用t检验;组内各时间点比较采用单因素方差分析,两两时间点比较采用SNK-q检验;两样本间相关性采用Pearson相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 AECⅡ形态变化空气组AECⅡ在24、48及72 h略呈梭形,细胞贴壁呈岛状生长,细胞饱满。高氧暴露24 h,AECⅡ颜色变暗,细胞内出现细小点状颗粒,部分细胞变小变圆;48 h后,细胞伸展呈不规则形,胞内点状颗粒增多,部分细胞漂浮于培养基中;72 h后,细胞形态更不规则,细胞颜色变暗,部分细胞呈空泡化改变,漂浮于培养基中的死细胞更多。
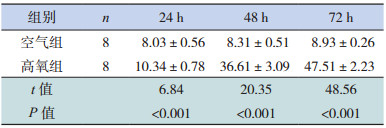
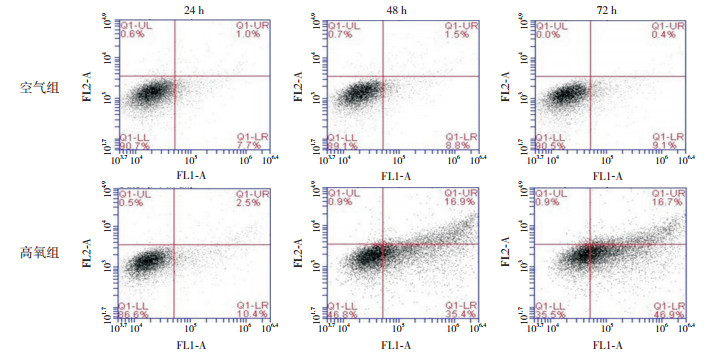
2.2 AECⅡ凋亡变化Annexin V/PI双染流式细胞术检测各时间点各组AECⅡ凋亡情况,结果表明,各时间点空气组AECⅡ早期凋亡率均较低,而高氧组AECⅡ早期凋亡率明显增加,与同时间点空气组相比差异均有统计学意义(P < 0.05)。见表 2及图 1。
| 表 2 空气组和高氧组AECII凋亡率比较(x±s,%) |
|
图 1 Annexin V/PI双染流式细胞术检测AECⅡ凋亡左上象限代表机械损伤细胞,左下象限代表正常细胞,右下象限代表早期凋亡细胞,右上象限代表晚期凋亡细胞。24、48及72 h,空气组早期凋亡率均较低,同时间点高氧组早期凋亡率均明显增加。 |
2.3 ERS相关因子mRNA表达变化
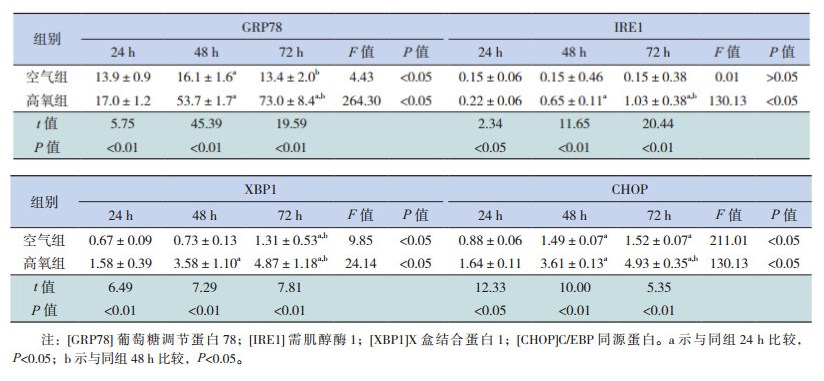
实时荧光定量PCR结果表明,各时间点空气组GRP78、IRE1、XBP1及CHOP mRNA表达量均较低;GRP78、IRE1、XBP1及CHOP mRNA表达随高氧暴露时间延长,表达量呈逐渐增高趋势(P < 0.05),且与同时间点空气组比较均增高,差异有统计学意义(P < 0.05)。见表 3。
| 表 3 两组各时间点ERS相关因子mRNA表达比较(×10-3,x±s,n=8) |
2.4 ERS相关因子蛋白表达变化
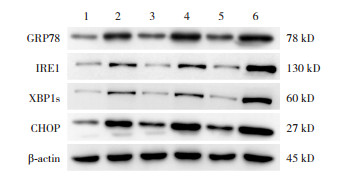
Western blot结果表明,随着高氧暴露时间延长,高氧组GRP78、IRE1、XBP1s、CHOP蛋白表达呈逐渐上升趋势(P < 0.05);与同时间点空气组相比升高明显,差异具有统计学意义(P < 0.05)。见图 2及表 4。
|
图 2 Western blot检测ERS相关因子蛋白表达1:空气组24 h;2:高氧组24 h;3:空气组48 h;4:高氧组48 h;5:空气组72 h;6:高氧组72 h。[GRP78]葡萄糖调节蛋白78;[IRE1]需肌醇酶1;[XBP1]X盒结合蛋白1;[CHOP]C/EBP同源蛋白。 |
| 表 4 两组各时间点ERS相关因子蛋白表达比较(x±s,n=8) |
2.5 CHOP免疫荧光变化
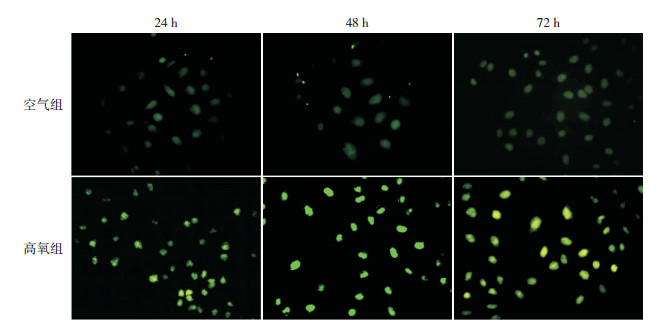
免疫荧光显示CHOP定位于AECⅡ细胞核内。在24、48及72 h,空气组荧光强度较弱,CHOP表达量较少;而在各时间点高氧组,荧光强度增强,CHOP表达量增多。见图 3。
|
图 3 免疫荧光检测CHOP表达(免疫荧光,×400)CHOP呈绿色荧光。24、48及72 h,空气组荧光强度较弱,CHOP表达较少;同时间点高氧组,荧光强度增强,CHOP表达增多。 |
2.6 相关性分析
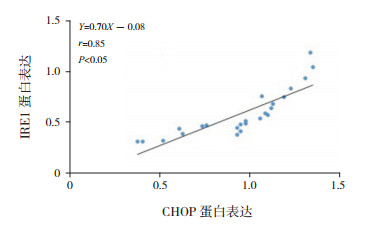
高氧组AECⅡ CHOP蛋白表达与AECⅡ凋亡率、IRE1及XBP1s蛋白表达均呈显著正相关(r=0.97、0.85、0.88,均P < 0.05),见图 4~6。

|
图 4 CHOP蛋白表达与AECII凋亡率相关分析图 |
|
图 5 CHOP蛋白表达与IRE1蛋白表达相关分析图 |

|
图 6 CHOP蛋白表达与XBP1蛋白表达相关分析图 |
3 讨论
AECⅡ是肺内主要干细胞。Hou等[8]利用新生大鼠BPD模型及原代培养AECⅡ研究发现,高氧暴露后,BPD组大鼠肺泡间隔中断增多,高氧组AECⅡ凋亡及转分化较对照组明显增加。本实验研究结果显示,高氧暴露后,AECⅡ出现了颜色变暗、细胞伸展,细胞中出现细小颗粒并有空泡化改变,漂浮细胞增多等改变。Annexin V/PI双染流式细胞术结果表明,空气组AECⅡ凋亡率较低,而高氧组AECⅡ凋亡率较同时间点空气组明显增加,说明高氧使AECⅡ发生了形态改变并诱导AECⅡ凋亡增加。
ERS相关凋亡是新近研究发现的非经典凋亡途径,AECⅡ含有大量板层小体和粗面内质网,具有发生ERS的基础。正常情况下,GRP78与跨膜蛋白结合以维持内质网稳态,但任何应激破坏内质网稳态,即发生ERS时,GRP78便与跨膜蛋白解离,因此GRP78被认为是ERS标志性蛋白之一[9]。本研究结果显示,高氧组GRP78 mRNA及蛋白表达水平随着给氧时间延长逐渐增高,且显著高于同时间点空气组,说明高氧确实启动了AECⅡ过程。
CHOP是ERS特异的早期凋亡相关转录因子,可阻滞细胞分裂诱导细胞凋亡。CHOP凋亡途径已被证实与多种疾病有关,包括糖尿病,神经退行性疾病,癌症等[10]。有研究表明[11],沉默CHOP基因可改善小鼠肾纤维化,减轻肾细胞凋亡及氧化应激损伤。利用高氧暴露小鼠BPD模型及小鼠肺上皮细胞损伤模型研究发现[12],沉默CHOP基因可使不成熟肺组织损伤后发生重构,出现肺泡化,肺细胞死亡减少。但CHOP凋亡途径与AECⅡ凋亡的关系目前还不十分清楚。在本研究中,CHOP表达于核内,空气组CHOP荧光强度较弱,高氧组CHOP荧光强度较空气组明显增强。空气组CHOP mRNA及蛋白表达均较低,而随着给氧时间延长,CHOP mRNA及蛋白表达均呈逐渐上升趋势,与同时间点空气组比较,增加明显,且CHOP表达与细胞凋亡率呈显著正相关。以上结果进一步从细胞层面说明,高氧可激活CHOP途径并参与AECⅡ凋亡,但是沉默CHOP基因是否能抑制AECⅡ凋亡仍需进一步研究。
ERS有三条跨膜感受器,均可诱导CHOP表达。IRE1是内质网跨膜蛋白之一,与GRP78解离后发生自身寡聚化和磷酸化,同时激活自身核糖核酸内切酶活性,剪切XBP1前体mRNA生成能编码XBP1s的mRNA,XBP1s具有转录活性,可激活CHOP凋亡途径。IRE1通路对于细胞的生存和凋亡,发挥重要调控作用,并已被证实与多种疾病相关,包括糖尿病、癌症等[13]。van Schadewijk等[14]利用毒胡萝卜素诱导肺上皮细胞ERS,研究发现,XBP1在发生ERS的肺上皮细胞中表达明显增高,且和GRP78、CHOP表达呈显著正相关。本实验研究发现,空气组IRE1及XBP1表达均较低,随着给氧时间延长,高氧组IRE1及XBP1 mRNA及蛋白表达逐渐上升,且与同时间点空气组比较差异有统计学意义。IRE1、XBP1s蛋白表达均与CHOP蛋白表达呈显著正相关,说明高氧启动了AECⅡ中IRE1-XBP1-CHOP通路,且很可能与AECⅡ凋亡密切相关。Ghosh等[15]利用大量细胞和动物ERS模型研究发现,抑制IRE1通路可缓解ERS,拮抗细胞凋亡,保护细胞生理功能。因此推测,在高氧所致AECⅡ凋亡过程中抑制IRE1通路可能对AECⅡ具有保护作用。
综上所述,高氧激活了ERS相关的IRE1-XBP1-CHOP途径,并参与AECⅡ凋亡。应用基因敲除技术或拮抗剂抑制CHOP功能,或调控IRE1-XBP1-CHOP途径,对于高氧所致AECⅡ损伤是否具有保护作用仍有待进一步研究。
| [1] | Balany J, Bhandari V. Understanding the impact of infection, inflammation, and their persistence in the pathogenesis of bronchopulmonary dysplasia[J]. Front Med (Lausanne) , 2015, 2 : 90. |
| [2] | Jin L, Yang H, Fu J, et al. Association between oxidative DNA damage and the expression of 8-oxoguanine DNA glycosylase 1 in lung epithelial cells of neonatal rats exposed to hyperoxia[J]. Mol Med Rep , 2015, 11 (6) : 4079–4086. |
| [3] | Kim SR, Lee YC. Endoplasmic reticulum stress and the related signaling networks in severe asthma[J]. Allergy Asthma Immunol Res , 2015, 7 (2) : 106–117. DOI:10.4168/aair.2015.7.2.106 |
| [4] | Koyama M, Furuhashi M, Ishimura S, et al. Reduction of endoplasmic reticulum stress by 4-phenylbutyric acid prevents the development of hypoxia-induced pulmonary arterial hypertension[J]. Am J Physiol Heart Circ Physiol , 2014, 306 (9) : H1314–H1323. DOI:10.1152/ajpheart.00869.2013 |
| [5] | Lu HY, Zhang J, Wang QX, et al. Activation of the endoplasmic reticulum stress pathway involving CHOP in the lungs of rats with hyperoxia-induced bronchopulmonary dysplasia[J]. Mol Med Rep , 2015, 12 (3) : 4494–4500. |
| [6] | Wang LL, Hu RC, Dai AG, et al. Bevacizumab induces A549 cell apoptosis through the mechanism of endoplasmic reticulum stress in vitro[J]. Int J Clin Exp Pathol , 2015, 8 (5) : 5291–5299. |
| [7] | 卢红艳, 常立文, 汪鸿, 等. 高氧对早产大鼠Ⅱ型肺泡上皮细胞转分化的影响[J]. 细胞与分子免疫学杂志 , 2006, 22 (6) : 706–709. |
| [8] | Hou A, Fu J, Yang H, et al. Hyperoxia stimulates the transdifferentiation of type Ⅱ alveolar epithelial cells in newborn rats[J]. Am J Physiol Lung Cell Mol Physiol , 2015, 308 (9) : L861–L872. DOI:10.1152/ajplung.00099.2014 |
| [9] | Feng J, Chen X, Sun X, et al. Expression of endoplasmic reticulum stress markers GRP78 and CHOP induced by oxidative stress in blue light-mediated damage of A2Econtaining retinal pigment epithelium cells[J]. Ophthalmic Res , 2014, 52 (4) : 224–233. DOI:10.1159/000363387 |
| [10] | Oyadomari S, Mori M. Roles of CHOP/GADD153 in endoplasmic reticulum stress[J]. Cell Death Differ , 2004, 11 (4) : 381–389. DOI:10.1038/sj.cdd.4401373 |
| [11] | Liu SH, Wu CT, Huang KH, et al. C/EBP homologous protein (CHOP) deficiency ameliorates renal fibrosis in unilateral ureteral obstructive kidney disease[J]. Oncotarget , 2016, 7 (16) : 21900–21912. |
| [12] | Choo-Wing R, Syed MA, Harijith A, et al. Hyperoxia and interferon-γ-induced injury in developing lungs occur via cyclooxygenase-2 and the endoplasmic reticulum stressdependent pathway[J]. Am J Respir Cell Mol Biol , 2013, 48 (6) : 749–757. DOI:10.1165/rcmb.2012-0381OC |
| [13] | Hetz C, Martinon F, Rodriguez D, et al. The unfolded protein response:integrating stress signals through the stress sensor IRE1α[J]. Physiol Rev , 2011, 91 (4) : 1219–1243. DOI:10.1152/physrev.00001.2011 |
| [14] | van Schadewijk A, van't Wout EF, Stolk J, et al. A quantitative method for detection of spliced X-box binding protein-1(XBP1) mRNA as a measure of endoplasmic reticulum (ER) stress[J]. Cell Stress Chaperones , 2012, 17 (2) : 275–279. DOI:10.1007/s12192-011-0306-2 |
| [15] | Ghosh R, Wang L, Wang ES, et al. Allosteric inhibition of the IRE1α RNase preserves cell viability and function during endoplasmic reticulum stress[J]. Cell , 2014, 158 (3) : 534–548. DOI:10.1016/j.cell.2014.07.002 |
 2016, Vol. 18
2016, Vol. 18