哮喘是儿童最常见的呼吸道慢性病之一,发病率呈逐年上升的趋势[1],但发病机制尚不完全明确,目前认为其可能是由多种机制共同参与引起的疾病。瞬时电位感受器香草酸受体(transient receptor potential vanilloid, TRPV)是瞬时受体电位离子通道的亚家族之一,在哺乳动物呼吸系统中有着较广泛的表达,其中包括气管平滑肌细胞、气管感觉神经、肺血管内皮细胞、炎症细胞等[2]。TRPV可以被多种细胞内外刺激因子激活,活化后可诱发细胞的钙内流,进而诱发病理状态下呼吸系统的功能调控。近年来,越来越多的研究表明,TRPV1可能是参与诱发儿童哮喘的重要调控信号分子[3]。
为进一步阐明TRPV1在哮喘气道炎症中的作用,本实验通过构建哮喘小鼠模型,研究TRPV1通道激活剂辣椒素和通道抑制剂辣椒平干预下小鼠气道炎症程度及相关炎性介质分泌水平。
1 材料与方法 1.1 动物模型构建与分组选取清洁级雌性BALB/c小鼠25只,6~8周龄,体重16±2 g,进行1周适应性饲养,随机平均分为正常对照组、哮喘组、辣椒素干预组、辣椒平干预组、地塞米松干预组,每组5只。参考文献[4]制作哮喘动物模型。除正常对照组外,其余各组小鼠于第1、8、15天腹腔注射卵清蛋白(OVA)-氢氧化铝混合液致敏(100 μg/只),第22天起各组小鼠每日给予OVA生理盐水(1%)超声雾化吸入激发哮喘,每次30 min,持续7 d。正常对照组致敏和激发过程用生理盐水替代。辣椒素干预组、辣椒平干预组和地塞米松组分别在每次激发前30 min腹腔注射辣椒素(30 μg/kg)、辣椒平(10 μmol/kg)及地塞米松(2 mg/kg)。在实验第28天时,于最后1次激发小鼠24 h后进行样品采集。
1.2 小鼠肺泡灌洗液中IL-8和IL-13的测定采用1 mL注射器头做气管插管,沿气管走向插入,用1 mL注射器吸取约0.6 mL DEPC水,经插管缓慢注入到肺内,缓慢吸出液体,重复冲洗步骤3次,回收率 > 80%视为灌洗操作成功。ELISA法测定肺泡灌洗液(BALF)中IL-13和IL-8水平。
1.3 肺组织苏木精-伊红染色取完整的左部肺叶,用DEPC水洗去黏附的血液。将肺叶抽吸固定后浸于4%多聚甲醛溶液中固定24 h后取出充分水洗。用乙醇溶液作为脱水剂,依次脱去肺组织中的水分,将脱水后肺组织置于透明剂二甲苯中透明。组织修块后浸蜡包埋,脱蜡后行苏木精-伊红(HE)染色,光镜下观察肺组织炎症浸润情况。
1.4 Real-Time PCR法检测TRPV1 mRNA的表达水平取完整的右部肺叶,用DEPC水洗去黏附的血液,TRIzol法抽提肺组织总RNA,逆转录合成cDNA。所有引物由Takara公司设计合成。TRPV1上游引物:5'-GACCTGTCCTGCATTGACACC-3',下游引物:5'-ACAAATCTGTCCCACTTGTCCTG-3',片段长度:143 bp;内参β-actin上游引物:5'-CATCCGTAAAGACCTCTATGCCAAC-3',下游引物:5'-ATGGAGCCACCGATCCACA-3',片段长度:171 bp。PCR反应体系(20 μL):SYBR Premix Ex Taq 10 μL,上下游引物各1 μL,cDNA 1.5 μL,灭菌水6.5 μL。PCR反应条件:95℃预变性30 s;95℃变性5 s,55℃退火30 s,72℃延伸30 s,共进行40个循环;最后72℃延伸10 min。经DioRad.iQ5分析软件分析,目的基因的相对表达量以2-△△Ct表示,其中△Ct=目的基因Ct-内参基因Ct,△△Ct=各处理组△Ct-对照组△Ct。实验独立重复3次。
1.5 统计学分析采用SPSS 13.0软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
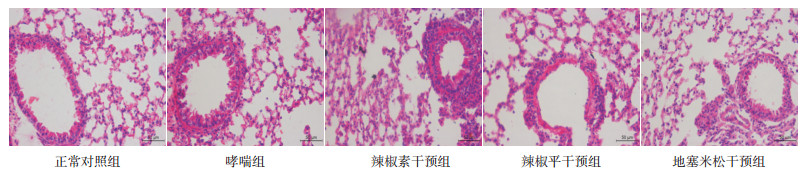
2 结果 2.1 各组小鼠临床表现及肺组织病理学变化哮喘组小鼠雾化激发后出现烦躁不安、呼吸急促、抓耳抓鼻、腹肌强直等表现,多次激发后出现精神差,活动减少;辣椒素干预组上述症状明显;辣椒平干预组喘息症状轻,与地塞米松组表现类似。HE染色结果显示与哮喘组比较,辣椒平干预组和地塞米松干预组肺部炎症程度轻,辣椒素干预组肺部炎症程度明显加重(图 1)。
|
图 1 各组小鼠肺组织HE染色结果(×40)哮喘组小鼠气道黏膜水肿明显,气道黏膜层、黏膜下层以及血管周围组织可见大量炎性细胞浸润,以淋巴细胞和嗜酸性粒细胞浸润为主,气道平滑肌增厚。辣椒素干预组较哮喘组气道平滑肌增厚明显。辣椒平干预组上述症状较轻,与地塞米松干预组表现相似。 |
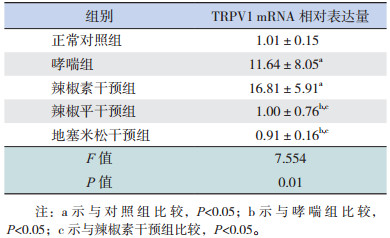
2.2 各组小鼠肺组织TRPV1 mRNA的表达
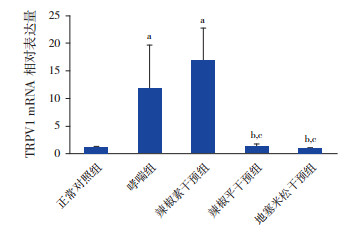
哮喘组、辣椒素干预组与正常对照组比较,TRPV1 mRNA表达明显增加(P < 0.05)。辣椒平干预组、地塞米松干预组分别与哮喘组和辣椒素干预组比较,TRPV1 mRNA表达明显降低(P < 0.05)。辣椒素干预组与哮喘组比较,TRPV1 mRNA表达增加,但差异无统计学意义(P > 0.05)。见表 1,图 2。
| 表 1 各组小鼠肺组织TRPV1 mRNA相对表达量比较(x±s,n=5 |
|
图 2 Real-Time PCR检测各组小鼠肺组织TRPV1 mRNA相对表达量(n=5)a示与对照组比较,P < 0.05;b示与哮喘组比较,P < 0.05;c示与辣椒素干预组比较,P < 0.05。 |
2.3 各组小鼠BALF中IL-13和IL-8水平
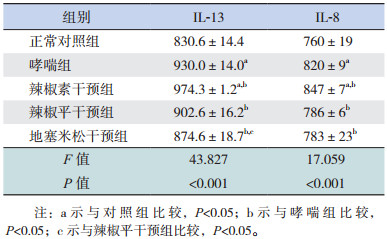
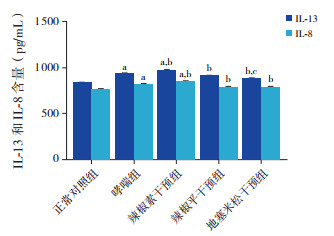
哮喘组、辣椒素干预组与正常对照组比较,IL-13、IL-8含量明显增加(P < 0.05)。辣椒平干预组、地塞米松干预组与哮喘组比较,IL-13、IL-8含量明显降低(P < 0.05)。辣椒素干预组与哮喘组比较,IL-13、IL-8含量明显增加(P < 0.05)。地塞米松干预组与辣椒平干预组比较,IL-13含量明显降低(P < 0.05)。见表 2,图 3。
| 表 2 各组小鼠BALF中IL-13和IL-8含量比较(x±s,pg/mL,n=5) |
|
图 3 ELISA法检测各组小鼠BALF中IL-13和IL-8含量(n=5)a示与对照组比较,P < 0.05;b示与哮喘组比较,P < 0.05;c示与辣椒平干预组比较,P < 0.05。 |
3 讨论
哮喘是一种慢性气道炎症性疾病,儿童发病率逐年上升。哮喘的发病机制尚不明确,目前认为其发生与发展主要由环境因素和遗传因素共同作用所致。TRPV是普遍存在于机体各种细胞中的一类通道蛋白,包含6个成员:TRPV1~6,具有介导感觉传导、参与细胞信号传导及调节发育等重要作用,其调节机制各异,涉及功能广泛,参与多种疾病的病理、生理过程。
TRPV1广泛表达于神经组织和非神经细胞中,在呼吸系统也有较为广泛的表达。TRPV1已被证实涉及人类疾病状态下有害刺激因素的超敏反应过程[5],TRPV1-1585V位点多态性与儿童哮喘的发生有关,有研究显示TRPV1-1585V基因变异细胞在典型的TRPV1刺激物(温度和辣椒素)的触发下通道的敏感性降低,TRPV1基因通过调节细胞内钙离子浓度在哮喘发病中起到作用[6]。本研究选用TRPV1通道激活剂辣椒素和通道抑制剂辣椒平为激发剂,比较哮喘模型小鼠气道炎症和炎性介质水平,以期进一步阐明TRPV1通道在哮喘发病机制中的作用。
本研究通过单纯OVA-氢氧化铝混合液激发构建哮喘小鼠模型,其气道嗜酸性粒细胞浸润严重,支气管及小血管周围还可见淋巴细胞浸润,支气管黏膜杯状细胞增多,管腔内见大量分泌物。气道重塑是慢性或重症哮喘患者典型的病理变化。本研究通过辣椒素激发,小鼠的细支气管和叶支气管均发生了气道重塑,HE染色可见气道上皮脱落及折叠、基质增加、气道平滑肌细胞肥大增生、黏液分泌增加,成功构建了重症哮喘小鼠模型。经地塞米松、辣椒平处理的小鼠与哮喘组小鼠相比,辣椒平组小鼠肺部病理改变较轻,局部的炎症细胞浸润少,气道上皮损伤轻,提示辣椒平类似地塞米松,可减轻哮喘小鼠肺部变应性炎症。
IL-8是趋化因子超家族中的一员(CXCL亚家族),又名中性粒细胞趋化因子,是哮喘气道炎症的上调因子,对多种炎症细胞具有趋化作用,可趋化免疫反应中炎性细胞的聚集,并激活嗜酸性粒细胞。部分研究发现IL-8水平与哮喘的严重程度有关,并认为IL-8在重症哮喘和激素不敏感哮喘中起到重要作用,可作为哮喘气道炎症程度及病情变化的指标[7]。此外,IL-8被认为是一个可以引发和维持神经元反应的炎性介质[8]。IL-13是一种具有多效性的免疫调节功能的细胞因子,主要由Th2细胞分泌产生,能延长嗜酸性粒细胞的存活时间,并诱导其他细胞因子协同刺激促进肺部大量嗜酸性粒细胞的浸润[9]。IL-13还可以通过刺激上皮生长因子受体,活化中性粒细胞,诱导杯状细胞分泌黏液。重症哮喘患者常发生小气道结构重塑,IL-13是导致支气管上皮下纤维化的最为关键的细胞因子[10]。
本研究发现,哮喘组小鼠BALF中IL-8、IL-13的水平显著高于正常对照组,经辣椒素处理后BALF中的IL-8、IL-13水平显著增高,表明辣椒素可以加重哮喘的炎症程度。IL-8被认为是神经源性炎症的重要细胞因子,IL-13是哮喘免疫反应的重要炎症介质,两者的水平增加,提示哮喘的发病机制中可能存在神经源性炎症和免疫源性炎症的交互作用。经辣椒平干预后,BALF中IL-13、IL-8显著降低,表明辣椒平可以抑制两者的合成和分泌,其作用效果与哮喘的经典治疗药物地塞米松相似。
本研究中辣椒平组肺部炎症较轻,其肺组织TRPV1 mRNA表达低于哮喘组,差异有统计学意义,说明辣椒平干预能够抑制TRPV1表达,而TRPV1通道的表达下调可以减轻哮喘的气道炎症。另一方面,地塞米松干预后TRPV1 mRNA表达下调,提示地塞米松除已知的抗炎途径外,还可能通过降低TRPV1表达水平在哮喘的治疗中发挥作用。
TRPV1通道激活剂辣椒素可加重哮喘小鼠肺部病理改变,提高BALF中IL-8、IL-13水平,而TRPV1通道抑制剂辣椒平则减轻哮喘小鼠肺部病理改变,降低BALF中IL-8、IL-13水平,提示TRPV1通道活性影响了哮喘气道炎症严重度,在哮喘的发病中起到一定作用。另外,TRPV1通道表达水平与哮喘的气道炎症严重度密切相关。针对TRPV1通道的研究可能是哮喘药物治疗的新靶点。
| [1] | 全国儿科哮喘协作组, 中国疾病预防控制中心环境与健康相关产品安全所. 第三次中国城市儿童哮喘流行病学调查[J]. 中华儿科杂志 , 2013, 51 (10) : 729–735. |
| [2] | Zholos AV. TRP channels in respiratory pathophysiology:the role of oxidative, chemical irritant and temperature stimuli[J]. Curr Neuropharmacol , 2015, 13 (2) : 279–291. DOI:10.2174/1570159X13666150331223118 |
| [3] | Chen CL, Li H, Xing XH, et al. Effect of TRPV1 gene mutation on bronchial asthma in children before and after treatment[J]. Allergy Asthma Proc , 2015, 36 (2) : e29–e36. DOI:10.2500/aap.2015.36.3828 |
| [4] | Locke NR, Royce SG, Wainewright JS, et al. Comparison of airway remodeling in acute, subacute, and chronic models of allergic airways disease[J]. Am J Respir Cell Mol Biol , 2007, 36 (5) : 625–632. DOI:10.1165/rcmb.2006-0083OC |
| [5] | Delescluse I, Mace H, Adcock JJ. Inhibition of airway hyperresponsiveness by TRPV1 antagonists (SB-705498 and PF-04065463) in the unanaesthetized ovalbumin-sensitized guinea pig[J]. Br J Pharmacol , 2012, 166 (6) : 1822–1832. DOI:10.1111/j.1476-5381.2012.01891.x |
| [6] | Cantero-Recasens G, Gonzalez JR, Fandos C, et al. Loss of function of transient receptor potential vanilloid 1(TRPV1) genetic variant is associated with lower risk of active childhood asthma[J]. J Biol Chem , 2010, 285 (36) : 27532–27535. DOI:10.1074/jbc.C110.159491 |
| [7] | Ma J, Altomare A, Guarino M, et al. HCl-induced and ATPdependent upregulation of TRPV1 receptor expression and cytokine production by human esophageal epithelial cells[J]. Am J Physiol Gastrointest Liver Physiol , 2012, 303 (5) : G635–G645. DOI:10.1152/ajpgi.00097.2012 |
| [8] | Wang Z, Yang Y, Yang H, et al. NF-κB feedback control of JNK1 activation modulates TRPV1-induced increases in IL-6 and IL-8 release by human corneal epithelial cells[J]. Mol Vis , 2011, 17 : 3137–3146. |
| [9] | Tsilogianni Z, Hillas G, Bakakos P, et al. Sputum interleukin-13 as a biomarker for the evaluation of asthma control[J]. Clin Exp Allergy , 2016, 46 (7) : 923–931. DOI:10.1111/cea.2016.46.issue-7 |
| [10] | Dunn R, Szefler SJ. Severe asthma in pediatric patients. Pathophysiology and unmet needs[J]. Ann Am Thorac Soc , 2016, 13 (Suppl 1) : S103–S104. |
 2016, Vol. 18
2016, Vol. 18