支气管哮喘(简称哮喘)是一种最为常见的慢性呼吸道疾病,严重影响了儿童的生长发育及身体健康。哮喘是由多种细胞参与的气道慢性炎症性疾病,以气道炎症、气道高反应性和气道重塑为主要特征。哮喘发病过程中,嗜酸性粒细胞、嗜中性粒细胞、抗原递呈细胞、Th2淋巴细胞、巨噬细胞及单核细胞等炎症细胞以及气道上皮细胞等体细胞广泛参与并相互作用,从而分泌产生大量的炎性递质和细胞因子,进而导致发生气道炎症和气道高反应性[1]。
髓样细胞触发受体(triggering receptor expressed on myeloid cells, TREM)是一种新型的与炎症相关的免疫球蛋白超家族受体。两个激活受体TREM-1与TREM-2属于人类免疫球蛋白超家族受体成员。有研究报道TREM在炎症反应及天然免疫应答中具有非常重要的作用。在炎症反应中,TREM-1是一种放大炎症的重要介质,能够协同Toll样受体4信号通路扩大炎症。在受到外来刺激比如细菌、真菌及细菌代谢产物脂多糖等,TREM-1的表达显著升高,而且还能够促进炎性因子的分泌[2-3]。与TREM-1促炎性作用相反,TREM-2能够抑制炎症介质的分泌,是一种重要的抗炎受体[4]。有研究表明在脂多糖诱导的急性肺损伤中,乌司他丁能够抑制TREM-1表达和促进TREM-2表达[5]。但是其与支气管哮喘气道炎症和气道重塑间的关系研究甚少,目前尚未报道。本研究拟建立大鼠哮喘模型,观察TREM-2的表达变化及其与哮喘大鼠气道炎症和气道重塑间的关系,以期为阐明哮喘发病机制及寻求新的治疗方法提供思路和依据。
1 材料与方法 1.1 材料卵白蛋白(OVA,美国Sigma公司);氢氧化铝凝胶(美国Sigma公司);IL-4、IL-5、IL-6、IL-10、IL-13、INF-γ和TGF-β1酶联免疫吸附测定(ELISA)试剂盒(美国R & D公司);TREM-2 ELISA试剂盒(上海西唐生物科技有限公司);小鼠IgE试剂盒(上海优宁炜);氯化乙酰胆碱(Ach,美国Sigma公司);TRIzol试剂(美国Invitrogen公司);实时荧光定量PCR(RT-PCR)反应系列试剂(美国Takara公司);PCR引物由上海申能博彩公司合成,PCR产物图像分析软件为Gel-Pro Analyze;兔抗鼠TREM-1多克隆抗体、鼠抗人基质金属蛋白酶2和9(MMP-2和MMP-9)多克隆抗体(Santa Cruz Biotechnology公司);辣根过氧化物酶山羊抗小鼠二抗、GAPDH抗体(上海碧云天生物技术有限公司)。
1.2 实验分组和模型制备将40只6~8周龄SPF级雌性BALB/c小鼠(购自北京维通利华实验动物技术有限公司)随机分为空白对照组、哮喘组、空载体组和TREM-2过表达组,每组10只。模型建立参考文献[6],除空白对照组外,各组小鼠于实验第8天腹腔注射0.1 mL致敏液(含OVA 10 μg,氢氧化铝凝胶50 μg),第14天以相同的剂量和方法重复致敏,第21天开始以1% OVA超声雾化吸入激发,每天30 min,连续14 d。以生理盐水代替OVA处理空白对照组。空载体组和TREM-2过表达组分别在实验第15天单次尾静脉注射2×109 PFU腺病毒空载体和TREM-2腺病毒载体各100 μL。
1.3 样本采集末次激发后2 h,予小鼠10%水合氯醛400 mg/kg腹腔注射麻醉,心脏穿刺取血后于4℃静置2 h,3 000 r/min离心15 min,吸取血清于-80℃保存备用。
打开胸腔,暴露肺组织,气管切开插管,结扎右主支气管,用2 mL生理盐水于气管插管处注入,缓慢灌洗左肺并回收支气管肺泡灌洗液(BALF),1 800 r/min离心15 min,取上清分装于EP管,-80℃保存用于细胞计数及ELISA测定。
收集BALF后,取出肺组织,左侧肺组织于4%多聚甲醛固定;右侧肺组织即刻投于液氮中保存,用于RNA及蛋白提取。
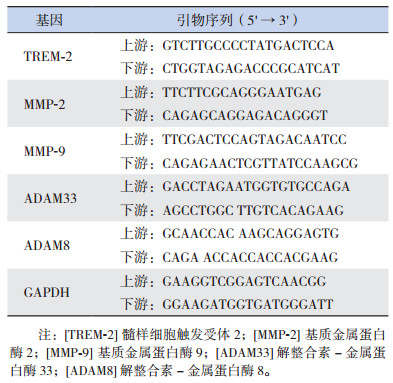
1.4 RT-PCR反应检测mRNA的表达水平用TRIzol试剂提取总RNA,逆转录成cDNA。应用SYBR Green荧光染料试剂盒(Takara)进行RT-PCR。反应条件为:94℃预变性2 min;94℃变性20 s,56℃退火30 s,72℃延伸40 s,进行45个循环。取RT-PCR产物5 μL与1 μL 6×loading buffer混合,在2%的琼脂糖凝胶中电泳,立即置于紫外线透射检测仪下观察,扫描输入计算机,然后使用Gel-pro analyzer软件进行分析,以GAPDH作内参基因,通过Ct值进行数据分析,目的基因的相对表达量以2-△△Ct来表示。基因引物序列见表 1。
| 表 1 基因引物序列 |
1.5 Western blot检测肺组织蛋白的表达
肺组织称重后按比例加入RIPA裂解液,冰上剪碎成小块,手动匀浆,4℃14 000 r/min离心15 min,将上清分装保存于-70℃。采用10%SDS-PAGE凝胶分离蛋白质电转到PVDF膜上。5%脱脂奶粉封闭后分别加入TREM-2、MMP-2、MMP-9及GAPDHⅠ抗,4℃摇床孵育过夜,TBST洗膜3次,加入辣根过氧化物酶标记的Ⅱ抗室温孵育1 h,TBST洗膜处理3次,于凝胶自动成像系统曝光,采用Image J软件进行分析。GAPDH蛋白作为内参标准,结果用目的蛋白/GAPDH比值表示目的蛋白的相对表达水平。
1.6 ELISA法检测血清总IgE及BALF中细胞因子水平应用ELISA法测定血清中IgE和BALF中TREM-2,IL-4、IL-5、IL-6、IL-10、IL-13、INF-γ及TGF-β1的浓度,测定方法按产品说明书进行操作。
1.7 BALF细胞计数和分类BALF离心后,在其细胞沉渣中加入200 μL 0.9%生理盐水,混匀后取20 μL混悬液,在其中加入380 μL冰醋酸;之后吸出20 μL混悬液在显微镜下用血细胞计数板计数细胞总数。然后采用瑞氏-吉姆萨法染色后行细胞分类计数,每个标本在高倍显微镜下分别计数其中的中性粒细胞、嗜酸性粒细胞、淋巴细胞和巨噬细胞。
1.8 明胶酶谱法检测MMP-2和MMP-9活性采用明胶酶谱法检测肺组织中MMP-2和MMP-9活性,实验步骤严格按照试剂盒说明书操作。经UVP凝胶扫描仪扫描后,图像分析测定明胶酶消化条带吸光度值。
1.9 统计学分析采用SPSS 16.0统计软件对数据进行统计学分析,应用Graph Pad Prism 5软件作图。计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。两变量的相关分析采用Pearson直线相关分析。P < 0.05为差异有统计学意义。
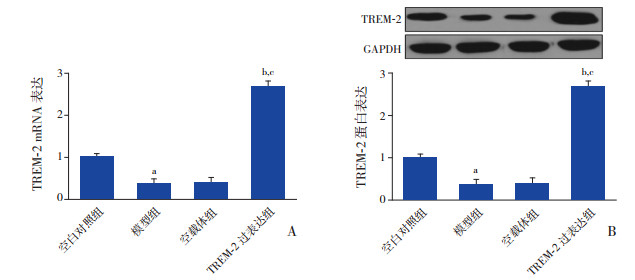
2 结果 2.1 TREM-2在各组小鼠肺组织和BALF中的表达为检测TREM-2在哮喘小鼠中的表达变化及TREM-2载体是否成功转染,采用RT-PCR和Western blot方法检测各组小鼠肺组织中TREM-2 mRNA和蛋白水平。OVA刺激诱导后,模型组小鼠肺组织中TREM-2 mRNA和蛋白水平均显著低于空白对照组(P < 0.05);TREM-2过表达组小鼠肺组织中TREM-2 mRNA和蛋白水平均显著高于模型组和空载体组(P < 0.05,图 1)。
|
图 1 TREM-2在各组小鼠肺组织中的表达A:RT-PCR检测各组TREM-2 mRNA相对表达水平(n=10);B:Western blot检测各组TREM-2蛋白相对表达水平(n=10)。a示与空白对照组比较,P < 0.05;b示与模型组比较,P < 0.05;c示与空载体组比较,P < 0.05。 |
2.2 TREM-2对OVA诱导哮喘小鼠BALF中炎症因子水平的影响
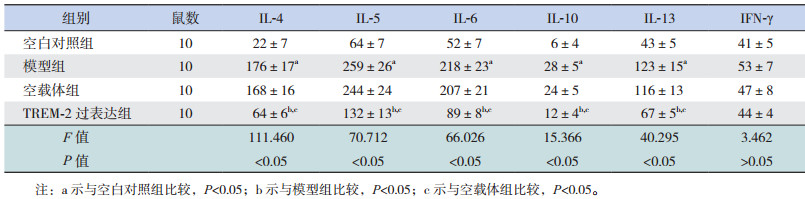
为研究TREM-2对OVA诱导的哮喘小鼠气道炎症的影响,采用ELISA法检测各组小鼠BALF中炎症因子水平。OVA诱导刺激后,模型组小鼠Th2细胞因子IL-4、IL-5、IL-6、IL-10和IL-13的水平均显著高于空白对照组(P < 0.05),而TREM-2过表达组上述细胞因子水平均明显低于模型组和空载体组(P < 0.05);Th1细胞因子IFN-γ水平在各组间比较差异无统计学意义(P > 0.05)。见表 2。
| 表 2 各组小鼠BALF中炎症因子水平比较(x±s,pg/mL) |
2.3 TREM-2对哮喘小鼠血清IgE、BALF中细胞总数和白细胞分类计数的影响
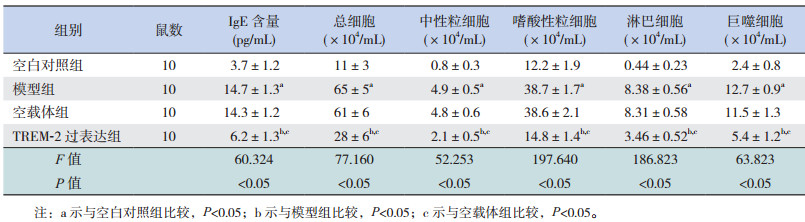
ELISA法检测小鼠血清中OVA特异性IgE含量,结果发现与模型组和空载体组比较,TREM-2高表达可降低IgE含量(P < 0.05)。进一步检测TREM-2对BALF细胞总数和白细胞分类计数的影响,结果显示,与空白对照组相比,模型组BALF中细胞总数、中性粒细胞、嗜酸性粒细胞、巨噬细胞及淋巴细胞数明显增加(P < 0.05);而与模型组和空载体组比较,过表达TREM-2显著降低细胞总数和白细胞分类计数(P < 0.05)。见表 3。
| 表 3 各组小鼠血清IgE、BALF中细胞总数和分类细胞数比较(x±s) |
2.4 TREM-2对OVA诱导的哮喘小鼠气道重塑的影响
检测TREM-2对气道重塑相关的炎性因子和生长因子的影响,结果发现与模型组和空载体组比较,TREM-2过表达显著抑制MMP-2和MMP-9 mRNA和蛋白水平(P < 0.05,图 2A和2B);而且MMP-2与MMP-9的活性也因此被抑制(P < 0.05,图 2C)。当TREM-2过表达时,肺组织中解整合素-金属蛋白酶(ADAM)8与ADAM33的水平较模型组和空载体组明显降低(P < 0.05,图 2D)。TREM-2过表达组BALF中TGF-β1水平明显低于模型组和空载体组(P < 0.05,图 2E)。以上结果表明过表达TREM-2有效减轻哮喘小鼠气道重塑。
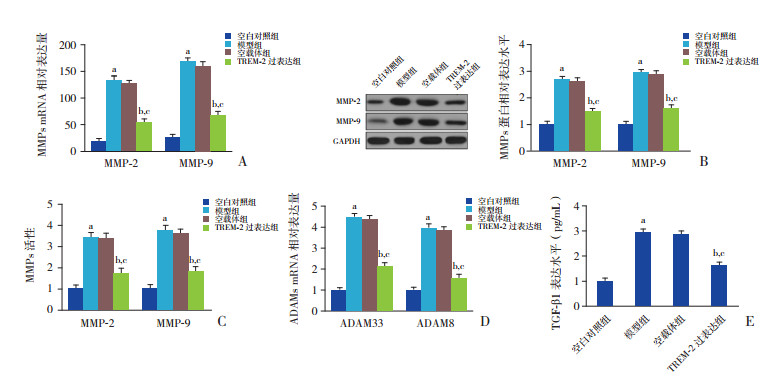
|
图 2 TREM-2对OVA诱导的哮喘小鼠气道重塑的影响A:RT-PCR检测各组BALF中MMP-2和MMP-9 mRNA相对表达水平(n=5);B:Western blot检测各组肺组织中MMP-2和MMP-9蛋白相对表达水平(n=5);C:明胶酶谱法检测各组肺组织中MMP-2及MMP-9活性(n=5);D:RT-PCR检测各组肺组织中ADAM8和ADAM33 mRNA相对表达水平(n=5);E:ELISA法检测各组BALF中TGF-β1水平(n=10)。a示与空白对照组比较,P < 0.05;b示与模型组比较,P < 0.05;c示与空载体组比较,P < 0.05。[MMP]基质金属蛋白酶;[ADAM]解整合素-金属蛋白酶。 |
3 讨论
哮喘是一种慢性疾病,其主要特征是气道炎症、气道高反应性和气道重塑,由于该病发生机制复杂,目前还没有完全阐明。大量研究报道Th1/Th2细胞免疫功能紊乱是哮喘发病的关键,Th2细胞过度活化后能够释放大量的细胞因子,从而使得许多炎症细胞和结构细胞激活,进而参与气道慢性炎症,炎症持续存在并且反复进行损伤修复,引发气道重塑[7]。当Th1功能被抑制而Th2功能增强时,可通过相关细胞因子诱导气道炎症,诱发哮喘。研究结果显示Th2相关细胞因子IL-4、IL-5和IL-13在哮喘患者BALF中高表达[8]。这些细胞因子通过促进变异原特异性IgE、嗜酸性粒细胞计数和气道黏液的产生而启动过敏性炎症反应。OVA通过分泌Th2型细胞因子,从而导致气道过敏性炎症。IL-4属于Th2型细胞因子,与哮喘的发病高度相关。与上述研究结果一致,本研究结果显示OVA诱导的哮喘小鼠中Th2相关细胞因子IL-4、IL-5、IL-6、IL-10、和IL-13的水平明显升高,Th1相关细胞因子IFN-γ表达则无明显变化,而高表达TREM-2显著抑制Th2相关细胞因子,对IFN-γ的水平则无影响。
嗜酸性粒细胞炎症是哮喘的本质特征,是由大量细胞因子及炎性介质参与,通过一系列病理生理学作用引起的气道壁结构的不可逆性改变,即为气道重塑。BALF中嗜酸性粒细胞数量明显增多,活化的嗜酸性粒细胞可释放多种碱性蛋白和脂质体造成气道上皮损伤、气道反应性增高、黏液分泌增多,以及间歇性气道阻塞。本研究结果显示与对照组相比,OVA刺激后BALF中总细胞数及中性粒细胞、嗜酸性粒细胞、巨噬细胞及淋巴细胞数均明显增多,而过表达TREM-2则细胞总数及白细胞分类计数均减少,即炎症程度较轻。由此表明,过表达TREM-2可减轻OVA刺激诱导的气道炎症。
在慢性炎症的刺激下,气道结构可发生改变,也就是气道重塑,这与气道内炎性细胞释放的炎症因子和生长因子密切相关。MMPs是哮喘气道重塑的重要致病因素,其中MMP-2和MMP-9与哮喘的关系最为重要[9]。TGF-β1是一种能够导致气道重塑的重要介质,通过调节炎症细胞的表达及细胞因子的分泌,从而促进血管生成、胶原合成、基质沉积平滑肌细胞迁移及增生等多种途径参与哮喘的发病进程[10]。TGF-β1是由不同类型的细胞分泌,在调节细胞的过程中发挥着极为重要的作用。已有研究表明,哮喘患者BALF中TGF-β1表达升高[11]。采用抗IgE治疗等方式减少嗜酸性粒细胞后,TGF-β1的表达减少,说明嗜酸性粒细胞是TGF-β1的来源之一。同时在体外环境下TGF-β1又可反过来影响嗜酸性粒细胞的生存。有研究表明ADAM8和ADAM33与哮喘气道炎症和气道重塑密切相关[12-13]。本研究检测了与气道重塑相关的炎性因子和生长因子,结果显示在哮喘模型中,MMP-2、MMP-9、TGF-β1、ADAM8和ADAM33的表达都明显升高,而过表达TREM-2后,其表达水平明显下调,而且MMP-2与MMP-9的活性也被抑制,从而得知,过表达TREM-2可缓解OVA刺激诱导的气道重塑。
综上所述,过表达TREM-2能够有效减轻慢性哮喘模型小鼠气道炎症及气道重塑,与哮喘的发生密切相关,因而可以将其作为治疗哮喘的新目标。
| [1] | Lazarus SC. Inflammation, inflammatory mediators, and mediator antagonists in asthma[J]. J Clin Pharmacol , 1998, 38 (7) : 577–582. DOI:10.1002/jcph.1998.38.issue-7 |
| [2] | Bouchon A, Dietrich J, Colonna M. Cutting edge:inflammatory responses can be triggered by TREM-1, a novel receptor expressed on neutrophils and monocytes[J]. J Immunol , 2000, 164 (10) : 4991–4995. DOI:10.4049/jimmunol.164.10.4991 |
| [3] | Bleharski JR, Kiessler V, Buonsanti C, et al. A role for triggering receptor expressed on myeloid cells-1 in host defense during the early-induced and adaptive phases of the immune response[J]. J Immunol , 2003, 170 (7) : 3812–3818. DOI:10.4049/jimmunol.170.7.3812 |
| [4] | Jiang H, Xie Y, Abel PW, et al. Regulator of G-protein signaling 2 repression exacerbates airway hyper-responsiveness and remodeling in asthma[J]. Am J Respir Cell Mol Biol , 2015, 53 (1) : 42–49. DOI:10.1165/rcmb.2014-0319OC |
| [5] | 沈叶菊, 陈晓兵, 石远峰, 等. 乌司他丁对急性肺损伤大鼠肺TLR4及TREM-1和TREM-2表达的影响[J]. 江苏医药 , 2015, 41 (17) : 2002–2005. |
| [6] | 李美容, 王敏. 哮喘小鼠模型的建立与评价[J]. 临床肺科杂志 , 2011, 16 (5) : 664–665. |
| [7] | Kudo M, Ishigatsubo Y, Aoki I. Pathology of asthma[J]. Front Microbiol , 2013, 4 : 263. |
| [8] | Prieto J, Van Der Ploeg I, Roquet A, et al. Cytokine mRNA expression in patients with mild allergic asthma following low dose or cumulative dose allergen provocation[J]. Clin Exp Allergy , 2001, 31 (5) : 791–800. DOI:10.1046/j.1365-2222.2001.01078.x |
| [9] | Ohbayashi H, Shimokata K. Matrix metalloproteinase-9 and airway remodeling in asthma[J]. Curr Drug Targets , 2005, 4 (2) : 177–181. DOI:10.2174/1568010053586246 |
| [10] | Yang YC, Zhang N, Van Crombruggen K, et al. Transforming growth factor-beta1 in inflammatory airway disease:a key for understanding inflammation and remodeling[J]. Allergy , 2012, 67 (10) : 1193–1202. DOI:10.1111/j.1398-9995.2012.02880.x |
| [11] | Xiong YY, Wang JS, Wu FH, et al. The effects of (±)-Praeruptorin A on airway inflammation, remodeling and transforming growth factor-β1/Smad signaling pathway in a murine model of allergic asthma[J]. Int Immunopharmacol , 2012, 14 (4) : 392–400. DOI:10.1016/j.intimp.2012.08.019 |
| [12] | Knolle MD, Owen CA. ADAM8:a new therapeutic target for asthma[J]. Expert Opin Ther Targets , 2009, 13 (5) : 523–540. DOI:10.1517/14728220902889788 |
| [13] | Van Eerdewegh P, Little RD, Dupuis J, et al. Association of the ADAM33 gene with asthma and bronchial hyperresponsiveness[J]. Nature , 2002, 418 (6896) : 426–430. DOI:10.1038/nature00878 |
 2016, Vol. 18
2016, Vol. 18