哮喘是常见的慢性呼吸道疾病之一,其发病率近年明显增加,目前仍是全球性的主要公共卫生问题[1]。据估计全球有约3亿哮喘患者,且儿童哮喘患病率高于成人,严重威胁青少年身体健康[2]。积极防治小儿支气管哮喘可防止气道不可逆性狭窄和气道重塑。
KyoT是一种LIM结构域蛋白,有两种类型:KyoT1和KyoT2蛋白,其中KyoT2可与RBP-Jκ相互作用[3]。有研究表明,在哮喘型小鼠中,过表达KyoT2抑制气道重塑[4]。气道平滑肌细胞(airway smooth muscle cells, ASMC)增殖和迁移参与哮喘的发生发展,是哮喘过程中重要的病理学变化[5]。KyoT2对ASMC的增殖和迁移作用尚未见报道。本研究拟通过卵白蛋白(ovalbumin, OVA)建立小鼠哮喘模型,观察KyoT2在哮喘小鼠ASMC中的表达;分离正常和哮喘小鼠的ASMC,探讨KyoT2对哮喘小鼠ASMC增殖和迁移的作用及可能的机制,为KyoT2防治哮喘气道重塑提供实验依据并奠定理论基础。
1 材料与方法 1.1 材料OVA(Sigma公司,美国),胎牛血清(Hyclone,美国),0.25%胰蛋白酶和D-Hanks液(JRH公司,美国),MTT试剂盒(上海碧云天公司),BrdU试剂盒(Roche公司,瑞士),AKT、p-AKT、Myc和PTEN抗体(Cell Signaling公司,美国),KyoT2抗体(Abcam公司,美国),RBP-Jκ(Santa Cruz公司,美国),HRP标记的二抗(北京中杉金桥公司),Transwell小室(Corning公司,美国)。
1.2 哮喘动物模型建立3周龄SPF级雌性BALB/c小鼠16只,体重18~22 g,由西安交通大学医学院实验动物中心提供,随机分成对照组和哮喘组,每组8只。小鼠哮喘动物模型的建立参照文献[6]后略加改动,哮喘组小鼠于第0天和第14天腹腔注射致敏液0.1 mL/只,致敏液中含20 μg OVA和0.1 mL氢氧化铝凝胶;第21~27天以0.5%的OVA溶液雾化激发,每次20 min。对照组给予相同体积的生理盐水致敏、雾化。两组小鼠于最后1次雾化吸入后24 h颈椎脱臼处死,取气管作ASMC分离培养实验。
1.3 小鼠ASMC分离及培养运用组织贴块分离培养ASMC。小鼠经断颈处死,迅速分离气管部分,置入含有青霉素的D-Hanks溶液中,剥离外膜并刮除内膜,将气管小心剪成约1 mm3组织块,贴于培养皿底部,加入含20%胎牛血清的完全培养基。显微镜下观察组织块外缘细胞融合度达80%时,进行首次传代,按照1:2传代。
1.4 细胞转染过表达KyoT2的质粒pCMV-Myc-KyoT2和对照质粒pCMV-Myc由上海生工生物公司提供。将哮喘组ASMC接种于培养皿中,随机分为空载体组(转染pCMV-Myc的哮喘组ASMC)和KyoT2过表达组(转染pCMV-Myc-KyoT2的哮喘组ASMC)。无血清培养24 h,采用lipo2000试剂将pCMV-Myc和pCMV-Myc-KyoT2转入ASMC中,5 h后换上完全培养基继续培养48 h,收样后检测KyoT2转染效率。
1.5 MTT法检测ASMC增殖ASMC经0.25%胰蛋白酶消化后,以1× 107/L的密度接种于96孔培养板中。细胞分为对照组(对照组ASMC)、哮喘组(哮喘组ASMC)、空载体组(转染pCMV-Myc的哮喘组ASMC)和KyoT2过表达组(转染pCMV-Myc-KyoT2的哮喘组ASMC),每组设置3个复孔。每孔加入5 g/L的MTT 20 μg,培养3.5 h后弃培养液,加入150 μL培养液,震荡10 min,选择570 nm波长,采用酶标仪检测各孔490 nm处的吸光度值(OD)。实验独立重复6次。
1.6 BrdU法检测ASMC增殖细胞处理及分组情况同1.5小节,每组设置3个复孔。收样前8~10 h,每孔加入BrdU 10 μL。收样时弃上清,加入200 μL/孔Fix Denat室温反应30 min,弃上清,加入100 μL/孔anti-BrdU-POD工作液,室温反应90 min,弃上清,清洗4次,加入100 μL底物溶液,室温反应15 min。2 mol/L硫酸终止反应。实验独立重复6次。
1.7 Transwell检测细胞迁移Transwell板上室和下室之间的聚碳酸酯膜采用I型胶原溶液于4℃过夜反应。ASMC经转染pCMV-Myc和pCMV-Myc-KyoT2 48 h后,消化细胞并计数,用含10%胎牛血清的培养基调整细胞密度为1×105/L,Transwell上室中加入各组细胞悬液100 μL,下室中加入600 μL含10%胎牛血清的培养基。将Transwell小室于37℃孵育6 h,擦去微孔膜上未穿膜的细胞,膜下面的ASMC采用甲醇固定,结晶紫染色10 min,封片,在倒置显微镜下,每组观察4张切片,每张切片随机选取5个视野进行计数,取平均值计算。实验独立重复6次。
1.8 Real-Time PCRASMC接种于6孔板中,分为对照组、空载体组和KyoT2过表达组。每组设3个平行样本,采用TRIzol提取各组细胞的总RNA。以总RNA为模板,采用逆转录试剂盒合成cDNA,引物由上海生工生物工程公司合成。KyoT2上游引物:5'-GACCAGAACGTGGAGTACAA-3',下游引物:5'-AGTCAGGGCAATACACCTGC-3';β-actin上游引物:5'-TGCTGTCCCTGTATGCCTCT-3',下游引物:5'-TTGATGTCACGCACGATTTC-3'。各组取5 μg cDNA为模板,选择25 μL的反应体系,94℃预变性2 min;94℃变性15 s,60℃退火30 s,72℃延伸30 s,共40个循环。每个基因用内参基因β-actin校准。目的基因的相对表达水平依据2-ΔΔCt法计算。实验独立重复6次。
1.9 Western blot法检测RBP-Jκ、PTEN和AKT蛋白表达ASMC接种于6孔板中,分为哮喘组、空载体组和KyoT2过表达组。每组设3个平行样本,提取各组总蛋白。采用BCA试剂盒测定蛋白浓度,每组50 μg蛋白经SDS-PAGE电泳、转膜后,5%脱脂牛奶室温封闭1 h,加入一抗4℃反应过夜。加入HRP标记的二抗,室温反应1 h,采用化学发光液进行显色。采用Image J软件分析各个条带的OD值。实验重复6次。
1.10 统计学分析采用SPSS 11.0统计学软件对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,两组间比较采用t检验;多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
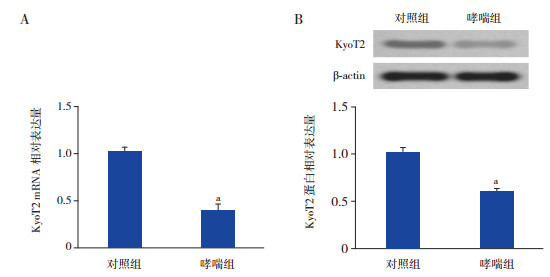
2 结果 2.1 KyoT2在哮喘ASMC中的表达RT-PCR和Western blot用于检测KyoT2的表达。哮喘组ASMC中KyoT2 mRNA表达较对照组显著下降(P < 0.05)(图 1A)。将Myc-KyoT2转染至哮喘组ASMC中48 h,结果表明哮喘组ASMC中KyoT2蛋白表达较对照组下调(P < 0.05)(图 1B)。
|
图 1 KyoT2在OVA诱导的哮喘小鼠ASMC中的表达A:RT-PCR检测KyoT2 mRNA表达水平(n=3);B:Western blot检测KyoT2蛋白表达水平(n=3)。a示与对照组相比,P < 0.05。 |
2.2 KyoT2转染效率
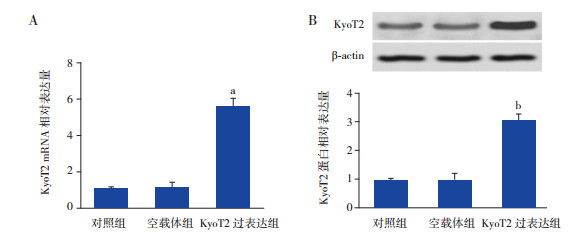
采用RT-PCR法检测KyoT2 mRNA表达水平。结果显示,与空载体组比较,过表达KyoT2显著上调其mRNA(图 2A,P < 0.05)和蛋白表达水平(图 2B,P < 0.05)。
|
图 2 KyoT2的转染效率A:RT-PCR检测KyoT2 mRNA表达水平(n=3);B:Western blot检测KyoT2蛋白表达水平(n=3)。a示与空载体组相比,P < 0.01;b示与空载体组相比,P < 0.05。 |
2.3 过表达KyoT2抑制ASMC增殖
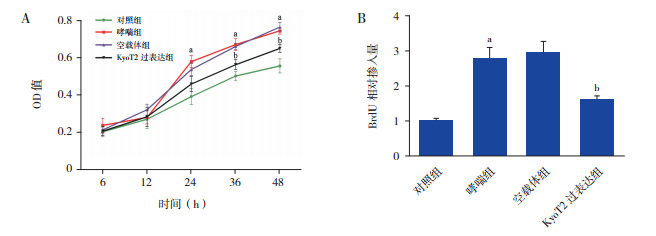
分别采用MTT法和BrdU法检测ASMC增殖。结果显示,KyoT2过表达组细胞增殖速度较空载体组下降(图 3A,P < 0.05)。采用BrdU法进一步验证,KyoT2过表达组细胞BrdU掺入量较空载体组显著减少(图 3B,P < 0.05)。
|
图 3 过表达KyoT2抑制ASMC增殖A:MTT法检测ASMC增殖(n=3);B:BrdU法检测ASMC增殖(n=3)。a示与对照组相比,P < 0.05;b示与空载体组相比,P < 0.05。 |
2.4 过表达KyoT2抑制ASMC迁移
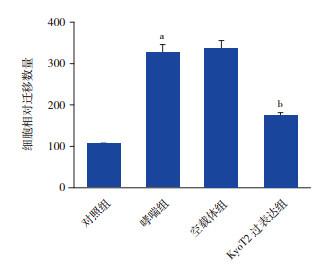
Transwell法用于检测过表达KyoT2对哮喘组ASMC迁移的作用,结果如图 4所示,哮喘组细胞迁移能力较对照组显著增强,而过表达KyoT2明显抑制OVA诱导的细胞迁移(P < 0.05)。
|
图 4 过表达KyoT2抑制ASMC迁移(n=4)a示与对照组相比,P < 0.05;b示与空载体组相比,P < 0.05。 |
2.5 过表达KyoT2负调控RBP-J/PTEN/AKT通路
KyoT2能负调控RBP-Jκ的活性及表达[7],同时RBP-Jκ能与PTEN的启动子结合进一步调控PTEN的表达及下游信号通路[8]。本研究结果显示,在ASMC中过表达KyoT2能显著抑制RBP-Jκ(图 5A和B)和p-AKT(图 5A和D)的表达而上调PTEN的表达(图 5A和C)(P < 0.05)。
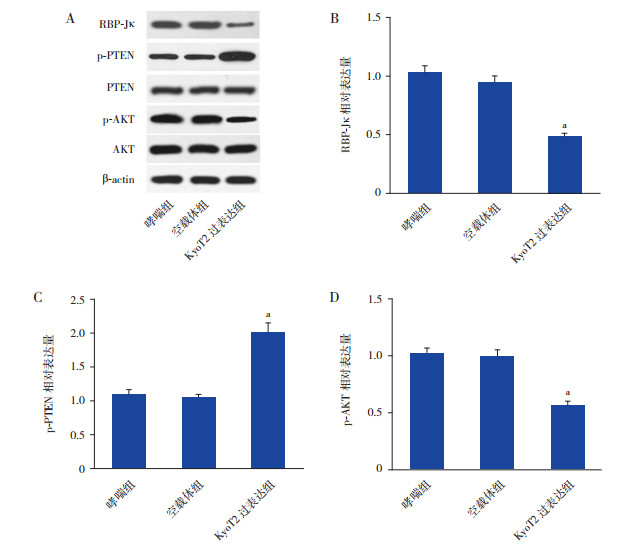
|
图 5 过表达KyoT2负调控RBP-Jκ/PTEN/AKT信号通路A:Western blot检测RBP-Jκ、PTEN和AKT蛋白表达水平(n=3);B:RBP-Jκ蛋白相对表达水平统计图(n=3);C:p-PTEN蛋白相对表达水平统计图(n=3);D:p-AKT蛋白相对表达水平统计图(n=3)。a示与空载体组相比,P < 0.05 |
3 讨论
近年来,由于环境污染及社会因素,哮喘发病率显著升高,尤其儿童哮喘的发病率逐年上升[9]。OVA是常用哮喘致敏原,一般分为单纯和复合两种方式致敏和诱导哮喘。氢氧化铝作为佐剂乳化OVA,多次经腹腔或者皮下致敏后,再滴鼻或者雾化吸入诱导哮喘模型。哮喘作为一种反复性发作的疾病,长期反复发作会使气道发生不可逆的缩窄和重塑[10]。同时,哮喘发生伴随着ASMC增殖并向气管腔内迁移,进一步促进气道壁增厚[11]。ASMC的增殖和迁移导致哮喘的加重。KyoT2是Notch 1信号的负性调控因子[12],能下调小鼠肺组织Hes1的表达,减轻OVA诱导的哮喘模型小鼠气道上皮下胶原沉积,减轻基底膜的厚度[4]。本研究证实,过表达KyoT2能抑制哮喘ASMC增殖和迁移,其具体机制可能是通过负调控RBP-Jκ/PTEN/AKT通路实现。
KyoT2是Notch信号通路的负性调控因子,能与其下游分子RBP-Jκ结合抑制Notch信号通路[13]。本研究发现过表达KyoT2下调RBP-Jκ的表达。同时,PTEN是一个具有双特异性磷酸酶活性的抑癌基因,对细胞的生长、增殖、分化、迁移和血管生长等均有明显的调控作用。研究表明过表达PTEN可通过下调p-Akt的表达,抑制HASMC的增殖和迁移,参与调控气道重塑[14]。RBP-Jκ能够与PTEN启动子结合调控PTEN基因的表达,进一步调控其下游分子的表达[8]。本研究结果显示过表达KyoT2显著上调PTEN的表达并抑制p-AKT表达。因此,过表达KyoT2抑制ASMC增殖和迁移可能是通过负调控RBP-Jκ/PTEN/AKT通路实现。
综上所述,过表达KyoT2抑制ASMC增殖和迁移,其可能的机制是通过负调控RBP-Jκ/PTEN/AKT信号通路实现。提示KyoT2可能作为防治哮喘的靶分子,为KyoT2预防哮喘气道重塑提供实验依据和新的思路。
| [1] | To T, Stanojevic S, Moores G, et al. Global asthma prevalence in adults:findings from the cross-sectional world health survey[J]. BMC Public Health , 2012, 12 : 204. DOI:10.1186/1471-2458-12-204 |
| [2] | Gasana J, Dillikar D, Mendy A, et al. Motor vehicle air pollution and asthma in children:a meta-analysis[J]. Environ Res , 2012, 117 : 36–45. DOI:10.1016/j.envres.2012.05.001 |
| [3] | 李荣, 程轶梦, 陈蕾, 等. LIM蛋白KyoT在小鼠胚胎发育中的表达[J]. 生物化学与生物物理进展 , 2003, 30 (1) : 95–98. |
| [4] | Hu M, Ou-Yang HF, Han XP, et al. KyoT2 downregulates airway remodeling in asthma[J]. Int J Clin Exp Pathol , 2015, 8 (11) : 14171–14179. |
| [5] | Li LH, Lu B, Wu HK, et al. Apigenin inhibits TGF-β1-induced proliferation and migration of airway smooth muscle cells[J]. Int J Clin Exp Pathol , 2015, 8 (10) : 12557–12563. |
| [6] | Hamelmann E, Schwarze J, Takeda K, et al. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography[J]. Am J Respir Crit Care Med , 1997, 156 (3 Pt 1) : 766–775. |
| [7] | Qin H, Wang J, Liang Y, et al. RING1 inhibits transactivation of RBP-J by Notch through interaction with LIM protein KyoT2[J]. Nucleic Acids Res , 2004, 32 (4) : 1492–1501. DOI:10.1093/nar/gkh295 |
| [8] | Whelan JT, Forbes SL, Bertrand FE. CBF-1(RBP-J kappa) binds to the PTEN promoter and regulates PTEN gene expression[J]. Cell Cycle , 2007, 6 (1) : 80–84. DOI:10.4161/cc.6.1.3648 |
| [9] | Von Mutius E. The microbial environment and its influence on asthma prevention in early life[J]. J Allergy Clin Immunol , 2016, 137 (3) : 680–689. DOI:10.1016/j.jaci.2015.12.1301 |
| [10] | Ozdogan S, Tabakci B, Demirel AS, et al. The evaluation of risk factors for recurrent hospitalizations resulting from wheezing attacks in preschool children[J]. Ital J Pediatr , 2015, 41 : 91. DOI:10.1186/s13052-015-0201-z |
| [11] | Prakash YS. Airway smooth muscle in airway reactivity and remodeling:what have we learned[J]. Am J Physiol Lung Cell Mol Physiol , 2013, 305 (12) : L912–L933. DOI:10.1152/ajplung.00259.2013 |
| [12] | 秦鸿雁, 韩骅. KyoT2结合蛋白KBP1对RBP-J介导的转录活性的影响[J]. 细胞与分子免疫学杂志 , 2004, 20 (5) : 544–547. |
| [13] | Borggrefe T, Oswald F. Keeping notch target genes off:a CSL corepressor caught in the act[J]. Structure , 2014, 22 (1) : 3–5. DOI:10.1016/j.str.2013.12.007 |
| [14] | 蓝海兵, 罗雅玲, 赖文岩, 等. 肿瘤抑制基因PTEN对人气道平滑肌细胞迁移和增殖的影响[J]. 南昌大学学报(医学版) , 2015, 55 (3) : 14–18. |
 2016, Vol. 18
2016, Vol. 18

