新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是围生期窒息或缺氧所致的新生儿脑损伤,是新生儿死亡的重要原因,也是癫癎、脑瘫等婴幼儿神经和运动系统功能障碍的常见原因[1]。在全球范围内,活产足月儿的HIE发病率约为1‰~8‰,即使在发达国家,其发病率也可达1.5‰~2‰。其中约15%~20%的患儿出生后死亡,约25%存活患儿会伴有较严重的智力障碍或运动缺陷[2-5],给患儿、社会和家庭带来了沉重的负担。因此,如何治疗和预防HIE一直是国内外研究的重点和热点。
脑是人体代谢较活跃的组织之一,其重量约为体重的2%,但耗氧量可占整体的20%~25%,对缺氧十分敏感。脑缺氧缺血(hypoxic-ischemia, HI)损伤后的发病机制涉及能量衰竭、自由基的产生、脂质过氧化、炎症因子、兴奋性氨基酸毒性、水通道蛋白失控、钙通道异常、细胞内钙离子超载等因素。各种机制相互作用,最终导致神经细胞水肿、变性、坏死和凋亡,脑组织完整性受损等[4, 6-7]。本文将重点对能量衰竭在HIE中的作用进行阐述。
1 能量衰竭在HIE病程中的作用和地位脑组织代谢活跃,除耗氧量高外,还体现在其能量消耗高:仅占体重2%的脑组织每日消耗的能量约占整体的20%,消耗的葡萄糖量约占整体的25%[8-9],故HIE造成的能量衰竭对脑组织有十分重要的影响。在HIE早期,缺氧条件下的脑组织通过低效的葡萄糖无氧代谢供能,使脑内高能磷酸化合物水平迅速下降,脑内能量储备的迅速耗竭导致了Na+-K+泵功能障碍等一系列细胞活动异常,即为原发性能量衰竭,多发生在HI后的6 h内。继发性能量衰竭通常发生在HI后6~48 h,由初始损伤引发的广泛反应导致的线粒体功能障碍所致,会进一步加剧脑组织损伤,且其严重程度与患儿神经系统功能预后密切相关[4]。
值得注意的是,在继发性能量衰竭开始前的一段时间里,细胞内的氧化代谢可部分或完全的恢复,这一短暂恢复期也被称为“潜伏期”,为减缓或防止继发性能量衰竭带来的严重脑损伤提供了关键的治疗时机,在此潜伏期内对HIE进行早期治疗十分重要,现普遍将出生后6 h内定为开始治疗的最佳时机[5, 10-11]。此外,由于临床上无法预测HI损伤发生的时间,且对宫内的HI损伤尚无相应的治疗方法,故对HIE而言,积极有效的预防方案比损伤后的治疗更有价值[12]。
近年来,许多研究针对能量衰竭这一核心病理过程,进行了相应的早期治疗和预防方法的探索。
2 针对能量衰竭的HIE治疗方法和/或预防措施 2.1 亚低温治疗HIE损伤是一个连续、不间断的病理过程,各种治疗多通过中断或缩短病程来发挥神经保护作用。由于潜伏期内神经元可部分或完全暂时性地恢复正常,故在此“时间窗”内开始治疗显得尤为重要,且实施越早取得效果越好。
研究表明,温度每降低1摄氏度,脑代谢可减少约5%。亚低温治疗可通过降低脑部温度、减少脑组织代谢、降低能量需求以缓解能量供需矛盾, 从而防止组织细胞的毒素积聚及凋亡,减轻脑损伤[11]。
有研究显示,亚低温治疗可显著降低足月儿18月龄时的病死率和严重伤残发生率,且18月龄时,存活患儿神经功能正常的比率明显增加[13]。
目前,亚低温治疗HIE的安全性和有效性得到了越来越多的认可,许多国家已将亚低温治疗作为新生儿HIE的常规疗法,相关指南也将其列入了新生儿窒息复苏后的常规管理办法[14-15],但亚低温治疗仍有其局限性。如:治疗时间窗短,最好在患儿出生后6 h内实施治疗;应用对象受限,主要应用于胎龄大于35周、出生体重大于1 800 g的中重度患儿,且对重度患儿疗效较差;应用场合受限,多推荐在设施、技术较完善的地区和医院中开展。此外,亚低温治疗也存在风险,如部分患儿可发生低血压、QT间期延长、血小板减少、硬肿症、代谢及电解质紊乱等不良反应,同时,尽管亚低温治疗可以在一定程度上减少HIE的死亡率,但其对神经系统功能障碍的改善作用并没有达到预期[11, 14, 16-17]。所以,探索HIE治疗方法的研究仍在继续,同时,如何使亚低温疗法的疗效最大化也是研究者们关心的问题。
研究者尝试在亚低温治疗过程中联合使用具有神经保护作用的措施,以期优化亚低温疗法的疗效。其中,氩气和氙气曾备受关注,但氙气价格较高,且运输和使用时均需特殊仪器设备[18],限制了其实验研究及临床应用。与之相比,同样具有神经保护作用的氩气因其在自然界中含量较多,在工业中的应用也较多,价格相对低,是氙气的1/200,对其获取、保存等技术也更为成熟,为科研及临床应用提供了可行性。研究者发现,在HI的新生猪模型中,对实验组于HI后2 h起实施亚低温治疗的同时使其持续吸入45%~50%的氩气治疗24 h,对照组则只进行亚低温治疗,发现HI后48 h实验组动物脑组织内三磷酸腺苷(adenosine triphosphate, ATP)含量与对照组相比明显增高,提示氩气可减轻HI造成的脑组织能量衰竭,其作用机制可能与氩气对线粒体的保护作用有关。此外,联合治疗后实验组动物的脑组织电生理活动可较快恢复正常,且脑组织细胞凋亡数量也减少,提示联合治疗增强了亚低温治疗的疗效[19]。但氩气的应用仍存在一些问题,如治疗时间窗较窄(HI后3 h或更短)、吸入氩气后血液偏碱性等[19-20],仍需进一步研究以探究其可能的不良反应及相关的解决办法、制定最优的治疗方案并验证其安全性和有效性。
2.2 治疗或预防性补充肌酸/磷酸肌酸脑是人类组织器官中能量消耗最大的器官之一,主要依靠葡萄糖有氧代谢产生的ATP供能,葡萄糖以糖原形式贮存在脑内,但其贮存量远少于肝脏及骨骼肌等代谢组织。当脑组织耗能增加时,主要依靠葡萄糖转运体摄取血液循环中的葡萄糖以满足自身需求[9, 21-22];
ATP为能量载体分子,可在糖酵解、氧化磷酸化等过程中产生,但大部分是由二磷酸腺苷(ADP)直接转换而来。ATP的高能磷酸键不稳定,故脑组织内ATP含量较少,需要依靠ADP的不断转换才能生成以维持正常的脑功能活动[23]。
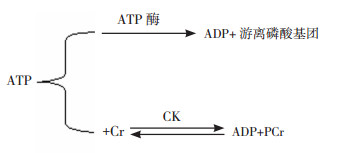
肌酸(creatine, Cr)/磷酸肌酸(phosphocreatine, PCr)/肌酸激酶(creatine kinase, CK)系统在维持ADP/ATP比率及脑组织能量稳态中发挥重要作用(图 1)。当代谢活跃时,ATP在ATP酶的作用下水解为ADP和游离磷酸基团,释放能量为机体供能;当能量需求相对较小时,ATP则在CK的作用下将高能磷酸键转移至Cr,生成PCr,CK催化的这一反应为可逆反应,当机体需要能量时,ADP和PCr可在CK作用下迅速生成ATP供能。在这一过程中,PCr为能量的短期储存库,Cr是ATP与PCr间高能磷酸键转移的媒介[24]。
|
图 1 ATP与ADP的转换当代谢活跃时,ATP在ATP酶的作用下水解为ADP和游离磷酸基团,释放能量为机体供能;当能量需求相对较小时,ATP则在CK的作用下将高能磷酸键转移至Cr,生成PCr,CK催化的这一反应为可逆反应,当机体需要能量时,ADP和PCr可在CK作用下迅速生成ATP供能。[CK]肌酸激酶;[Cr]肌酸;[PCr]磷酸肌酸。 |
HI后,一方面,无氧代谢的低效使ATP生成量减少;另一方面,缺血使消耗的葡萄糖无法得到及时补充,能量来源受阻进一步影响ATP生成量。二者共同作用下,脑内ATP水平迅速下降、能量供应缺乏、组织细胞活动异常,进而造成了一系列不良后果。若能设法在缺氧条件下增加脑组织内ATP含量,则可延缓或阻止能量衰竭进程,在一定程度上减轻或预防HI脑损伤。
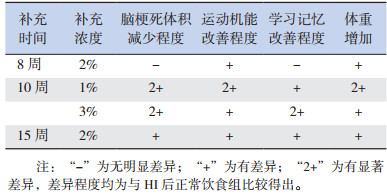
研究者尝试通过补充Cr或PCr,来治疗或预防HIE病程中能量衰竭及其所造成的病理改变。治疗方面:有研究者对生后10 d的小白鼠(脑发育相当于人类足月儿)进行HI处理,HI后10 d时断奶并改用添加了Cr的食物进行喂养,观察并比较其脑损伤程度及行为学表现。发现Cr补充8周及以上的HI小白鼠病情有不同程度缓解,补充10周者各观测指标均有明显好转,脑梗死体积显著减少,其中补充Cr浓度为1%者运动机能改善明显,3%者学习记忆改善明显,但尚不清楚造成此种差异的具体机制。综合考虑,认为补充3%Cr10周疗效较好,具体见表 1[25-27]。
| 表 1 不同浓度、时间Cr补充治疗新生鼠HIE的效果比较 |
预防方面:怀孕期间,胎儿的物质和能量需求主要依靠母体供给,其能量代谢与储备情况也与母孕期情况密切相关,因此可以假设若胎儿能通过孕母在宫内获得足够的Cr作为能量储备,或可在遭受HI损伤时减轻或避免能量衰竭及其导致的脑损伤,增强其对HI损伤的耐受性,故孕期预防也极为重要。
孕母体内的Cr稳态水平在怀孕期间是动态变化的。非洲刺毛鼠在怀孕中后期,血浆中Cr含量和肾脏排泄的Cr量均显著降低,自身组织、胎儿及胎盘中Cr含量增多[28],提示在孕中后期,胎儿对Cr的需求量增多。此时补充Cr,既可保证胎儿的正常能量供应,也可为胎儿提供足够的原料以进行能量储备。有研究者从孕中期起用添加了5%Cr的饲料饲养非洲刺毛鼠孕鼠,至足月时处死孕鼠并对胎鼠进行宫内缺氧处理(人为模拟产时窒息),发现孕中期起补充Cr可增加窒息后新生鼠存活率、提高其脑组织内Cr含量并减轻脂质过氧化、细胞凋亡、线粒体损伤等脑组织损伤[29-30],提示Cr补充可增强脑组织对缺氧损伤的耐受性, 降低围产期获得性脑损伤的风险。正如孕母现已常规于孕早期补充叶酸以预防神经管缺陷一样[12],补充Cr也有望成为HIE预防的新方法。
Cr补充对HIE病程中能量衰竭的延缓或阻止作用可能主要来源于以下两方面:一方面,补充Cr可提高脑组织细胞对能量衰竭的耐受性。实验表明,增加食物中Cr的摄入可使脑组织内的Cr水平增高,且增加母体饮食中的Cr摄入也可明显增加胎盘及胎儿脑组织内的Cr含量。这些外源性的Cr进入脑组织后,可在线粒体内的CK作用下利用线粒体氧化磷酸化产生的ATP合成PCr,使脑内能量储备增多。由于PCr在CK作用下使ADP转化为ATP的反应过程不需氧的参与,故缺氧时,PCr可迅速转化为ATP为脑组织供能以延缓或阻止能量衰竭,从而减轻或预防能量衰竭所致的脑组织损伤[24, 29];另一方面,Cr对氧化应激下的线粒体及线粒体DNA有直接保护作用。有研究表明,外源性的Cr可以通过减少线粒体内活性氧的产生,抑制线粒体通透性和线粒体的凋亡,可减轻继发性能量衰竭过程中由线粒体功能障碍所致的脑组织损伤[24, 31-34]。
此外,Cr还有促进神经元祖细胞分化、维持海马神经元形态正常、在应激状态下保护认知功能等作用[35-37]。补充Cr是HIE的防治新方向。
但补充Cr也存在一定的隐患。运动员补充Cr的实验显示,高水平Cr摄入可能会造成体重、血压和肾功能等的改变[38]。在用Cr治疗小鼠HI脑损伤的实验中,也观察到实验组小鼠体重较对照组有明显增高[25-27]。故在临床应用前,仍需进一步研究。若Cr补充的安全性得以确保,则可进行临床随机对照试验以进一步验证其有效性,可将安慰剂或已经确定有神经保护作用的药物(如硫酸镁等)用作对照,观察并评估婴儿的健康状况、发病情况、疾病恢复情况、近期及远期预后,以验证Cr补充是否确有神经保护作用及其对患儿生长、发育的影响。若确实有效,则可进一步比较不同剂量、不同时间的Cr补充方案对其神经保护作用的影响,探索出Cr补充的最优方案[39]。
2.3 一种可能的新能源供给:干细胞来源的细胞外囊泡干细胞移植作为一种再生疗法,在HIE治疗方法的探索过程中也获得了广泛关注。但由于干细胞移植的安全性和有效性尚未得到统一认识,且在伦理学方面也存在争议,限制了干细胞移植治疗在临床上的应用和发展。干细胞来源的细胞外囊泡(extracellular vesicles, EVs)的发现,为干细胞疗法的应用提供了新的方向。
EVs是一种细胞间通讯分子,种类繁多,常见的如外泌体、微囊泡等。几乎所有类型的细胞均可分泌EVs,它们通过将蛋白质、脂质、信使RNA或微小RNA等携带至受体细胞发挥通讯作用[40-42]。最近有研究者采用差速离心法从培养的间充质干细胞的培养基中分离、提取出微囊泡并给放射性脑损伤的小鼠进行脑室内注射,发现小鼠的认知功能较对照组显著提高[43]。在模拟早产儿HI脑损伤的绵羊模型中也发现,对HI处理后的胎羊静脉内注射间充质干细胞来源的EVs后,其脑组织的电生理异常及组织学损伤较对照组均有所改善[44]。这提示我们干细胞对疾病的治疗作用可能存在一种新机制即通过其分泌的EVs作用于靶细胞而实现。
在治疗心肌缺血的动物实验中,研究者发现,在再灌注前5 min给小鼠静脉注射干细胞来源的EVs,可在缺血/再灌注损伤后30 min内恢复心肌的能量供应水平,并认为这可能是因为干细胞来源的EVs中包含了合成ATP所需要的酶[45]。此外,也有研究发现,间充质干细胞来源的EVs在ATP衰竭诱导产生的急性肾缺血再灌注损伤的体外模型中,可通过转运及调节与肾近端小管内皮细胞损伤及修复过程相关的miRNAs对肾近端小管内皮细胞产生保护作用,抑制了ATP衰竭对近端小管内皮细胞造成的损伤[46]。这些研究均提示EVs用于治疗HIE病程中的能量衰竭的可能性。但干细胞来源的EVs是否可通过上述途径在脑缺血/再灌注时恢复脑组织的正常氧化还原反应及能量供应水平或减轻能量衰竭造成的脑组织损伤,仍需进一步研究。有研究表明,使用干细胞来源的EVs治疗外伤性脑损伤或脑卒中,对其神经功能恢复和血管重塑也有明显改善作用[47-48]。这些研究均为EVs用于HIE的治疗提供了科学参考。若可在体外及动物实验中验证干细胞来源的EVs在HIE治疗中的安全性及有效性,则可进一步探究不同干细胞来源、不同剂量、不同用药时间、不同给药途径等对其疗效的影响,以期为后期的临床研究提供参考。
3 小结在探索HIE治疗的方法中,还有很长的路要走,值得欣慰的是,亚低温治疗的开展,在一定程度上改善了HIE的预后。尽管如此,仍有部分重度患儿疗效不佳。因此,积极探寻安全有效的预防和治疗新措施仍十分重要。能量衰竭作为HIE病程中的重要环节,两次能量衰竭之间的“潜伏期”更是临床医生必须抓住的关键防治时间窗。而Cr补充对于能量衰竭的阻止或减轻作用也为HIE的防治提供了新的可能。此外,干细胞来源的EVs作为一种极具潜能的治疗探索,也为HIE能量衰竭的防治,提供了新的参考。
| [1] | Lai MC, Yang SN. Perinatal hypoxic-ischemic encephalopathy[J]. J Biomed Biotechnol , 2011, 2011 : 609813. |
| [2] | Kurinczuk JJ, White-Koning M, Badawi N. Epidemiology of neonatal encephalopathy and hypoxic-ischaemic encephalopathy[J]. Early Hum Dev , 2010, 86 (6) : 329–338. DOI:10.1016/j.earlhumdev.2010.05.010 |
| [3] | Yates HL, McCullough S, Harrison C, et al. Hypoxic ischaemic encephalopathy:accuracy of the reported incidence[J]. Arch Dis Child Fetal Neonatal Ed , 2012, 97 (1) : F77–F78. |
| [4] | James A, Patel V. Hypoxic ischaemic encephalopathy[J]. Paediatr Child Health , 2014, 24 (9) : 385–389. DOI:10.1016/j.paed.2014.02.003 |
| [5] | Saliba E, Fakhri N, Debillon T. Establishing a hypothermia service for infants with suspected hypoxic-ischemic encephalopathy[J]. Semin Fetal Neonatal Med , 2015, 20 (2) : 80–86. DOI:10.1016/j.siny.2015.01.008 |
| [6] | Wu Q, Chen W, Sinha B, et al. Neuroprotective agents for neonatal hypoxic-ischemic brain injury[J]. Drug Discov Today , 2015, 20 (11) : 1372–1381. DOI:10.1016/j.drudis.2015.09.001 |
| [7] | Lv H, Wang Q, Wu S, et al. Neonatal hypoxic ischemic encephalopathy-related biomarkers in serum and cerebrospinal fluid[J]. Clin Chim Acta , 2015, 450 : 282–297. DOI:10.1016/j.cca.2015.08.021 |
| [8] | Mckenna MC, Dienel GA, Sonnewald U, et al. Energy metabolism of the brain[M]//Siegel GJ, Albers RW, Price DL. Basic neurochemistry. 8 th ed. New York:Academic Press, 2012:200-231. |
| [9] | Bélanger M, Allaman I, Magistretti PJ. Brain energy metabolism:focus on astrocyte-neuron metabolic cooperation[J]. Cell Metab , 2011, 14 (6) : 724–738. DOI:10.1016/j.cmet.2011.08.016 |
| [10] | Drury PP, Bennet L, Gunn AJ. Mechanisms of hypothermic neuroprotection[J]. Semin Fetal Neonatal Med , 2010, 15 (5) : 287–292. DOI:10.1016/j.siny.2010.05.005 |
| [11] | Silveira RC, Procianoy RS. Hypothermia therapy for newborns with hypoxic ischemic encephalopathy[J]. J Pediatr (Rio J) , 2015, 91 (6 Suppl 1) : S78–S83. |
| [12] | Dickinson H, Ellery S, Ireland Z, et al. Creatine supplementation during pregnancy:summary of experimental studies suggesting a treatment to improve fetal and neonatal morbidity and reduce mortality in high-risk human pregnancy[J]. BMC Pregnancy Childbirth , 2014, 14 : 150. DOI:10.1186/1471-2393-14-150 |
| [13] | Tagin MA, Woolcott CG, Vincer MJ, et al. Hypothermia for neonatal hypoxic ischemic encephalopathy:an updated systematic review and meta-analysis[J]. Arch Pediatr Adolesc Med , 2012, 166 (6) : 558–566. |
| [14] | Perlman JM, Wyllie J, Kattwinkel J, et al. Part 7:Neonatal resuscitation:2015 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations[J]. Circulation , 2015, 132 (16 Suppl 1) : S204–S241. DOI:10.1161/CIR.0000000000000276 |
| [15] | Trays G, Banerjee S. Fetal and neonatal hyperthermia[J]. Paediatr Child Health , 2014, 24 (9) : 419–423. DOI:10.1016/j.paed.2014.01.005 |
| [16] | Jacobs SE, Berg M, Hunt R, et al. Cooling for newborns with hypoxic ischaemic encephalopathy[J]. Cochrane Database Syst Rev , 2013 (1) : CD003311. |
| [17] | Sarkar S, Barks JD. Systemic complications and hypothermia[J]. Semin Fetal Neonatal Med , 2010, 15 (5) : 270–275. DOI:10.1016/j.siny.2010.02.001 |
| [18] | Robertson NJ, Tan S, Groenendaal F, et al. Which neuroprotective agents are ready for bench to bedside translation in the newborn infant?[J]. J Pediatr , 2012, 160 (4) : 544–552. DOI:10.1016/j.jpeds.2011.12.052 |
| [19] | Broad KD, Fierens I, Fleiss B, et al. Inhaled 45-50% argon augments hypothermic brain protection in a piglet model of perinatal asphyxia[J]. Neurobiol Dis , 2016, 87 : 29–38. DOI:10.1016/j.nbd.2015.12.001 |
| [20] | Loetscher PD, Rossaint J, Rossaint R, et al. Argon:neuroprotection in in vitro models of cerebral ischemia and traumatic brain injury[J]. Crit Care , 2009, 13 (6) : R206. DOI:10.1186/cc8214 |
| [21] | Obel LF, Müller MS, Walls AB, et al. Brain glycogen-new perspectives on its metabolic function and regulation at the subcellular level[J]. Front Neuroenergetics , 2012, 4 : 3. |
| [22] | Mlody B, Lorenz C, Inak G, et al. Energy metabolism in neuronal/glial induction and in iPSC models of brain disorders[J]. Semin Cell Dev Biol , 2016, 52 : 102–109. DOI:10.1016/j.semcdb.2016.02.018 |
| [23] | Shulman RG, Rothman DL, Behar KL, et al. Energetic basis of brain activity:implications for neuroimaging[J]. Trends Neurosci , 2004, 27 (8) : 489–495. DOI:10.1016/j.tins.2004.06.005 |
| [24] | Ellery SJ, Dickinson H, McKenzie M, et al. Dietary interventions designed to protect the perinatal brain from hypoxic-ischemic encephalopathy-Creatine prophylaxis and the need for multi-organ protection[J]. Neurochem Int , 2016, 95 : 15–23. DOI:10.1016/j.neuint.2015.11.002 |
| [25] | Allah Yar R, Akbar A, Iqbal F. Creatine monohydrate supplementation for 10 weeks mediates neuroprotection and improves learning/memory following neonatal hypoxia ischemia encephalopathy in female albino mice[J]. Brain Res , 2015, 1595 : 92–100. DOI:10.1016/j.brainres.2014.11.017 |
| [26] | Iqbal S, Ali M, Iqbal F. Long term creatine monohydrate supplementation, following neonatal hypoxic ischemic insult, improves neuromuscular coordination and spatial learning in male albino mouse[J]. Brain Res , 2015, 1603 : 76–83. DOI:10.1016/j.brainres.2014.10.006 |
| [27] | Iqbal S, Ali M, Akbar A, et al. Effects of dietary creatine supplementation for 8 weeks on neuromuscular coordination and learning in male albino mouse following neonatal hypoxic ischemic insult[J]. Neurol Sci , 2015, 36 (5) : 765–770. DOI:10.1007/s10072-014-2041-9 |
| [28] | Ellery SJ, LaRosa DA, Kett MM, et al. Maternal creatine homeostasis is altered during gestation in the spiny mouse:is this a metabolic adaptation to pregnancy?[J]. BMC Pregnancy Childbirth , 2015, 15 : 92. DOI:10.1186/s12884-015-0524-1 |
| [29] | Ireland Z, Dickinson H, Snow R, et al. Maternal creatine:does it reach the fetus and improve survival after an acute hypoxic episode in the spiny mouse (Acomys cahirinus)?[J]. Am J Obstet Gynecol , 2008, 198 (4) : 431. |
| [30] | Ireland Z, Castillo-Melendez M, Dickinson H, et al. A maternal diet supplemented with creatine from mid-pregnancy protects the newborn spiny mouse brain from birth hypoxia[J]. Neuroscience , 2011, 194 : 372–379. DOI:10.1016/j.neuroscience.2011.05.012 |
| [31] | Dickinson H, Ellery S, Ireland Z, et al. Creatine supplementation during pregnancy:summary of experimental studies suggesting a treatment to improve fetal and neonatal morbidity and reduce mortality in high-risk human pregnancy[J]. BMC Pregnancy Childbirth , 2014, 14 : 150. DOI:10.1186/1471-2393-14-150 |
| [32] | Dolder M, Walzel B, Speer O, et al. Inhibition of the mitochondrial permeability transition by creatine kinase substrates[J]. J Biol Chem , 2003, 278 (20) : 17760–17766. DOI:10.1074/jbc.M208705200 |
| [33] | Meyer LE, Machado LB, Santiago AP, et al. Mitochondrial creatine kinase activity prevents reactive oxygen species generation:antioxidant role of mitochondrial kinase-dependent ADP re-cycling activity[J]. J Biol Chem , 2006, 281 (49) : 37361–37371. DOI:10.1074/jbc.M604123200 |
| [34] | Guidi C, Potenza L, Sestili P, et al. Differential effect of creatine on oxidatively-injured mitochondrial and nuclear DNA[J]. Biochim Biophys Acta , 2008, 1780 (1) : 16–26. DOI:10.1016/j.bbagen.2007.09.018 |
| [35] | Turner CE, Byblow WD, Gant N. Creatine supplementation enhances corticomotor excitability and cognitive performance during oxygen deprivation[J]. J Neurosci , 2015, 35 (4) : 1773–1780. DOI:10.1523/JNEUROSCI.3113-14.2015 |
| [36] | Sartini S, Lattanzi D, Ambrogini P, et al. Maternal creatine supplementation affects the morpho-functional development of hippocampal neurons in rat offspring[J]. Neuroscience , 2016, 312 : 120–129. DOI:10.1016/j.neuroscience.2015.11.017 |
| [37] | Andres RH, Ducray AD, Schlattner U, et al. Functions and effects of creatine in the central nervous system[J]. Brain Res Bull , 2008, 76 (4) : 329–343. DOI:10.1016/j.brainresbull.2008.02.035 |
| [38] | Poortmans J, Francaux M. Adverse effects of creatine supplementation:fact or fiction?[J]. Sports Med , 2000, 30 (3) : 155–170. DOI:10.2165/00007256-200030030-00002 |
| [39] | Dickinson H, Bain E, Wilkinson D, et al. Creatine for women in pregnancy for neuroprotection of the fetus[J]. Cochrane Database Syst Rev , 2014 (12) : CD010846. |
| [40] | EL Andaloussi S, Mäger I, Breakefield XO, et al. Extracellular vesicles:biology and emerging therapeutic opportunities[J]. Nat Rev Drug Discov , 2013, 12 (5) : 347–357. DOI:10.1038/nrd3978 |
| [41] | Colombo M, Raposo G, Théry C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles[J]. Annu Rev Cell Dev Biol , 2014, 30 : 255–289. DOI:10.1146/annurev-cellbio-101512-122326 |
| [42] | Zappulli V, Friis KP, Fitzpatrick Z, et al. Extracellular vesicles and intercellular communication within the nervous system[J]. J Clin Invest , 2016, 126 (4) : 1198–1207. DOI:10.1172/JCI81134 |
| [43] | Baulch JE, Acharya MM, Allen BD, et al. Cranial grafting of stem cell-derived microvesicles improves cognition and reduces neuropathology in the irradiated brain[J]. Proc Natl Acad Sci U S A , 2016, 113 (17) : 4836–4841. DOI:10.1073/pnas.1521668113 |
| [44] | Ophelders DR, Wolfs TG, Jellema RK, et al. Mesenchymal stromal cell-derived extracellular vesicles protect the fetal brain after hypoxia-ischemia[J]. Stem Cells Transl Med , 2016, 5 (6) : 754–763. DOI:10.5966/sctm.2015-0197 |
| [45] | Arslan F, Lai RC, Smeets MB, et al. Mesenchymal stem cellderived exosomes increase ATP levels, decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury[J]. Stem Cell Res , 2013, 10 (3) : 301–312. DOI:10.1016/j.scr.2013.01.002 |
| [46] | Lindoso RS, Collino F, Bruno S, et al. Extracellular vesicles released from mesenchymal stromal cells modulate miRNA in renal tubular cells and inhibit ATP depletion injury[J]. Stem Cells Dev , 2014, 23 (15) : 1809–1819. DOI:10.1089/scd.2013.0618 |
| [47] | Xin H, Li Y, Cui Y, et al. Systemic administration of exosomes released from mesenchymal stromal cells promote functional recovery and neurovascular plasticity after stroke in rats[J]. J Cereb Blood Flow Metab , 2013, 33 (11) : 1711–1715. DOI:10.1038/jcbfm.2013.152 |
| [48] | Zhang Y, Chopp M, Meng Y, et al. Effect of exosomes derived from multipluripotent mesenchymal stromal cells on functional recovery and neurovascular plasticity in rats after traumatic brain injury[J]. J Neurosurg , 2015, 122 (4) : 856–867. DOI:10.3171/2014.11.JNS14770 |
 2016, Vol. 18
2016, Vol. 18