哮喘是由嗜酸性粒细胞、肥大细胞及多种细胞因子等共同作用,以气道慢性炎症浸润、气道重塑及可逆性气流受限为特征的慢性呼吸系统疾病[1],至今发病机制并不完全清楚。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种高度保守的丝氨酸/苏氨酸蛋白激酶,由于处于生长调节的中心环节而倍受关注,在炎症损伤、免疫应答及肿瘤等方面发挥重要作用[2-3]。研究发现mTOR高表达也同样存在于哮喘中,这可能因为mTOR参与了哮喘气道炎症浸润及气道重塑等病理过程[4],而 mTOR 抑制剂雷帕霉素能阻断这一过程抑制哮喘的发生,但mTOR是如何通过下游靶蛋白参与哮喘的发生少见相关报道。真核生物始动因子4E结合蛋白1(eukaryote initiating factor 4E binding protein 1,4EBP1)是mTOR下游的一个重要靶蛋白,激活后可促进包括缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、血管内皮生长因子(vascular endothelial growth factor,VEGF)在内的调节细胞生长关键蛋白的翻译[5],研究发现HIF-1α及VEGF在哮喘发生中发挥重要作用[6-8],由此我们推测 mTOR可能通过激活4EBP1从而引起 HIF-1α及VEGF表达增加促进哮喘发生,而磷酸化的mTOR、4EBP1(即 p-mTOR、p-4EBP1)被认为是该信号通路激活的标志,本研究通过建立小鼠哮喘模型,检测肺组织p-mTOR、p-4EBP1及肺泡灌洗液中HIF-1α、VEGF的表达,从而进一步明确哮喘的发病机制,寻找有效治疗哮喘的新方法。
1 材料与方法 1.1 实验动物与试剂SPF级6~8周龄雌性Balb/c小鼠40只,体重为18~22 g,由河南省动物实验中心提供。p-mTOR、 p-4EBP1 抗体(美国Santa Cruz 公司),雷帕霉素、卵清蛋白(OVA)(美国Sigma 公司)。
1.2 动物模型制备与分组按随机数字表法将40只小鼠分为对照组、哮喘组、布地奈德干预组、雷帕霉素干预组,每组10只。模型制作参照文献[4]并加以改进:哮喘组、布地奈德干预组、雷帕霉素干预组小鼠均于第1、8、15 天用OVA(100 μg)+氢氧化铝(1 mg)混悬液 0.2 mL腹腔注射行基础致敏,对照组用生理盐水0.2 mL代替;自第22天开始,用2% OVA雾化吸入进行激发,每日1次,共10次,对照组以生理盐水代替OVA进行激发;每次激发前30 min,雷帕霉素干预组给予雷帕霉素 3 mg/kg腹腔注射,布地奈德干预组给予雾化吸入1 mg布地奈德混悬液,而哮喘组和对照组均给予等量生理盐水进行替代。末次激发24 h后颈椎脱臼处死小鼠,打开胸腔,用改良后的22 G留置针行气管插管,结扎左侧主支气管,以磷酸盐缓冲液灌洗0.5 mL×3次,收集肺泡灌洗液(BALF)并混匀。收集的BALF离心后取上清液于-80℃冰箱内保存待测。
1.3 小鼠BALF中HIF-1α及VEGF含量测定采用酶联免疫吸附法(ELISA)测定HIF-1α、VEGF的表达,实验步骤按试剂盒说明书进行。
1.4 肺组织病理改变取肺组织常规制作石蜡切片后,行苏木精-伊红(HE)染色,显微镜下观察肺组织病理改变。
1.5 免疫组化染色检测各组小鼠肺组织 p-mTOR及p-4EBP1的表达取肺组织常规制作石蜡切片,采用链霉菌抗生物素蛋白-过氧化物酶连结法进行检测。p-mTOR、p-4EBP1以细胞质或细胞核出现棕黄染色判定为阳性细胞,采用软件(Image-pro Plus 6.0)测定p-mTOR、p-4EBP1阳性表达的总积分光密度值(IOD),每份标本随机取3张切片,每张切片随机观察5个高倍镜视野,取其平均值为表达结果。
1.6 Western blot法检测各组小鼠肺组织p-mTOR及p-4EBP1的表达取200 mg肺组织用RIPA细胞裂解液研磨裂解并离心,取上清液测蛋白浓度。样本经 SDS-PAGE电泳分离后转移至硝酸纤维素滤膜上,经5%脱脂奶粉PBST溶液室温下封闭2 h后分别加入一抗、二抗孵育。洗膜后暗室中加ECL发光试剂曝光、显色。应用β-actin作为内参照,结果以目的蛋白与内参蛋白表达比值表示。
1.7 统计学分析采用SPSS 21.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间的比较经方差齐性检验后采用单因素方差分析,组间两两比较采用SNK-q检验;相关分析采用 Pearson 直线相关分析,P<0.05为差异有统计学意义。
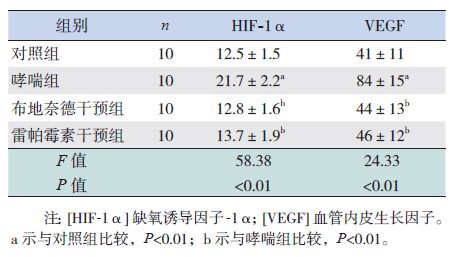
2 结果 2.1 ELISA法检测各组小鼠 BALF 中 HIF-1α及VEGF水平哮喘组小鼠BALF中HIF-1α、VEGF水平均显著高于对照组、布地奈德干预组及雷帕霉素干预组(P<0.01),而对照组与两干预组间相比,HIF-1α、VEGF水平差异无统计学意义(P>0.05),见表 1。
| 表 1 各组小鼠BALF中HIF-1α及VEGF水平比较(x±s,pg/mL) |
2.2 各组小鼠肺组织病理学改变
对照组小鼠肺组织HE染色示支气管壁结构光滑完整,上皮细胞排列整齐,气道壁厚度适中,少量炎性细胞浸润;哮喘组小鼠肺组织HE染色示气管及其周围炎性细胞尤其是嗜酸性粒细胞等浸润明显,黏膜下水肿,皱襞增多,黏液分泌物增多,气道平滑肌肥大,管壁及基底膜增厚不规则。而布地奈德干预组及雷帕霉素干预组小鼠肺组织上述病理改变明显减轻。以上差异提示建立哮喘模型成功,且干预治疗有效。见图 1。
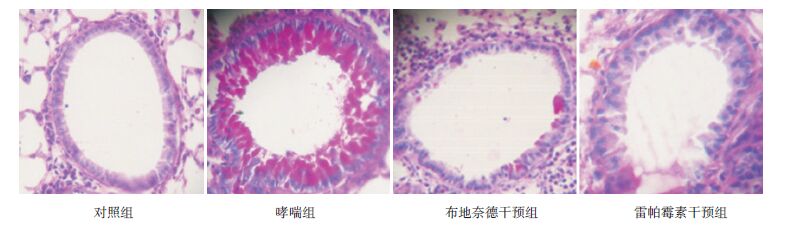
|
图 1 各组小鼠肺组织病理学改变(苏木精 - 伊红染色,×200) 对照组小鼠支气管壁结构光滑完整,上皮细胞排列整齐,气道壁厚度适中,少量炎性细胞浸润;哮喘组小鼠气管及其周围炎性细胞浸润明显,黏膜下水肿,皱襞增多,黏液分泌物增多,气道平滑肌肥大,管壁及基底膜增厚不规则;布地奈德干预组及雷帕霉素干预组气管周围可见少量炎性细胞浸润,气管内少量黏液分泌物,气道壁稍增厚。 |
2.3 免疫组织化学法检测各组小鼠肺组织p-mTOR及p-4EBP1的表达
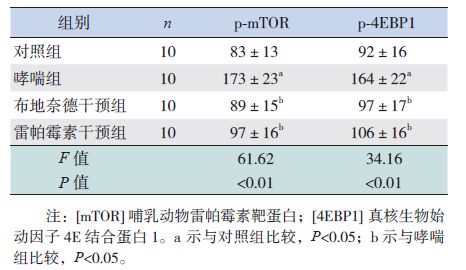
p-mTOR、p-4EBP1在哮喘组小鼠气道平滑肌均呈深棕黄色强免疫反应表达,在对照组小鼠支气管呈淡棕黄色弱免疫反应表达,两组比较差异有统计学意义(P<0.01)。与哮喘组比较,经雷帕霉素或布地奈德干预后,小鼠气道平滑肌 p-mTOR、p-4EBP1蛋白表达明显减弱(P<0.01)。对照组与两干预组间两两比较差异均无统计学意义(P>0.05)。见图 2,表 2。
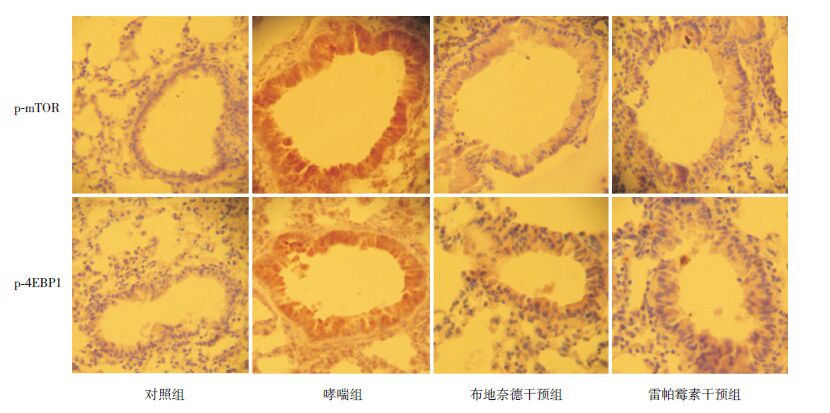
|
图 2 各组小鼠p-mTOR及p-4EBP1在肺组织内的表达(免疫组织化学染色,×200) p-mTOR及p-4EBP1在对照组小鼠肺组织中呈淡棕黄色弱免疫反应表达,在哮喘组小鼠肺组织中呈深棕黄色强免疫反应表达,经布地奈德及雷帕霉素干预后,两组小鼠肺组织p-mTOR、p-4EBP1的表达较哮喘组均减弱。 |
| 表 2 各组小鼠p-mTOR 及p-4EBP1 表达水平比较 (x±s,IOD) |
2.4 Western blot检测各组小鼠肺组织p-mTOR及p-4EBP1的表达
哮喘组小鼠肺组织中p-mTOR、p-4EBP1的表达均较对照组明显升高(P<0.01);与哮喘组相比,经雷帕霉素或布地奈德干预后,p-mTOR、p-4EBP1表达均下降(P<0.01);而雷帕霉素干预组、布地奈德干预组及对照组间两两比较差异均无统计学意义(P>0.05)。见图 3。
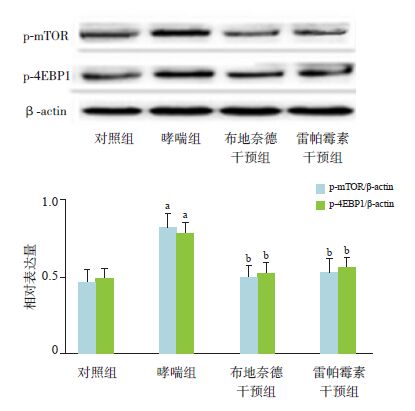
|
图 3 Western blot检测各组小鼠肺组织p-mTOR及p-4EBP1的表达比较 上图为蛋白电泳条带图;下图为统计图(n=10)。a示与对照组比较,P<0.01;b示与哮喘组比较,P<0.01。 |
2.5 相关性分析
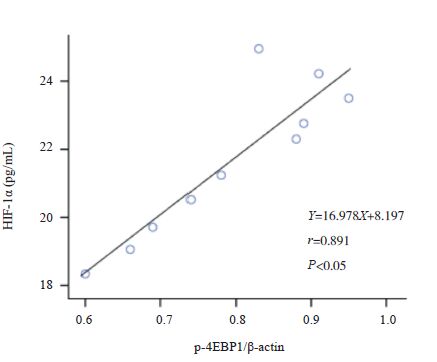
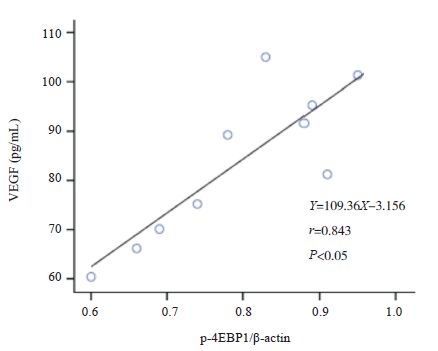
哮喘组小鼠肺组织p-mTOR的表达与肺组织p-4EBP1及BALF中HIF-1α、VEGF的表达水平分别呈正相关(分别r=0.921、0.924、0.887,P<0.05),哮喘组小鼠肺组织p-4EBP1的表达与BALF中HIF-1α、VEGF的表达水平分别呈正相关(分别r=0.891、0.843,P<0.05),哮喘组小鼠BALF中HIF-1α与VEGF的表达水平呈正相关(r=0.875,P<0.05)(图 4~9)。余各组各检测指标间不具有相关性(P>0.05)。
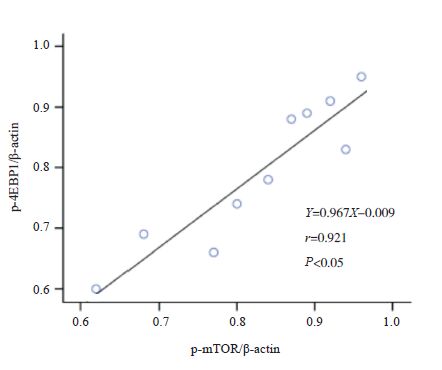
|
图 4 哮喘组小鼠肺组织p-mTOR蛋白与p-4EBP1蛋白表达相关性分析 |
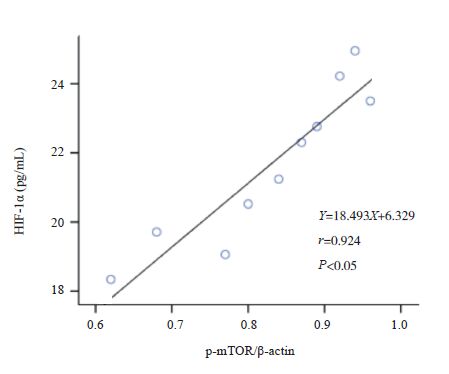
|
图 5 哮喘组小鼠肺组织p-mTOR蛋白表达与 BALF中HIF-1α表达水平相关分析图 |
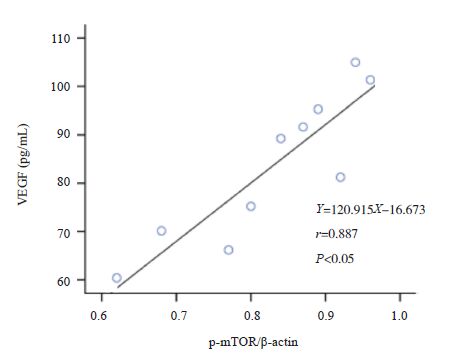
|
图 6 哮喘组小鼠肺组织p-mTOR蛋白表达与BALF中VEGF表达水平相关分析图 |
|
图 7 哮喘组小鼠肺组织p-4EBP1蛋白表达与 BALF中HIF-1α表达水平相关分析图 |
|
图 8 哮喘组小鼠肺组织p-4EBP1蛋白表达与BALF中VEGF表达水平相关分析图 |

|
图 9 哮喘组小鼠 BALF中HIF-1α与VEGF表达水平相关分析图 |
3 讨论
哮喘的发病机制一直是研究的热点,气道炎症浸润及气道重塑是哮喘的重要特征[1],但具体机制未完全明确。已有研究发现哮喘时存在mTOR的高表达,可能参与哮喘气道重塑的过程[4],查阅国内外文献发现目前关于mTOR相关信号通路在哮喘中的影响多集中在mTOR及其上游信号通路,而其下游信号是如何发挥作用的研究较少。4EBP1是mTOR下游的一个直接靶点,通过整合内外环境信号被激活的mTOR可进一步磷酸化4EBP1而使后者活化发挥其一系列的病理生理作用[5]。雷帕霉素是目前研究最多的mTOR抑制剂,其可以减弱气道的高反应性,减轻如嗜酸性粒细胞、杯状细胞及其分泌的多种细胞因子等引起的气道炎性浸润,抑制气道重塑[9-10]。与上述研究一致,本研究中采用免疫组化及免疫印迹法发现哮喘组小鼠肺组织中p-mTOR、p-4EBP1均较对照组明显升高,提示哮喘时存在mTOR/4EBP1的激活,同时发现给予布地奈德或雷帕霉素干预后p-mTOR、p-4EBP1的表达较哮喘组明显下降,而且HE染色发现布地奈德干预组和雷帕霉素干预组小鼠肺组织炎性细胞浸润、黏膜下水肿及气道平滑肌的增厚等病理改变均较哮喘组明显减轻,而两干预组间p-mTOR、p-4EBP1的表达无明显差别,病理改变也无显著差别。由此推测激活的 mTOR/4EBP1可能在促进哮喘的气道炎症浸润及气道重塑等方面发挥重要作用,而雷帕霉素可通过阻断mTOR及其下游信号有效抑制哮喘的发生,更证实雷帕霉素可作为哮喘的候选治疗这一推测。但也有研究发现雷帕霉素对减轻过敏性气道炎症和抑制气道的高反应性并无影响[11],以往的研究多只利用雷帕霉素干预观察对哮喘模型鼠的影响,并未深入探讨其具体的作用机制,两种结果的不一致,考虑可能与雷帕霉素干预的时间及方式等不同有关。
HIF-1α是存在于所有哺乳动物细胞中的一种氧依赖性的转录激活因子,可以调节100 多种功能基因,其主要在缺氧条件下表达,在免疫和炎症反应中起着重要作用[12]。VEGF是内皮细胞特异性有丝分裂肽,可调节血管生成,参与炎症反应。已有研究证明,HIF-1α及 VEGF的过度表达参与发展过敏性气道炎症[13-14]。本研究亦发现在哮喘组小鼠BALF中 HIF-1α、VEGF的表达明显高于对照组,而经布地奈德或雷帕霉素干预后两者的表达明显下降。Crotty Alexander等[6] 研究发现HIF-1α可使嗜酸性粒细胞、肥大细胞、巨噬细胞等在过敏性气道炎症中发挥重要作用的细胞聚集浸润于气道,并活化分泌多种细胞因子,损伤气道上皮细胞,引起气道高反应及气道重塑等。Kim等[7]和Lee等[8]发现VEGF作为HIF-1α下游的一个靶蛋白在过敏性气道疾病中能强烈刺激炎症并使血管通透性增加,血浆外渗,诱使气道壁充血水肿、管腔变窄,参与气道重塑。结合本研究中哮喘组小鼠肺组织经HE染色较对照组明显可见气管及其周围炎症细胞尤其是嗜酸性粒细胞浸润明显、分泌物增多、气道壁增厚等病理改变,进一步证实HIF-1α、VEGF协同促进哮喘时的炎症细胞浸润,尤其是嗜酸性粒细胞及气道重塑等,在哮喘的发生中发挥重要作用。
HIF-1α、VEGF是mTOR/4EBP1下游两个重要的效应分子,活化的4EBP1可进一步促进HIF-1α、VEGF翻译的增加[9],由此构成mTOR/4EBP1/HIF-1α/VEGF信号通路,查阅国外文献发现该信号通路在肿瘤及血管生成等方面发挥重要作用[15],在过敏性气道炎症中mTOR 亦可通过调节HIF-1α影响VEGF的表达[16],本研究发现哮喘组p-mTOR、p-4EBP1、HIF-1α、VEGF两两互呈正相关,而在对照组及各干预组无此相关性,且给予mTOR抑制剂雷帕霉素干预后小鼠BALF中HIF-1α、VEGF明显下降,由此推测mTOR/4EBP1/HIF-1α/VEGF信号通路在哮喘的发生发展中发挥重要协同作用。哮喘发生时mTOR、4EBP1激活,p-mTOR、p-4EBP1与HIF-1α、VEGF表达水平均明显升高,从而使嗜酸性粒细胞、巨噬细胞等炎症细胞及细胞因子聚集参与气道炎症、气道重塑等过程,促进哮喘的发生发展,而雷帕霉素能阻断这一过程成为理论上治疗哮喘的一个潜在靶点。至于mTOR/4EBP1/HIF-1α/VEGF信号通路在哮喘发生中更具体的机制还需要进一步研究。
| [1] | Ferkol T, Schraufnagel D. The global burden of respiratory disease[J]. Ann Am Thorac Soc, 2014, 11 (3): 404–406. DOI:10.1513/AnnalsATS.201311-405PS |
| [2] | Lee GK, Shin H, Lim HJ. Rapamycin influences the efficiency of in vitro fertilization and development in the mouse:a role for autophagic activation[J]. Asian-Australas J Anim Sci, 2016, 29 (8): 1102–1110. |
| [3] | 朱广倍, 周维英, 蔡家利. mTOR调节免疫细胞分化与功能的研究进展[J]. 免疫学杂志, 2016, 32 (2): 173–176. |
| [4] | 罗云海, 欧立文, 李晓玲. 哮喘大鼠气道中雷帕霉素靶蛋白的表达对气道重塑的影响[J]. 实用医学杂志, 2013, 29 (2): 190–192. |
| [5] | Mi C, Ma J, Shi H, et al. 4',6-dihydroxy-4-methoxyisoaurone inhibits the HIF-1α pathway through inhibition of Akt/mTOR/p70S6K/4E-BP1 phosphorylation[J]. J Pharmacol Sci, 2014, 125 (2): 193–201. DOI:10.1254/jphs.13273FP |
| [6] | Crotty Alexander LE, Akong-Moore K, Feldstein S, et al. Myeloid cell HIF-1α regulates asthma airway resistance and eosinophil function[J]. J Mol Med (Berl), 2013, 91 (5): 637–644. DOI:10.1007/s00109-012-0986-9 |
| [7] | Kim SR, Lee KS, Park HS, et al. HIF-1α inhibition ameliorates an allergic airway disease via VEGF suppression in bronchial epithelium[J]. Eur J Immunol, 2010, 40 (10): 2858–2869. DOI:10.1002/eji.200939948 |
| [8] | Lee CG, Ma B, Takyar S, et al. Studies of vascular endothelial growth factor in asthma and chronic obstructive pulmonary disease[J]. Proc Am Thorac Soc, 2011, 8 (6): 512–515. DOI:10.1513/pats.201102-018MW |
| [9] | Mushaben EM, Kramer EL, Brandt EB, et al. Rapamycin attenuates airway hyperreactivity, goblet cells, and IgE in experimental allergic asthma[J]. J Immunol, 2011, 187 (11): 5756–5763. DOI:10.4049/jimmunol.1102133 |
| [10] | Kramer EL, Hardie WD, Mushaben EM, et al. Rapamycin decreases airway remodeling and hyperreactivity in a transgenic model of noninflammatory lung disease[J]. J Appl Physiol (1985), 2011, 111 (6): 1760–1767. DOI:10.1152/japplphysiol.00737.2011 |
| [11] | Eynott PR, Salmon M, Huang TJ, et al. Effects of cyclosporin A and a rapamycin derivative (SAR943) on chronic allergic inflammation in sensitized rats[J]. Immunology, 2003, 109 (3): 461–467. DOI:10.1046/j.1365-2567.2003.01672.x |
| [12] | Mo JH, Kim JH, Lim DJ, et al. The role of hypoxia-inducible factor 1α in allergic rhinitis[J]. Am J Rhinol Allergy, 2014, 28 (2): e100–e106. DOI:10.2500/ajra.2014.28.4025 |
| [13] | Huerta-Yepez S, Baay-Guzman GJ, Bebenek IG, et al. Hypoxia inducible factor promotes murine allergic airway inflammation and is increased in asthma and rhinitis[J]. Allergy, 2011, 66 (7): 909–918. DOI:10.1111/all.2011.66.issue-7 |
| [14] | Yuksel H, Yilmaz O, Karaman M, et al. Role of vascular endothelial growth factor antagonism on airway remodeling in asthma[J]. Ann Allergy Asthma Immunol, 2013, 110 (3): 150–155. DOI:10.1016/j.anai.2012.12.015 |
| [15] | Chen MC, Hsu WL, Hwang PA, et al. Low molecular weight fucoidan inhibits tumor angiogenesis through downregulation of HIF-1/VEGF signaling under hypoxia[J]. Mar Drugs, 2015, 13 (7): 4436–4451. DOI:10.3390/md13074436 |
| [16] | Choi YH, Jin GY, Li LC, et al. Inhibition of protein kinase C delta attenuates allergic airway inflammation through suppression of PI3K/Akt/mTOR/HIF-1 alpha/VEGF pathway[J]. PLoS One, 2013, 8 (11): e81773. DOI:10.1371/journal.pone.0081773 |
 2017, Vol. 19
2017, Vol. 19