肺炎链球菌(Streptococcus pneumoniae,SP)是引起鼻窦炎、急性中耳炎的最常见病因,更是导致婴幼儿脑膜炎、菌血症、肺炎等严重疾病的首要病原菌[1]。SP感染性疾病是全球5岁以下儿童高居第一位的死亡病因[2]。临床抗生素大量经验性应用,耐药情况日趋加重。短腭、肺及鼻咽上皮克隆1(short palate,lung,and nasal epithelium clone 1,SPLUNC1)是新近发现具有抗菌活性的天然免疫蛋白,由呼吸道上皮细胞分泌,研究证实,细菌暴露后,SPLUNC1可对其结合包裹,通过调节离散小孔的形成增加细菌细胞膜通透性,抑制细菌生长,随感染加重,SPLUNC1可驱动中性粒细胞及巨噬细胞的迁移,启动适应性免疫反应,相关炎症因子的分泌又可抑制SPLUNC1的表达[3-6]。白藜芦醇(resveratrol,Res)提取自虎杖根茎,是最强的天然SIRT1激活剂,能通过抑制NF-κB在机体免疫防御系统起抗炎作用[7-9]。我们推测Res预处理BEAS-2B细胞,可以通过抑制NF-κB炎症信号通路,下调相关炎症因子,影响SPLUNC1的表达。SP感染领域SPLUNC1、Res研究甚少,Res对 SPLUNC1表达的影响更是尚无定论。本实验建立SP感染人支气管上皮细胞(BEAS-2B细胞)模型,以不同浓度Res预处理,在各感染时间点进行细胞活性、SPLUNC1表达量检测,探讨SP感染时SPLUNC1的宿主防御作用,及Res对SPLUNC1表达的影响,为SP感染性疾病的治疗提供新的思路。
1 材料与方法 1.1 细菌菌株和细胞株系SP(ATCC 49619)由首都医科大学附属北京儿童医院杨永弘教授馈赠。BEAS-2B细胞购自中科院上海细胞生物研究所细胞库。
1.2 主要试剂及仪器胎牛血清、DMEM培养基、胰蛋白酶(0.25%EDTA)(美国Gibco公司),TRIzol(美国Invitrogen公司),逆转录试剂盒(美国Fermentas公司),Lightcycle 480 SYBR GreenⅠMaster(美国Roche公司),Cell Counting Kit -8(CCK8)试剂盒(日本株式会社同仁化学研究所),Res(美国Sigma公司),SPLUNC1 ELISA试剂盒(上海酶研生物科技有限公司),哥伦比亚血琼脂培养基(温州康泰生物科技有限公司),奥普托欣试纸(杭州微生物试剂有限公司),PCR primer(上海捷瑞生物工程有限公司),二级生物安全柜(美国Forma公司),超净工作台、CO2培养箱(Heal Force90)(美国Thermo公司),实时荧光定量PCR仪(Lightcycle 480)(美国Roche公司),低温高速离心机(德国Hettich公司),酶标仪(ELX808IU)(美国Bio-Tek公司)。
1.3 BEAS-2B细胞培养BEAS-2B细胞分别接种于25 cm2培养瓶中,使细胞生长于含10% FBS的DMEM培养基,置37℃、5% CO2培养箱中培养,用胰蛋白酶(0.25% EDTA)常规消化传代。
1.4 细菌培养及菌悬液的制备用灭菌接种环将SP接种于哥伦比亚血琼脂平板,置于37℃、5%CO2培养箱中,传代2次至生长旺盛,用灭菌环刮取单个细菌菌落,接种至装有5 mL脑心浸液肉汤的玻璃试管中增菌,离心、洗涤、重悬细菌,取适量菌液加入含10% FBS的DMEM培养液中,用麦氏比浊仪调整菌悬液至所需浓度。
1.5 SP感染损伤BEAS-2B细胞及Res对BEAS-2B细胞活性的影响根据感染复数(MOI)不同将SP感染BEAS-2B细胞分为对照组、MOI20 SP组和MOI50 SP组;根据Res药物浓度不同将Res预处理MOI20 SP感染BEAS-2B细胞分为12.5Res+SP组、25Res+SP组、50Res+SP组。将BEAS-2B细胞按1×104个/孔接种于96孔板,置37℃、5% CO2培养箱中培养,待细胞生长至70%~80%融合,取出96孔板,用无菌PBS溶液冲洗细胞,分别向12.5Res+SP组、25Res+SP组、50Res+SP组加入Res(终浓度分别为12.5 μmol/L、25 μmol/L、50 μmol/L)无双抗培养液,余各组加入等量新鲜无双抗培养液,放置培养箱孵育24 h,取出96孔板,向MOI20 SP组、12.5Res+SP组、25Res+SP组、50Res+SP组加入菌悬液(MOI 20),向MOI50 SP组加入菌悬液(MOI 50),放置培养箱孵育,于感染后0、3、6、12、18 h取出相应96孔板,用于CCK8法检测细胞活力。以此就SP、Res不同作用浓度及时间对BEAS-2B细胞活性的影响进行分析讨论,并选出SP、Res最佳作用浓度及时间进行后续研究。
1.6 CCK8法检测细胞活力从培养箱中取出96孔板,用无菌PBS溶液冲洗细胞,向每孔加入新的培养基及10 μL CCK-8溶液。继续培养45 min,用酶标仪测定在450 nm处的吸光度。每组设6个复孔,实验独立重复3次。
1.7 SP诱导BEAS-2B细胞表达SPLUNC1及Res对SPLUNC1表达的影响实验分为对照组、Res组、SP组和Res+SP组。将BEAS-2B细胞按5×105个/皿接种于6 cm细胞培养皿中,置37℃、5% CO2培养箱中培养,待细胞生长至70%~80%融合,取出培养皿,用无菌PBS溶液冲洗细胞,向Res组及Res+SP组加入Res(终浓度25 μmol/L)无双抗培养液,余各组加入等量新鲜无双抗培养液,放置培养箱孵育24 h,向SP组和Res+SP组加入SP菌悬液(MOI 20),于感染后0、3、6 h,收集各组细胞培养上清液,用于ELISA检测SPLUNC1蛋白表达;无菌PBS溶液冲洗细胞,提取细胞总RNA,用于实时定量(qRT-PCR)检测SPLUNC1 mRNA水平。
1.8 qRT-PCR检测BEAS-2B细胞SPLUNC1 mRNA相对表达量按照试剂盒要求提取细胞总RNA并反转录成cDNA,最后进行qRT-PCR检测。反应体系为20 μL,包括cDNA 2 μL、SYBR 10 μL、上下游引物各1 μL、DEPC水6 μL。SPLUNC1基因上游引物序列为:5'-TGAGAGATAAGCAGGAGAGG-3',下游引物序列为:5'-AAGTCCATCAAGCAGAG-AAA-3',扩增产物大小为102 bp。内参基因β-actin上游引物序列为:5'-CTACCTCATGAAGATCCTCA-CCGA-3',下游引物序列为:5'-TTCTCCTTAATGTC-ACGCACGATT-3',扩增产物大小为84 bp。反应程序如下:95℃ 5 min;95℃10 s、60℃10 s、72℃10 s,45个循环。每组设3个平行样本,实验独立重复3次。数据以2-ΔΔCt进行分析。
1.9 ELISA法检测BEAS-2B细胞SPLUNC1蛋白表达量按照试剂盒要求收集细胞培养上清液,应用双抗体夹心法测定SPLUNC1蛋白表达量,最后使用酶标仪测定450 nm处吸光度值(OD值),绘制标准曲线,根据样本OD值确定实际浓度。每组设3个复孔,实验独立重复3次。
1.10 统计学分析采用SPSS 19.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
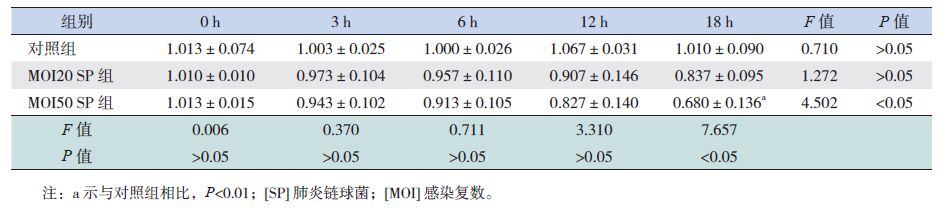
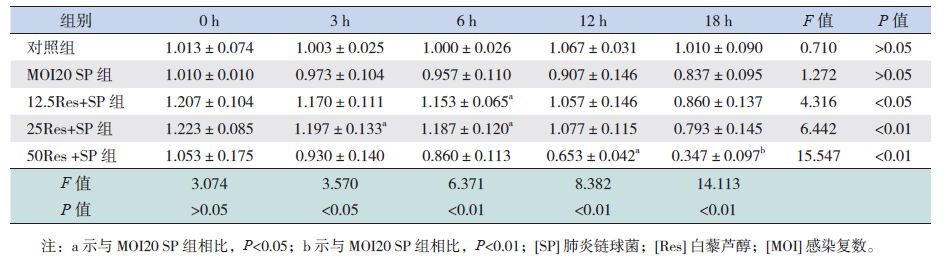
2 结果 2.1 SP感染损伤BEAS-2B细胞及Res对BEAS-2B细胞活性的影响以感染复数(MOI)不同将SP感染BEAS-2B细胞分为对照组、MOI20 SP组和MOI50 SP组;结果显示MOI50 SP组随感染时间延长,细胞活性显著降低(P<0.05);在感染后18 h时,与对照组相比,MOI50 SP组细胞活性显著降低(P<0.01);提示MOI50 SP组较MOI20 SP组细胞损伤更明显,SP感染对BEAS-2B细胞活性的影响具有时间及浓度依赖性(表 1)。根据Res药物浓度不同将Res预处理MOI20 SP感染BEAS-2B细胞分为12.5Res+SP组、25Res+SP组、50Res+SP组。结果显示不同浓度Res+SP组随时间延长,细胞活性显著降低(P<0.05);在3 h和6 h时,25 Res+SP组细胞活性显著高于MOI20 SP组(P<0.05),在12 h和18 h时,50Res+SP组细胞活性显著低于MOI20 SP组(P<0.05);提示RES预处理对SP感染BEAS-2B细胞活性的影响具有时间及浓度依赖性,低 Res可增强SP感染BEAS-2B细胞活性,而高浓度Res可抑制SP感染BEAS-2B细胞活性(表 2)。
| 表 1 SP感染对BEAS-2B细胞活性的影响 (x±s,n=3) |
| 表 2 Res预处理对SP感染BEAS-2B细胞活性的影响 (x±s,n=3) |
2.2 SP诱导BEAS-2B细胞表达SPLUNC1及Res对SPLUNC1表达的影响
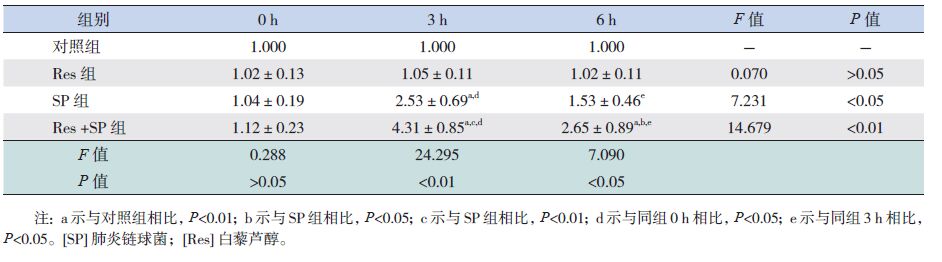
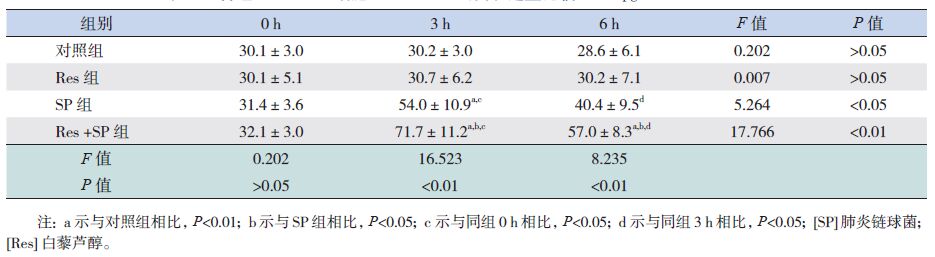
SP组和Res+SP组随感染时间延长,BEAS-2B细胞SPLUNC1 mRNA表达水平增高,3 h达到峰值,6 h下降(P<0.05);与SP组比较,Res+SP组SPLUNC1 mRNA表达水平在3 h和6 h均显著增高(P<0.05)(表 3)。与对照组相比,Res组SPLUNC1 mRNA表达稳定,随时间延长未见明显改变(P>0.05)(表 3)。各组SPLUNC1蛋白表达情况与SPLUNC1 mRNA表达水平变化相一致,见表 4。
| 表 3 各组BEAS-2B细胞SPLUNC1 mRNA相对表达量比较 (x±s,n=3) |
| 表 4 各组BEAS-2B细胞SPLUNC1蛋白表达量比较 (pg/mL,x±s,n=3) |
3 讨论
SP为革兰阳性菌,成双或短链状排列,电镜下菌体似矛头状,其致病性与其毒力因子密切相关,主要包括荚膜多糖、SP相关蛋白、细胞壁与细胞壁多糖[10-11]。本研究以MOI20、MOI50 SP分别感染BEAS-2B细胞,结果显示随感染时间延长,细胞活性降低,说明SP感染对BEAS-2B细胞的损伤具有时间依赖性,较MOI20组相比,MOI50组细胞损伤更显著,说明SP感染致细胞损伤具有浓度依赖性。故本研究选取MOI20 SP感染18 h内进行后续实验,期间细胞活性较对照组相比,差异无统计学意义,可以认为SP感染不影响细胞的正常生长,后续实验结果具有可比性。
SPLUNC1是具有抗菌活性的天然免疫蛋白质,研究证实,SPLUNC1可通过抑制病原体生长、增强呼吸道表面活性及促进纤毛清除等发挥先天免疫作用,并在必要时启动适应性免疫反应,有效抵御革兰阴性菌、肺炎支原体的侵袭[12-17]。本研究以MOI 20 SP感染人支气管上皮BEAS-2B细胞,qRT-PCR、ELISA结果均显示细胞SPLUNC1高水平表达,说明SP感染可以诱导SPLUNC1的表达。感染初期SPLUNC1分泌量相对较少,尚不能发挥细胞保护作用,直至3 h分泌达高峰,足以有效减少SP感染对细胞的损伤,维持细胞活性的稳定,SP感染3~6 h期间细胞活性趋于稳定,降低较缓慢,相关研究证实适应性免疫反应的激活可以抑制SPLUNC1的表达[4],随着SP感染加重,适应性免疫反应启动,SPLUNC1分泌受到抑制,细胞保护作用再次减弱,感染6 h SPLUNC1分泌明显减少,细胞损伤迅速加重。Britto等[4]研究显示革兰阴性菌感染后小鼠支气管肺泡灌洗液中SPLUNC1蛋白表达增加,达高峰后下降,而SPLUNC1 mRNA表达呈持续下降趋势,并无增加阶段,这与本次实验结果不一致,考虑与本研究为细胞体外培养,自身SPLUNC1 mRNA储存不足有关。本次实验SPLUNC1 mRNA与蛋白高峰同时出现,较mRNA表达相比,蛋白分泌并未滞后,可能与检测时间点设置略少有关,结果显示了先增高后减少的趋势,却未能捕捉到真正的高峰点。
Res属于非黄酮类多酚化合物,在抗炎、抗肿瘤、抗氧化、抗血小板聚集、抗动脉粥样硬化等多方面发挥作用[7-9]。本实验以不同浓度Res预处理BEAS-2B细胞,结果显示SP感染0 h时,各浓度Res+SP组较MOI20 SP组相比,细胞活性水平基本一致,差异无统计学意义,说明Res药物预处理不影响细胞的正常生长,后续实验结果具有可比性。SP感染后,25Res+SP组细胞活性增强,50Res+SP组显著降低,说明Res可以浓度依赖的方式发挥细胞保护作用。随SP感染时间延长,各组细胞活性均呈降低趋势,较MOI20 SP组相比,25Res+SP组6 h后下降更迅速,提示Res的细胞保护作用具有时间依赖性。故本研究选用25 μmol/L Res预处理BEAS-2B细胞,SP感染6 h内进行后续实验,期间Res具有显著的细胞保护作用。结果显示较SP组相比,Res+SP组SPLUNC1高水平表达,同期细胞活性更好,提示Res可以通过上调SPLUNC1的表达减少SP感染对细胞的损伤。较对照组相比,Res组SPLUNC1表达水平稳定,随时间延长未见明显变化,说明未感染SP状态下,Res不影响SPLUNC1的表达。
SPLUNC1制剂及Res相关药物的研发可能将为儿童SP感染性疾病的治疗提供新的思路,或许有助于减少抗生素的使用,改善抗生素耐药情况。
| [1] | Yao KH, Yang YH. Streptococcus pneumoniae diseases in Chinese children:past, present and future[J]. Vaccine, 2008, 26 (35): 4425–4433. DOI:10.1016/j.vaccine.2008.06.052 |
| [2] | Denapaite D, Brückner R, Hakenbeck R, et al. Biosynthesis of teichoic acids in Streptococcus pneumoniae and closely related species:lessons from genomes[J]. Microb Drug Resist, 2012, 18 (3): 344–358. DOI:10.1089/mdr.2012.0026 |
| [3] | McGillivary G, Bakaletz LO. The multifunctional host defense peptide SPLUNC1 is critical for homeostasis of the mammalian upper airway[J]. PLoS One, 2010, 5 (10): e13224. DOI:10.1371/journal.pone.0013224 |
| [4] | Britto CJ, Liu Q, Curran DR, et al. Short palate, lung, and nasal epithelial clone-1 is a tightly regulated airway sensor in innate and adaptive immunity[J]. Am J Respir Cell Mol Biol, 2013, 48 (6): 717–724. DOI:10.1165/rcmb.2012-0072OC |
| [5] | Di YP. Functional roles of SPLUNC1 in the innate immune response against Gram-negative bacteria[J]. Biochem Soc Trans, 2011, 39 (4): 1051–1055. DOI:10.1042/BST0391051 |
| [6] | Ning F, Wang C, Berry KZ, et al. Structural characterization of the pulmonary innate immune protein SPLUNC1 and identification of lipid ligands[J]. FASEB J, 2014, 28 (12): 5349–5360. DOI:10.1096/fj.14-259291 |
| [7] | Lee M, Kim S, Kwon OK, et al. Anti-inflammatory and anti-asthmatic effects of resveratrol, a polyphenolic stilbene, in a mouse model of allergic asthma[J]. Int Immunopharmacol, 2009, 9 (4): 418–424. DOI:10.1016/j.intimp.2009.01.005 |
| [8] | Miki H, Uehara N, Kimura A, et al. Resveratrol induces apoptosis via ROS-triggered autophagy in human colon cancer cells[J]. Int J Oncol, 2012, 40 (4): 1020–1028. |
| [9] | Yuan Y, Xue X, Guo RB, et al. Resveratrol enhances the antitumor effects of temozolomide in glioblastoma via ROS-dependent AMPK-TSC-mTOR signaling pathway[J]. CNS Neurosci Ther, 2012, 18 (7): 536–546. DOI:10.1111/j.1755-5949.2012.00319.x |
| [10] | Hathaway LJ, Brugger SD, Morand B, et al. Capsule type of Streptococcus pneumoniae determines growth phenotype[J]. PLoS Pathog, 2012, 8 (3): e1002574. DOI:10.1371/journal.ppat.1002574 |
| [11] | Blumental S, Granger-Farbos A, Moïsi JC, et al. Virulence factors of Streptococcus pneumoniae. Comparison between African and French invasive isolates and implication for future vaccines[J]. PLoS One, 2015, 10 (7): e0133885. DOI:10.1371/journal.pone.0133885 |
| [12] | Sayeed S, Nistico L, St Croix C, et al. Multifunctional role of human SPLUNC1 in Pseudomonas aeruginosa infection[J]. Infect Immun, 2013, 81 (1): 285–291. DOI:10.1128/IAI.00500-12 |
| [13] | Liu Y, Di ME, Chu HW, et al. Increased susceptibility to pulmonary Pseudomonas infection in Splunc1 knockout mice[J]. J Immunol, 2013, 191 (8): 4259–4268. DOI:10.4049/jimmunol.1202340 |
| [14] | Gally F, Di YP, Smith SK, et al. SPLUNC1 promotes lung innate defense against Mycoplasma pneumoniae infection in mice[J]. Am J Pathol, 2011, 178 (5): 2159–2167. DOI:10.1016/j.ajpath.2011.01.026 |
| [15] | Chu HW, Thaikoottathil J, Rino JG, et al. Function and regulation of SPLUNC1 protein in Mycoplasma infection and allergic inflammation[J]. J Immunol, 2007, 179 (6): 3995–4002. DOI:10.4049/jimmunol.179.6.3995 |
| [16] | Liu Y, Bartlett JA, Di ME, et al. SPLUNC1/BPIFA1 contributes to pulmonary host defense against Klebsiella pneumoniae respiratory infection[J]. Am J Pathol, 2013, 182 (5): 1519–1531. DOI:10.1016/j.ajpath.2013.01.050 |
| [17] | Hobbs CA, Blanchard MG, Alijevic O, et al. Identification of the SPLUNC1 ENaC-inhibitory domain yields novel strategies to treat sodium hyperabsorption in cystic fibrosis airway epithelial cultures[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 305 (12): L990–L1001. DOI:10.1152/ajplung.00103.2013 |
 2017, Vol. 19
2017, Vol. 19