患儿,男,3岁9个月,因发热20 d入院。患儿入院前20 d受凉后出现不规则发热,热峰39.5℃左右,伴阵发性腹痛(脐周为主),无咳嗽、咳痰、流涕,无寒颤、抽搐、惊厥,无皮疹、关节疼痛,无头痛、恶心、呕吐等,在当地医院予以抗感染(具体用药不详)治疗,效果欠佳。起病以来,患儿神志清楚、热退后精神、食欲可,大小便正常。
既往体健。出生史、喂养史、生长发育史、家族史均无特殊。
入院体查:体温39.0℃,脉搏132次/min,呼吸26次/min,血压96/62 mm Hg,体重15 kg。神志清楚,精神差,全身皮肤无苍白、黄染、色素脱失斑及出血点,颈部及腹股沟可触及数个肿大淋巴结,最大约2 cm×1 cm,质中,无压痛,活动度可。球结膜无充血,眼球无震颤,瞳孔等大等圆、对光反射灵敏。口唇无发绀,口腔黏膜无破溃,无异常分泌物,咽充血,双侧扁桃体Ⅱ°肿大。心肺无异常。腹平软,肝脏肋缘下约3 cm、剑突下约4 cm,脾肋下约3.5 cm,质韧、界清、无压痛,肠鸣音正常。脊柱四肢无畸形。肛门外生殖器无异常,神经系统体查无异常。
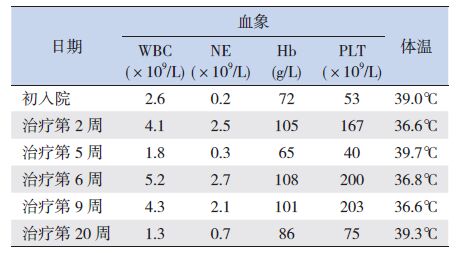
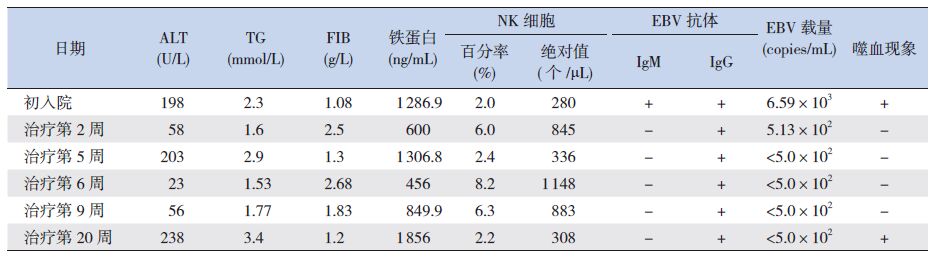
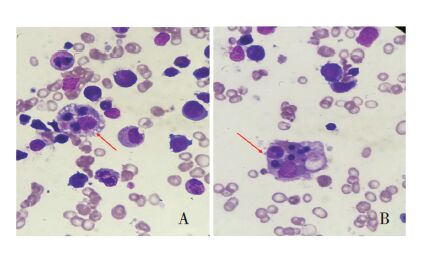
实验室检查:血常规白细胞2.6×109/L、中性粒细胞0.2×109/L、血小板93×109/L、血红蛋白72.0 g/L;大小便常规、心肌酶、肾功能、免疫球蛋白、心电图均未见明显异常;电解质:钠122 mmol/L(正常范围:135~153 mmol/L),余项正常;C-反应蛋白6.88 mg/L(正常范围:0~5 mg/L);降钙素原0.43 ng/mL(正常范围:0~0.20 ng/L);EB病毒IgM、 IgG均阳性,EB病毒DNA 6.59×103/mL(<5.0×102/mL);肝功能:谷丙转氨酶234 U/L(正常范围:0~40 U/L)、谷草转氨酶195 U/L(正常范围:0~40 U/L),甘油三酯2.30 mmol/L(正常范围:<1.7 mmol/L);血清铁蛋白1 286.9 ng/mL(正常范围:30~400 U/L);凝血功能:FIB 1.1 g/L(正常范围:2.0~4.0 g/L)、APTT 51 s(正常范围:26~40 s)、TT 20 s(正常范围:10~18 s)、D-Dimer 2.3 mg/L(正常范围:0~0.3 mg/L),余正常;NK细胞百分比2.0%(正常范围:5.0%~27.0%),NK细胞绝对计数280/μL(正常范围:150~1 100/μL)。腹部彩超:肝大,脾大,肠系膜多发肿大淋巴结;肺部CT:双肺炎症;骨髓细胞学(图 1):骨髓增生明显活跃,粒红比值正常,全片有核细胞未见包涵体,可见吞噬细胞(吞噬粒细胞、有核红细胞和血小板)。患儿父母EB病毒IgM均阴性、IgG均阳性,EB病毒DNA均<5.0×102/mL。
|
图 1 患儿骨髓细胞学形态(瑞氏染色×100) A:骨髓组织细胞吞噬有核红细胞和血小板(箭头所示);B:骨髓组织细胞吞噬粒细胞和有核红细胞(箭头所示)。 |
经家属知情同意,将患儿及其父母血标本送检至康圣环球医学特检集团,通过高通量测序(NGS)法,使用Life Technologies公司的Ion Proton测序仪检测家族性噬血细胞综合征(familial hemophagocytic lymphohistiocytosis,FHL)10个相关基因,PRF1、UNC13D、STX11、STXBP2、XIAP、SH2D1A、Rab27a、AP3B1、LYST、ITK,使用DNAstar 软件包中的 Seqman 进行测序基因与正常LYST基因的比对分析。
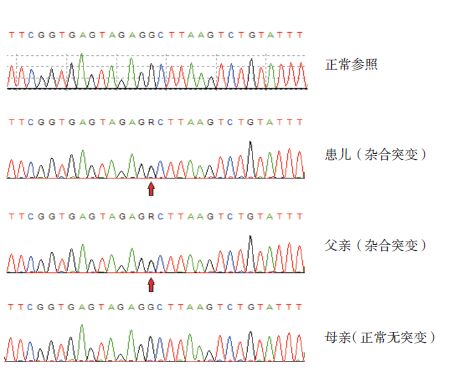
结果:患儿及其父亲LYST基因有一处杂合突变:第46号外显子10 526位G→A,导致编码的3509位精氨酸被谷氨酰胺代替(Arg→Gln,Arg3509Gln),为错义突变,患儿母亲第46号外显子测序未发现此突变(图 2)。经检索人类基因突变数据库和最新文献,位于第46号外显子的突变c.10526G>A(p.Arg3509Gln)为新突变,该突变在人群中发生率极低,排除其单核苷酸多态性(single nucleotide polymorphism,SNP)。
|
图 2 患儿及其父母LYST基因46号外显子检测结果 患儿及其父亲均存在c.10526G>A突变,突变位点如箭头所指。患儿母亲未检测到基因突变。 |
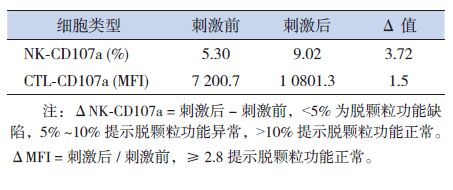
治疗第20周再次入院时,通过流式细胞术检测外周血NK细胞和CTL细胞在刺激前后的细胞膜CD107a分子表达。与刺激前相比,刺激后CD107a分子在NK和CTL细胞膜上的表达增加,但增加幅度低于正常参考范围,表明患儿NK和CTL细胞脱颗粒功能存在异常(见表 1)。
| 表 1 CD107a激发实验检测结果 |
治疗与演变:患儿发热20 d,伴有脾大、血细胞三系减少、FIB明显减少、TG 升高、血清铁蛋白显著增高,以及骨髓涂片发现噬血细胞,符合噬血细胞综合征诊断标准[1],按2004-HLH方案(地塞米松、环孢霉素、依托泊苷)[1]规律化疗,辅以抗感染、粒细胞集落刺激因子、成分输血等支持治疗,治疗第2周体温、血常规基本正常,肝功能、TG、FIB、铁蛋白等提示已缓解;治疗第5周,患儿再度出现持续高热,复查血常规、肝功能、血脂、凝血功能等提示复发(见表 2~3),家族性噬血细胞综合征相关基因测序结果提示患儿及其父亲的LYST基因存在杂合突变,诊断原发性噬血细胞综合征,建议干细胞移植,家属拒绝,继续原方案化疗,病情缓解,第6周出院,出院后予以维持治疗,第 9周复查HLH指标稳定;第20周患儿再次出现持续高热,血常规、肝功能、血脂、凝血功能、铁蛋白等提示HLH复发,行细胞毒脱颗粒检测(CD107a激发实验),显示:ΔNK-CD107a为3.72%,CTL细胞ΔMFI为1.5,考虑原发性噬血细胞综合征复发,再次建议行干细胞移植,目前等待移植中。
| 表 2 患儿治疗过程中血象、体温的动态变化 |
| 表 3 患儿治疗过程中的HLH相关指标变化 |
讨论:原发性噬血细胞综合征(primary hemophago-cytic syndrome,pHPS),又称原发性噬血细胞性淋巴组织细胞增生症(primary hemophagocytic lymphohistiocytosis,pHLH),是由多种因素导致机体免疫功能紊乱,引起单核/巨噬细胞系统反应性增生、大量细胞因子释放、导致多脏器浸润及全血细胞减少为特征的疾病[2]。它是一种常染色体或X连锁隐性遗传病,包括FHL和原发性免疫缺陷病相关噬血细胞综合征(immunodeficiency related hemophagocytic lympho-histiocytosis,iHLH)[3]。FHL有5个亚型,FHL1~FHL5。iHLH包括 Chediak-Higashi 综合征1 型、Griscelli 综合征2 型、Hermansky-Pudlak 综合征Ⅱ型和X-连锁淋巴增殖综合征(XLP,包括XLP-1 和XLP-2)等[3]。pHLH相关的基因缺陷包括PRF1、UNC13D、STX11、STXBP2、XIAP、SH2D1A、Rab27a、AP3B1和LYST[4]。越来越多研究提示,即使基因检测为杂合突变,在一定条件下仍可诊断pHLH[5]。pHLH在亚洲地区发病率较高,可达3.42/100万,男性:女性为1 : 1[6]。90%的患儿发病年龄小于2岁,少数可延迟至青春期甚至成年后发病[7];而迟发性pHLH特别是年长儿和成人发病者逐渐增多,目前报道的pHLH最大发病年龄为62岁[8]。
溶酶体运输调节因子基因(lysosomal trafficking regulator gene,LYST),定位于常染色lq42.1-42.2,全长205 878 kb,含52个内含子、53个外显子,编码LYST[9]。 LYST含3 801个氨基酸,参与溶酶体形成和细胞内运输过程。LYST基因突变位点散布于大的编码区内,突变点约50 多个,多为无义突变、错义突变和框移突变,如c.11362 G>A(p.G3725R)、c.961 T>C(p.C258R)和c.925C>T(p.R309X )[9, 10, 11]。LYST 基因突变位点也可位于内含子,如c.7060-1 G>A,NM_000081[12]。LYST基因突变导致细胞毒性颗粒不能正常释放,积聚成大的颗粒,致使CTL和NK细胞不能有效清除被感染细胞;巨噬细胞被活化的T 细胞刺激,分泌过量细胞因子,使T细胞及巨噬细胞处于失控的活化状态,继而表现出HLH的一系列症状。
本研究通过NGS发现患儿及其父亲LYST基因有一处杂合突变,而且CD107a激发实验阳性,支持pHLH的诊断。溶酶体相关膜蛋白-1(LAMP-1 或CD107a)是一种高糖基化蛋白,约占溶酶体膜蛋白的50%,当NK 细胞杀伤靶细胞时,细胞毒颗粒将到达浆膜面并与细胞膜融合,引起颗粒内容物释放,最终杀死靶细胞。随着脱颗粒的发生,CD107a 分子被转运至膜表面,并且CD107a 分子的表达上调与穿孔素的分泌一致[13],因此,CD107a 表达率可以反映NK 细胞杀伤活性。有学者[14]提出,流式细胞术检测穿孔素或者CD107a激发试验对于静息状态下NK细胞和/或CTL细胞功能的反映具有一致性。Bryceson等[15]对可疑HLH患者进行CD107a激发实验前瞻性队列研究,发现静息状态下NK细胞CD107a低于5%对于FHL诊断的敏感性为96%、特异性为88%。近年来研究提示,即使基因检测阴性或为杂合突变,在一定条件下仍可诊断为pHLH。Spessott等[5]曾报道存在STXBP2基因杂合突变的患儿,因其相关蛋白munc18-2受影响而干扰溶酶体颗粒释放,最终诊断为FHL5;周晓姮[16]研究中有2例患儿,1例PRF1基因存在杂合错义突变V50L,1例PRF1基因存在杂合错义突变R489W,综合穿孔素或颗粒酶B表达异常,明确诊断为FHL2。
本研究患儿及其父亲的LYST基因均出现同一杂合突变,但患儿发病、父亲无症状,推测有以下原因:(1)本研究患儿的CD107a明显降低,但因条件所限未完善患儿父亲的CD107a以及LYST蛋白检测,患儿父亲目前处于无病状态,不排除其CD107a和LYST蛋白均正常的可能。(2) pHLH是常染色体或X连锁隐性遗传病,但单纯的基因缺陷有时并不能够导致疾病的发生,往往由继发因素包括感染、免疫缺陷病、肿瘤及组织损伤等诱发,在儿童时期多为细菌或病毒感染诱发,而成人常为感染、恶性淋巴瘤及免疫性疾病等诱发。本研究患儿存在EB病毒感染,而患儿父亲无诱发因素。(3)目前发现的pHLH相关基因有PRF1、UNC13D、STX11、STXBP2、XIAP、SH2D1A、Rab27a、AP3B1和LYST,但辛辛那提儿童医疗中心诊断的HLH患儿有一半以上不能用这些基因缺陷解释[17],提示将近一半的pHLH相关基因未被克隆出来,因此不能排除该患儿尚存在某些未被检测到的致病基因。(4)某些不典型突变所处区域编码的分子功能并不很重要,一般处于沉默状态,虽然可以导致NK 细胞和CTL功能障碍,但无典型的HLH临床表现,称为温和突变,这可能是部分pHLH发病延迟的原因[18]。患儿父亲长期处于无病状态,不排除该突变位点为温和突变的可能性。pHLH相关的基因突变及其对特定蛋白质的作用仍需进一步研究。
综上,pHLH诊断困难,可通过基因检测确诊,但基因检测阴性或仅为杂合突变时,需要结合临床特征、相关基因的蛋白表达以及CD107a激发实验。深入地研究pHLH相关基因突变及其与特定蛋白质的相互作用,了解基因突变如何导致CTL和NK细胞功能障碍、建立pHLH快速诊断方法是今后努力的方向。
| [1] | Henter JI, Horne A, Arico M, et al. HLH-2004:Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2007, 48 (2): 124–131. DOI:10.1002/(ISSN)1545-5017 |
| [2] | Gholam C, Grigoriadou S, Gilmour KC, et al. Familial haemophagocytic lymphohistiocytosis:advances in the genetic basis, diagnosis and management[J]. Clin Exp Immunol, 2011, 163 (3): 271–283. DOI:10.1111/cei.2011.163.issue-3 |
| [3] | Janka GE. Familial and acquired hemophagocytic lymphohistiocytosis[J]. Annu Rev Med, 2012, 63 : 233–246. DOI:10.1146/annurev-med-041610-134208 |
| [4] | Cetica V, Sieni E, Pende D, et al. Genetic predisposition to hemophagocytic lymphohistiocytosis:Report on 500 patients from the Italian registry[J]. J Allergy Clin Immunol, 2016, 137 (1): 188–196. DOI:10.1016/j.jaci.2015.06.048 |
| [5] | Spessott WA, Sanmillan ML, McCormick ME, et al. Hemophagocytic lymphohistiocytosis caused by dominant-negative mutations in STXBP2 that inhibit SNARE-mediated membrane fusion[J]. Blood, 2015, 125 (10): 1566–1577. DOI:10.1182/blood-2014-11-610816 |
| [6] | Gholam C, Grigoriadou S, Gilmour KC, et al. Familial haemophagocytic lymphohistiocytosis:advances in the genetic basis, diagnosis and management[J]. Clin Exp Immunol, 2011, 163 (3): 271–283. DOI:10.1111/cei.2011.163.issue-3 |
| [7] | Sieni E, Cetica V, Piccin A, et al. Familial hemophagocytic lymphohistiocytosis may present during adulthood:clinical and genetic features of a small series[J]. PLoS One, 2012, 7 (9): e44649. DOI:10.1371/journal.pone.0044649 |
| [8] | Nagafuji K, Nonami A, Kumano T, et al. Perforin gene mutations in adult-onset hemophagocytic lymphohistiocytosis[J]. Haematologica, 2007, 92 (7): 978–981. DOI:10.3324/haematol.11233 |
| [9] | Sepulveda FE, Burgess A, Heiligenstein X, et al. LYST controls the biogenesis of the endosomal compartment required for secretory lysosome function[J]. Traffic, 2015, 16 (2): 191–203. DOI:10.1111/tra.2015.16.issue-2 |
| [10] | Sánchez-Guiu I, Antón AI, García-Barberá N, et al. Chediak-Higashi syndrome:description of two novel homozygous missense mutations causing divergent clinical phenotype[J]. Eur J Haematol, 2014, 92 (1): 49–58. DOI:10.1111/ejh.2013.92.issue-1 |
| [11] | Al-Tamemi S, Al-Zadjali S, Al-Ghafri F, et al. Chediak-Higashi syndrome:novel mutation of the CHS1/LYST gene in 3 Omani patients[J]. J Pediatr Hematol Oncol, 2014, 36 (4): e248–250. DOI:10.1097/MPH.0000000000000025 |
| [12] | Nielsen C, Agergaard CN, Jakobsen MA, et al. Infantile hemophagocytic lymphohistiocytosis in a case of chediak-higashi syndrome caused by a mutation in the LYST/CHS1 gene presenting with delayed umbilical cord detachment and diarrhea[J]. J Pediatr Hematol Oncol, 2015, 37 (2): e73–e79. DOI:10.1097/MPH.0000000000000300 |
| [13] | Alter G, Malenfant JM, Altfeld M, et al. CD107a as a functional marker for the identification of natural killer cell activity[J]. Immunol Methods, 2004, 294 (1-2): 15–22. DOI:10.1016/j.jim.2004.08.008 |
| [14] | Chen Y, Wang Z, Cheng Y, et al. Novel mutations in the UNC13D gene carried by a Chinese neonate with hemophagocytic lymphohistiocytosis[J]. Yonsei Med J, 2013, 54 (4): 1053–1057. DOI:10.3349/ymj.2013.54.4.1053 |
| [15] | Bryceson YT, Pende D, Maul-Pavicic A, et al. A prospective evaluation of degranulation assays in the rapid diagnosis of familial hemophagocytic syndromes[J]. Blood, 2012, 119 (12): 2754–2763. DOI:10.1182/blood-2011-08-374199 |
| [16] | 周晓姮, 罗建明, 宾琼, 等. 噬血细胞性淋巴组织细胞增生症患儿及其家系穿孔素和颗粒酶B的表达[J]. 中华血液学杂志, 2016, 37 (3): 227–232. |
| [17] | Filipovich AH. Hemophagocytic lymphohistiocytosis (HLH) and related disorders[J]. Hematology Am Soc Hematol Educ Program, 2009 : 127–131. |
| [18] | 王旖旎, 王昭, 王晓琳. 成人原发性噬血细胞综合征一例报告及文献复习[J]. 中华血液学杂志, 2012, 33 (4): 291–293. |
 2017, Vol. 19
2017, Vol. 19