2. 青岛大学附属医院儿科, 山东 青岛 266003;
3. 青岛大学附属青岛妇女儿童医院新生儿科, 青岛 266034
手足口病(hand,foot,and mouth disease,HFMD)是儿童常见的感染性疾病,重症HFMD主要由肠道病毒71型(enterovirus 71,EV71)引起[1-2]。由于EV71具有嗜神经性,易引起中枢神经损伤,而脑炎是其最常见的神经系统并发症[3-5],常导致较高的致死率和致残率。EV71感染合并脑炎的发病机制尚未完全清楚。但是,EV71感染后个体的免疫应答与宿主基因组易感性之间的关系越来越受到学术界重视。研究表明,Toll 样受体(Toll-like receptors,TLRs)在病毒感染中发挥重要免疫调控作用[6-8],TLR3-1377C/T位点基因多态性与多种炎症及感染性疾病密切相关[7-8],但TLR3-1377C/T位点的多态性与血清TLR3的表达水平及EV71脑炎易感性之间是否存在关联,尚不明确。因此,本研究采用聚合酶链反应限制性片段长度多态性(polymerase chain reaction-restricted fragment length polymorphism,PCR-RFLP)及酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)等方法,检测TLR3-1377C/T基因多态性及血清TLR3水平,探讨EV71脑炎的易感机制,为其可能的靶向治疗提供理论依据。
1 资料与方法 1.1 研究对象收集2015年7月至2015年9月青岛大学附属青岛妇女儿童医院及青岛大学附属医院EV71感染(经RT-PCR定性法证实咽拭子、粪便或脑脊液EV71病毒核酸阳性)患儿187例,年龄0.6~3.9岁,中位年龄3.2岁,男116例、女71例。根据是否合并脑炎,分为脑炎组59例,年龄0.6~3.5岁,中位年龄1.9岁,男37例、女 22例;无脑炎组128例,年龄0.8~3.9岁,中位年龄3.7岁,男79例、女49例。EV71脑炎诊断符合EV71感染重症病例临床救治专家共识[9]。取同期健康体检儿童232例作为对照组,年龄0.6~4.5岁,中位年龄3.6岁,男136例、女96例。对照组患儿2周内均没有与EV71感染患者密切接触史,基本生化检查及血常规正常,咽拭子或粪便EV71病毒核酸阴性。入组人群均为长期居住青岛的汉族人群。EV71感染组和对照组在性别及年龄分布上的差异无统计学意义。
所有研究对象就诊当日留取咽拭子及EDTA抗凝静脉血3mL。
本研究通过医院伦理委员会批准,并获得患儿监护人知情同意。
1.2 基因组DNA提取取研究对象EDTA抗凝血2 mL,利用基因组DNA提取试剂盒(大连宝生物公司)提取DNA,操作严格遵循试剂盒说明书。采用紫外分光光度仪测定DNA的纯度及含量,A260/A280在 1.7~2.0 之间,计算产物浓度。
1.3 TLR3-1377C/T位点基因多态性检测及分型采用PCR-RFLP对TLR3-1377C/T(rs3775290)基因多态性进行检测并分型。特异性引物序列(5'-CCAGGCATAAAAAGCAATATG-3'和 5'-GGA CCAAGGCAAAGGAGTTC-3')由上海Sangon生物技术有限公司合成。PCR反应体系:DNA 1 μL ,上下游引物各0.5 μL,Buffer F 5 μL,Tag酶0.3 μL,dNTP 0.5 μL,蒸馏水17.2 μL,每个样本反应体系为25 μL。 PCR扩增反应条件:95℃预处理5 min;95℃变性30 s、60℃退火30 s、72℃延伸60 s,共35个循环;72℃延伸7 min。使用TagⅠ酶消化PCR产物,2%琼脂糖凝胶电泳(100 mV 30 min),紫外凝胶成像系统采集条带图像。
1.4 EV71 病毒载量检测采用荧光定量逆转录聚合酶链反应(fluorescent quantitation reverse transcriptase polymerase chain reaction ,qRT-PCR)测定EV71感染患儿的病毒核糖核酸的拷贝数。并逆转录合成cDNA。再根据 EV71 的 VPl 基因段设计引物EV71-S(5'-GTTCTTAACTCACATAGCA-3',nucleotides 2643-2661)与 EV71-A(5'-TTGACAAAAACTGAGGGTT-3',nucleotides 2983-2965),进行PCR扩增:95℃预处理15 min;95℃变性10 s、60℃退火60 s、72℃延伸30 s,40个循环。病毒载量浓度梯度:1×107 copies/μL、1×106 copies/μL、1×105 copies/μL和1×104 copies/μL。使用Mx3000P系统进行实时定量RT-PCR。病毒载量的结果先根据试剂盒已知拷贝数标准计算出各样本病毒RNA拷贝数,再将实际拷贝数转换为10的对数(log10 copies/μL)表示。
1.5 血清TLR3浓度的检测对EV71感染组(其中EV71脑炎组24例,无脑炎组20例)及对照组44例进行血清TLR3浓度检测。取各组研究对象剩余EDTA抗凝血1 mL,采用ELISA检测血清TLR3浓度。严格遵循试剂盒(美国R&D公司)操作说明,TLR3最小检测限量为0.1 ng/mL,采用已知的TLR3浓度绘制标准曲线,并用于每个标本的检测。
1.6 统计学分析采用SPSS 8.0统计软件进行数据处理。计量资料采用均值±标准差(x±s)表示,计数资料采用百分率表示。计量资料的比较采用方差分析、t检验,计数资料的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果 2.1 Hardy-Weinburg 平衡检验对 EV71感染组及对照组的TLR3-1377C/T位点各基因型的检测值和预期值进行检验,每组基因型的分布均符合Hardy-Weinberg遗传定律(χ2=5.92,P=0.051),提示本组研究对象具备群体代表价值。
2.2 各组TLR3-1377C/T位点基因型及等位基因的分布与对照组相比,EV71感染组的TLR3-1377C/T位点基因型分布及等位基因频率的差异无统计学意义(χ2=0.199、0.125,P>0.05);与EV71感染无脑炎组相比,脑炎组的TLR3-1377C/T位点基因型分布及等位基因频率的差异亦无统计学意义(χ2=0.082、0.056,P>0.05)。见表 1。
| 表 1 各组TLR3-1377C/T 位点基因型及等位基因的分布 [例(%)] |
2.3 血清TLR3水平及咽拭子病毒载量的检测
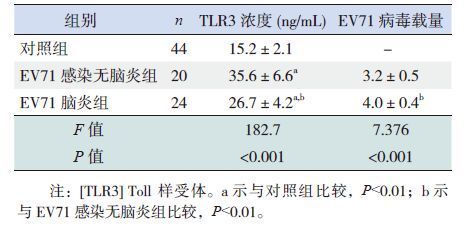
EV71感染脑炎组及无脑炎组的TLR3水平均较对照组升高(P<0.01),以无脑炎组最高(P<0.01);EV71脑炎组的病毒载量高于无脑炎组(P<0.01)。见表 2。
| 表 2 各组血清TLR3 浓度及病毒载量的比较 (x±s) |
2.4 各组不同年龄血清TLR3水平的检测
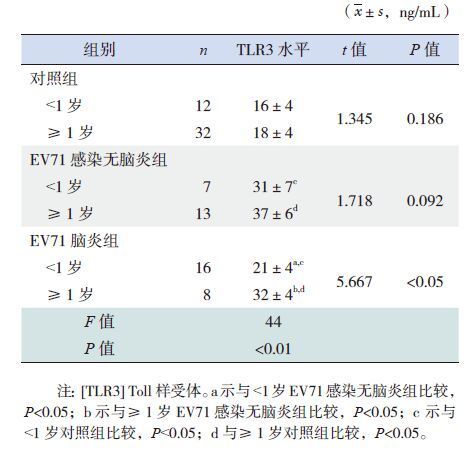
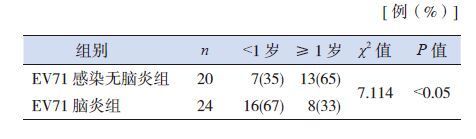
不同年龄组别的EV71脑炎组和无脑炎组血清TLR3水平均较相应对照组增高(P<0.05),其中无脑炎组TLR3水平高于相应年龄的脑炎组(P<0.05)。EV71感染无脑炎组及对照组的TLR3浓度在<1岁与≥1岁的患儿间的差异无统计学意义(P>0.05);而EV71感染脑炎组≥1岁患儿的TLR3浓度高于<1岁者(P<0.05)。见表 3。EV71感染脑炎组以<1岁的较多(χ2=7.14,P<0.05),见表 4。
| 表 3 各组不同年龄患儿TLR3 水平的比较 |
| 表 4 EV71 感染脑炎组与无脑炎组的年龄分布 |
3 讨论
大量临床研究表明[8, 10-12],免疫在EV71感染重症病例的发生中起到了关键作用,而固有免疫系统在机体受病原微生物入侵后首当其冲。模式识别受体(pattern recognition receptor,PRR)作为固有免疫识别病毒等抗原的重要识别受体,表达在多种天然免疫细胞上,在固有免疫中起重要作用。TLRs是研究较为透彻的PRR,TLRs广泛分布于人类中枢神经系统,病毒感染后TLRs通过识别病毒的相关分子模式,进一步激活下游的信号传导通路,诱导转录因子活化,如核因子-κB、干扰素调节因子以及激活子蛋白-1等,进一步调节固有免疫系统多种前炎症细胞因子、趋化因子的表达[6],参与病毒感染后的免疫调控。
大量研究发现,TLR3-1377C/T位点基因多态性与H1N1及EB病毒的易感性有关[7-8]。Liu等[8] 发现该位点在中国山东地区的人群中存在多态性,且与胃癌引起的炎性反应相关。然而,目前该位点在EV71感染中的作用及其与病情严重程度的关系知之甚少。本研究发现,EV71感染脑炎组与无脑炎组患儿的TLR3-1377C/T位点基因型及等位基因分布差异无统计学意义,提示该位点的基因多态性与儿童EV71脑炎的发生可能无相关性。
近年来大量研究[6-7, 12]发现,TLR3在嗜神经病毒感染后机体的免疫应答过程中发挥重要作用,但存在矛盾观点。Carty 等[13]发现,TLR3缺陷在嗜神经病毒西尼罗病毒感染中起保护作用。但Daffis等[14]的研究却发现,TLR3缺陷型小鼠感染西尼罗病毒后,其外周血西尼罗病毒载量更高,提示TLR3对嗜神经病毒感染有抑制作用。本研究发现,EV71感染患儿血清TLR3水平较正常对照显著升高,提示TLR3参与了EV71感染后机体的固有免疫过程。同时本研究还发现,EV71脑炎患儿的血清TLR3水平低于EV71感染无脑炎组,而EV71脑炎组病毒载量高于无脑炎组,提示病毒血症及高水平复制可能诱发了EV71进入中枢神经系统,推测高水平TLR3可能通过对病毒复制的抑制而对EV71感染起保护作用,与Daffis等[14]的研究类似。
研究发现[2, 15-16],年长儿EV71的显性感染多表现为无并发症的HFMD,而幼儿尤其小于1岁的婴儿更易发展为脑炎、脑干脑炎等,常遗留永久性后遗症。上述特点可能与生命早期固有免疫的特异性不成熟有关,而固有免疫的这种年龄依赖模式与感染发病机制关系密切[17-18]。本研究对不同年龄组儿童的TLR3水平检测发现,EV71脑炎组TLR3水平在婴儿组显著降低;而在 EV71感染未合并脑炎的患儿,不同年龄组间的TLR3水平差异无统计学意义,提示重症患儿TLR3的产生呈年龄依赖性。推测婴儿EV71感染后TLR3的低表达可能引起对病毒复制的抑制作用减弱,从而促进了EV71脑炎的发生。婴儿固有免疫分子TLR3的产生不足可能是导致EV71脑炎的重要因素。
总之,本组青岛地区汉族儿童未发现TLR3-1377C/T位点基因多态性与EV71感染及EV71脑炎之间存在相关性。但EV71感染后TLR3的低水平可能引起其对病毒复制的抑制作用减弱,从而促进EV71脑炎发生;婴儿EV71感染后TLR3的低表达更为明显。本研究对进一步加强EV71感染后TLR3调控机制的探索提供了新的思路,对减少EV71感染重症病例的发生具有重要价值。
本研究仅针对TLR3的一个基因位点进行了多态性分析;仅在入院当天检测了血清TLR3浓度,未能了解TLR3随病程的动态变化,而且样本量较小。因此,本研究虽在TLR3基因多态性及其水平与EV71脑炎的相关性方面获得一些有价值的线索,但TLR3的准确作用及机制尚未完全明确,本课题组将进一步扩大样本量进行深入研究。
| [1] | 邓慧玲, 张玉凤. 肠道病毒71型感染致重症手足口病新认识[J]. 中华实用儿科临床杂志, 2016, 31 (10): 736–743. |
| [2] | Ooi MH, Wong SC, Lewthwaite P, et al. Clinical features, diagnosis, and management of enterovirus 71[J]. Lancet Neurol, 2010, 9 (11): 1097–1105. DOI:10.1016/S1474-4422(10)70209-X |
| [3] | Li F, Liu XP, Li JA, et al. Correlation of an interleukin-4 gene polymorphism with susceptibility to severe enterovirus 71 infection in Chinese children[J]. Arch Virol, 2015, 160 (4): 1035–1042. DOI:10.1007/s00705-015-2356-8 |
| [4] | Han ZL, Li JA, Chen ZB. Genetic polymorphism of CCL2-2510 and susceptibility to enterovirus 71 encephalitis in a Chinese population[J]. Arch Virol, 2014, 159 (9): 2503–2507. DOI:10.1007/s00705-014-2082-7 |
| [5] | Yuan A, Li J, Liu P, et al. Association of interleukin-6-572C/G gene polymorphism and serum or cerebrospinal fluid interleukin-6 level with enterovirus 71 encephalitis in Chinese Han patients with hand, foot, and mouth disease[J]. Inflammation, 2015, 38 (2): 728–735. DOI:10.1007/s10753-014-9983-1 |
| [6] | Land WG. The role of damage-associated molecular patterns in human diseases:Part I-promoting inflammation and immunity[J]. Sultan Qaboos Univ Med J, 2015, 15 (1): e9–e21. |
| [7] | Esposito S, Molteni CG, Giliani S, et al. Toll-like receptor 3 gene polymorphisms and severity of pandemic A/H1N1/2009 influenza in otherwise healthy children[J]. Virol J, 2012, 9 : 270. DOI:10.1186/1743-422X-9-270 |
| [8] | Liu S, Wang X, Shi Y, et al. Toll-like receptor gene polymorphisms and susceptibility to Epstein-Barr virus-associated and -negative gastric carcinoma in Northern China[J]. Saudi J Gastroenterol, 2015, 21 (2): 95–103. DOI:10.4103/1319-3767.153832 |
| [9] | 卫生部手足口病临床专家组. 肠道病毒71型(EV71)感染重症病例临床救治专家共识[J]. 中华儿科杂志, 2011, 49 (9): 675–678. |
| [10] | Gantt S, Yao L, Kollmann TR, et al. Implications of age-dependent immune responses to enterovirus 71 infection for disease pathogenesis and vaccine design[J]. J Pediatric Infect Dis Soc, 2013, 2 (2): 162–170. DOI:10.1093/jpids/pit017 |
| [11] | Li JA, Chen ZB, Lv TG, et al. Genetic polymorphism of CCL2-2518, CXCL10-201, IL8+781 and susceptibility to severity of Enterovirus-71 infection in a Chinese population[J]. Inflamm Res, 2014, 63 (7): 549–556. DOI:10.1007/s00011-014-0724-6 |
| [12] | Han JF, Cao RY, Deng YQ, et al. Antibody dependent enhancement infection of enterovirus 71 in vitro and in vivo[J]. Virol J, 2011, 8 : 106. DOI:10.1186/1743-422X-8-106 |
| [13] | Carty M, Reinert L, Paludan SR, et al. Innate antiviral signalling in the central nervous system[J]. Trends Immunol, 2014, 35 (2): 79–87. DOI:10.1016/j.it.2013.10.012 |
| [14] | Daffis S, Samuel MA, Suthar MS, et al. Toll-like receptor 3 has a protective role against West Nile virus infection[J]. J Virol, 2008, 82 (21): 10349–10358. DOI:10.1128/JVI.00935-08 |
| [15] | Huang PN, Shih SR. Update on enterovirus 71 infection[J]. Curr Opin Virol, 2014, 5 : 98–104. DOI:10.1016/j.coviro.2014.03.007 |
| [16] | Pathinayake PS, Hsu AC, Wark PA. Innate immunity and immune evasion by entrovirus 71[J]. Viruses, 2015, 7 (12): 6613–6630. DOI:10.3390/v7122961 |
| [17] | Kuo RL, Shih SR. Strategies to develop antivirals against enterovirus 71[J]. Virol J, 2013, 10 : 28. DOI:10.1186/1743-422X-10-28 |
| [18] | Kok CC. Therapeutic and prevention strategies against human enterovirus 71 infection[J]. World J Virol, 2015, 4 (2): 78–95. DOI:10.5501/wjv.v4.i2.78 |
 2017, Vol. 19
2017, Vol. 19