手足口病 (hand,foot,and mouth disease,HFMD)是由肠道病毒感染引起的传染病,多发生于学龄前儿童,目前已成为全球性的传染病,严重威胁儿童的生命健康[1]。神经源性肺水肿和循环衰竭是HFMD患儿死亡的主要原因[2-3],目前研究证实交感神经过度兴奋,释放大量儿茶酚胺,产生“儿茶酚胺风暴”,引起细胞膜离子通道改变、心肌细胞损伤、β受体反应性增高等,最终导致患儿血流动力学急剧变化、心功能衰竭、恶性心律失常、肺毛细血管血管通透性增加等病理生理改变,是神经源性肺水肿的始动和中心机制[4-5],细胞因子的大量释放及免疫调节的异常可能为神经源性肺水肿发展过程中的重要因素[6-7]。盐酸艾司洛尔是一种超短效、选择性β1受体阻滞剂,临床上用于治疗“儿茶酚胺风暴”取得了良好的疗效。2006年室性心律失常治疗与心脏性猝死预防(ACC/AHA/ESC)指南指出,静脉注射β受体阻滞剂是治疗“儿茶酚胺风暴”的唯一有效方法[8]。此外,有研究提示艾司洛尔能有效减轻患者炎性反应[9],保护心肌细胞,改善心功能[10]。本研究将艾司洛尔应用于危重型手足口病的治疗中,观察其临床疗效,并探讨其可能的作用机制。
1 资料与方法 1.1 研究对象选取徐州市儿童医院重症医学科2013年5月至2015年12月收治的102例危重型HFMD患儿(临床分期为3期)为研究对象,均符合原卫生部发布的HFMD诊疗指南(2010版)诊断标准[11],临床分期参照《肠道病毒71型(EV71)感染重症病例临床救治专家共识(2011年版)》[12]。排除标准:支气管哮喘、房室传导阻滞、窦性心动过缓、低血压、先天性心脏病、正在使用洋地黄类或其他正性肌力作用的药物。
纳入的102例患儿中,男54例,女48例;年龄9个月至3岁5个月(平均1.5±0.6岁);病程2~5 d。102例患儿入院后采用随机数字表法分为常规治疗组和艾司洛尔组,每组各51例。 2组患儿年龄、性别、病程等差异无统计学意义。本研究均征得患儿家长知情同意,并经我院医学伦理委员会批准。
1.2 治疗方法2组患儿均按照HFMD诊疗指南[11]予以甘露醇、呋塞米降颅压,丙种球蛋白免疫支持及应用血管活性药物米力农等治疗。艾司洛尔干预组在此基础上加用艾司洛尔,首次负荷量为0.5 mg/kg,静脉快速注射,随后以0.03 mg/(kg·min)持续静脉泵入。用药过程中持续监测血压、心率(HR),并根据血压、HR变化,每10~20 min调整一次剂量,每次增减0.01 mg/(kg·min),最大剂量不超过0.1 mg/(kg·min)[9]。当患儿临床症状明显缓解或出现血压、HR低于正常值范围低限时,停止静脉给药。
1.3 标本采集及单核细胞的提取分别于治疗前及治疗后1 d、3 d、5 d采血,按照试剂盒说明书提取外周血单核细胞,检测单核细胞核因子-κB(NF-κB) p65含量及血清去甲肾上腺素(NE)、肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、氨基末端脑钠肽前体(NT-proBNP)的水平。
1.4 NF-κB p65及NT-proBNP、NE、TNF-α、IL-6的检测采用Western blot 法检测 NF-κB p65 的表达: RIPA 裂解细胞,离心取上清液加入 5×蛋白上样缓冲液,煮蛋白10 min。10% SDS-PAGE 电泳分离总蛋白,转移至PVDF 膜,5%脱脂奶粉封闭 2 h,洗膜后放入 NF-κB p65抗体(1 : 250)和 β-actin(1 : 1 000)中 4℃过夜。洗膜,放入二抗(1 : 1 000)37℃ 孵育2 h,ECL显影液显影。采用Image J和GraphPad Prism5.0 分析软件进行蛋白显影后图像分析,以目的蛋白/内参蛋白灰度值反映其表达水平。
血清NT-proBNP、NE、TNF-α、IL-6的测定:试剂盒由美国R&D公司生产,中国组装。按照试剂盒操作步骤,采用双抗体夹心酶联免疫吸附法测定。
1.5 临床指标的监测监测危重型HFMD患儿治疗前及治疗后1 d、3 d和5 d的HR、呼吸频率(RR)、收缩压(SBP)变化情况。检测治疗前及治疗5 d后心肌酶谱的变化。
1.6 统计学分析采用SPSS 20.0软件进行统计学分析,计量资料用均数±标准差(x±s)表示,两组间比较采用成组t检验,治疗前后比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果 2.1 患儿转归常规治疗组51例患儿中,45例治愈出院,6例病情持续进展进入心肺功能衰竭期,其中5例患儿出现神经源性肺水肿,1例患儿出现脑功能衰竭,最终抢救无效后死亡,病死率为12%。艾司洛尔组51例患儿中,48例治愈出院,3例病情恶化,其中2例患儿出现神经源性肺水肿,1例出现脑功能衰竭,抢救无效后死亡,病死率为6%。两组病死率比较差异无统计学意义(χ2 =0.487,P>0.05)。
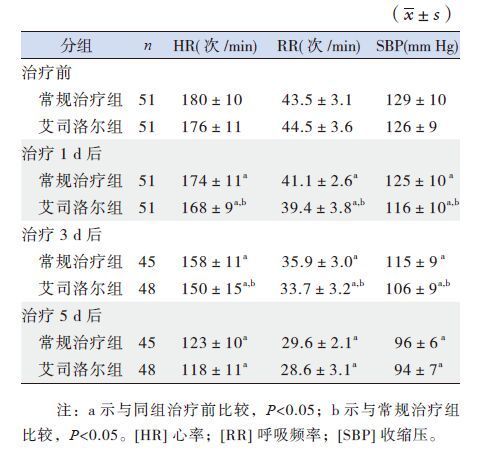
2.2 两组患儿治疗前后HR、RR、SBP的变化治疗前两组患儿HR、RR、SBP差异无统计学意义(P>0.05)。与治疗前相比,治疗后1 d、3 d、5 d两组患儿HR、RR、SBP均明显降低 (P<0.05);与常规治疗组相比,艾司洛尔组患儿治疗1 d、3 d后上述指标改善更明显(P<0.05),而治疗5 d后两组患儿上述指标差异无统计学意义。见表 1。
| 表 1 两组患儿治疗前后HR、RR、SBP 的变化 |
2.3 两组患儿治疗前后NT-proBNP及心肌酶的变化
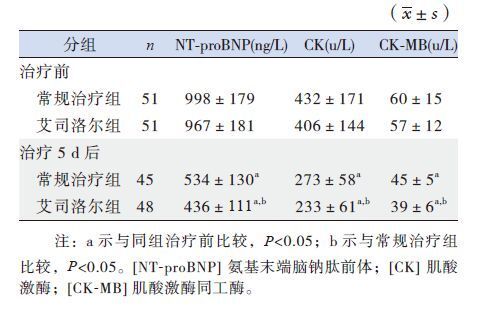
治疗前两组患儿血清NT-proBNP及肌酸激酶(CK)、 肌酸激酶同工酶(CK-MB)水平差异无统计学意义(P>0.05)。治疗后5 d,两组患儿以上指标较治疗前显著下降(P<0.05) ,且艾司洛尔组效果明显优于常规治疗组,差异有统计学意义(P<0.05)。见表 2。
| 表 2 两组患儿治疗前后心肌酶及NT-proBNP 的变化 |
2.4 两组患儿治疗前后NF-κB p65 、NE、TNF-α、IL-6的变化
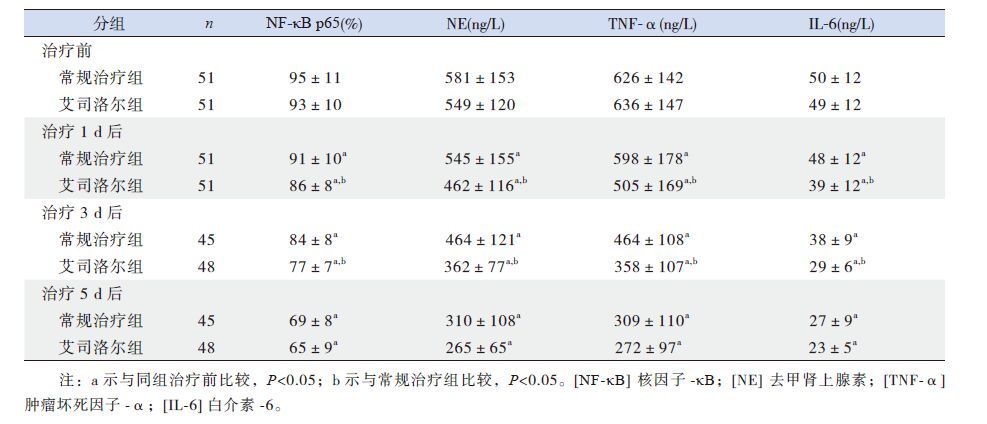
治疗前两组患儿血清NF-κB p65、NE、TNF-α、IL-6水平差异无统计学意义(P>0.05)。与治疗前相比,治疗后1 d、3 d、5 d两组患儿血清NF-κB p65、NE、TNF-α、IL-6均明显降低(P<0.05)。与常规治疗组相比,艾司洛尔组患儿治疗1 d、3 d后上述指标改善更明显,差异有统计学意义(P<0.05),而治疗后5 d两组患儿单核细胞NF-κB p65的表达及血清NE、TNF-α、IL-6的水平差异无统计学意义(P>0.05),见表 3。
| 表 3 两组患儿治疗前后NF-κB p65、NE、TNF-α、IL-6 的变化 (x±s) |
3 讨论
危重型HFMD(心肺功能衰竭前期)多发生在病程5 d内,病情进展迅速,短期内可发展为心肺衰竭期导致患儿死亡,在这一时期予以正确治疗,是降低病死率的关键[12]。目前研究证实神经源性肺水肿是导致患儿死亡的主要原因,其发生可能与自主神经功能失调或交感神经功能亢进,儿茶酚胺大量释放有关[2, 12]。因此,抑制交感神经兴奋,降低血液儿茶酚胺水平成为治疗的重要环节。艾司洛尔是一种静脉注射的β1 受体阻滞剂,具有起效快、停药后作用迅速消失的特点[13],能迅速有效地降低患者交感神经活性,降低HR,降血压,保护心肌细胞,改善心功能[10, 14-16]。2006年室性心律失常治疗与心脏性猝死预防(ACC/AHA/ESC)指南指出,静脉注射β受体阻滞剂是治疗儿茶酚胺风暴的唯一有效方法[8]。然而由于其负性肌力作用,临床上用于治疗小儿危重型HFMD的研究罕见报道。本研究发现,在常规治疗的基础上加用艾司洛尔治疗危重型HFMD,患儿HR、SBP较治疗前迅速改善,血清NT-proBNP及NE水平较治疗前显著降低,且艾司洛尔组治疗效果优于常规治疗组。NT-proBNP主要由心室肌细胞分泌,在心室压力增高或扩张时分泌增加,且其增高幅度与心力衰竭严重程度呈正相关,是反映心功能受损的敏感指标[17, 18]。Groenning等[19]研究发现,利用NT-proBNP水平评价心功能状态与超声心动图所监测的多项指标具有相关性。本研究发现艾司洛尔能显著降低血清NT-proBNP水平,改善心功能,考虑与以下因素有关:心排出量主要受心脏前后负荷、HR及心肌收缩力的影响,HR在一定范围内增加可增加心排出量,但是当HR过快时,由于心舒张期明显缩短,心舒期充盈量明显减少,因此心排出量下降。艾司洛尔能迅速降低血清NE水平,减慢HR,增加心室充盈量,增加心排出量。此外,艾司洛尔与强心药物米力农联合应用,消除了其负性肌力作用。有研究证实重症HFMD患儿存在不同程度心肌损害[2],目前与心肌损害有关的常用酶学检查指标主要有CK、CK-MB等,其中 CK-MB在心肌细胞中的含量最高,而正常血清中的含量极微,对判断心肌受损具有高度特异性和敏感性。本研究发现艾司洛尔治疗危重型HFMD后患儿血清CK、CK-MB水平较常规治疗组明显降低,提示艾司洛尔能有效减轻危重型HFMD患儿心肌损伤,这与既往研究相符[10]。
既往的研究证实过度表达的炎症细胞因子和免疫调节异常在危重型HFMD患儿神经源性肺水肿的发生中起到重要作用[20-21]。NF-κB 是炎症反应中重要的转录调节因子,当细胞外信号刺激细胞后,可强烈诱导TNF-α、 IL-6等释放[22] 。本研究将艾司洛尔应用到危重型HFMD患儿的治疗中,观察其对NF-κB、TNF-α、IL-6的影响。与常规治疗组相比较,艾司洛尔组患儿治疗1 d后外周血单核细胞NF-κB及血清炎症因子TNF-α、IL-6进一步降低,差异有统计学意义,这种优势持续到治疗后3 d。治疗5 d后患儿生命体征平稳,艾司洛尔组患儿外周血单核细胞NF-κB的表达及血清炎症因子TNF-α、IL-6与常规治疗组无显著差异,这也与患儿临床表现相一致,提示早期应用艾司洛尔治疗危重型HFMD能有效抑制患儿单核细胞NF-κB的表达,减少危重型HFMD患儿血清炎性因子的产生,减轻全身炎性反应。
综上,本研究显示在常规治疗基础上加用艾司洛尔治疗危重型HFMD并不降低患儿总体病死率,但早期应用能有效稳定患儿生命体征,其可能的作用机制为迅速有效地降低血清儿茶酚胺浓度,减轻心肌损伤,改善心功能,减轻炎性反应。
| [1] | Takahashi S, Liao Q, Van Boeckel TP, et al. Hand, foot, and mouth disease in China:modeling epidemic dynamics of enterovirus serotypes and implications for vaccination[J]. PLoS Med, 2016, 13 (2): e1001958. DOI:10.1371/journal.pmed.1001958 |
| [2] | Jiang M, Wei D, Ou WL, et al. Autopsy findings in children with hand, foot, and mouth disease[J]. N Engl J Med, 2012, 367 (1): 91–92. DOI:10.1056/NEJMc1110981 |
| [3] | Nadel S. Hand, foot, mouth, brainstem, and heart disease resulting from enterovims 71[J]. Crit Care Med, 2013, 41 (7): 1821–1822. DOI:10.1097/CCM.0b013e318291cb2d |
| [4] | Sedy J, Zicha J, Kunes J, et al. Mechanisms of neurogenic pulmonary edema development[J]. Physiol Res, 2008, 57 (4): 499–506. |
| [5] | Kao SJ, Yang FL, Hsu YH, et al. Mechanism of fulminant pulmonary edema caused by enterovirus 71[J]. Clin Infect Dis, 2004, 38 (12): 1784–1788. DOI:10.1086/421021 |
| [6] | Wang SM, Lei HY, Liu CC. Cytokine immunopathogenesis of enterovirus 71 brain stem encephalitis[J]. Clin Dev Immunol, 2012, 2012 : 876241. |
| [7] | Zhang Y, Liu H, Wang L, et a1. Comparative study of the cytokine/chemokine response in children with differing disease severity in enterovirus 71-induced hand, foot, and mouth disease[J]. PLoS One, 2013, 8 (7): e67430. |
| [8] | Zipes DP, Camm AJ, Borggrefe M, et al. ACC/AHA/ESC 2006 Guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death[J]. JACC, 2006, 48 (5): e247–e346. DOI:10.1016/j.jacc.2006.07.010 |
| [9] | Kim Y, Hwang W, Cho ML, et al. The effects of intraoperative esmolol administration on perioperative inflammatory responses in patients undergoing laparoscopic gastrectomy:a dose-response study[J]. Surg Innov, 2015, 22 (2): 177–182. DOI:10.1177/1553350614532534 |
| [10] | Er F, Dahlem KM, Nia AM, et al. Randomized control of sympathetic drive with continuous intravenous esmolol in patients with acute ST-segment elevation myocardial infarction:the BEtA-blocker therapy in acute myocardial infarction (BEAT-AMI) trial[J]. JACC Cardiovasc Interv, 2016, 9 (3): 231–240. DOI:10.1016/j.jcin.2015.10.035 |
| [11] | 中华人民共和国卫生部. 手足口病诊疗指南(2010年版)[EB/OL]. (2010-04-20). http://www.nhfpc.gov.cn/yzygj/s3593g/201306/6d935c0f43cd4a1fb46f8f71acf8e245.shtml. |
| [12] | 卫生部手足口病临床专家组. 肠道病毒7l型(EV71)感染重症病例临床救治专家共识[J]. 中华儿科杂志, 2011, 49 (9): 675–678. |
| [13] | Garnock-Jones KP. Esmolol:a review of its use in the short-term treatment of tachyarrhythmias and the short-term control of tachycardia and hypertension[J]. Drugs, 2012, 72 (1): 109–132. DOI:10.2165/11208210-000000000-00000 |
| [14] | Gui P, Wu Q, Wu J, et al. Protective effect of esmolol on myocardial ischemic injury during open heart surgery in children[J]. Paediatr Anaesth, 2013, 23 (3): 217–221. DOI:10.1111/pan.12117 |
| [15] | Wang Z, Wu Q, Nie X, et al. Infusion of esmolol attenuates lipopolysaccharide-induced myocardial dysfunction[J]. J Surg Res, 2016, 200 (1): 283–289. DOI:10.1016/j.jss.2015.07.015 |
| [16] | Srivastava VK, Agrawal S, Gautam SK, et al. Comparative evaluation of esmolol and dexmedetomidine for attenuation of sympathomimetic response to laryngoscopy and intubation in neurosurgical patients[J]. J Anaesthesiol Clin Pharmacol, 2015, 31 (2): 186–190. DOI:10.4103/0970-9185.155146 |
| [17] | Liu H, Wang C, Liu L, et al. Perioperative application of N-terminal pro-brain natriuretic peptide in patients undergoing cardiac surgery[J]. J Cardiothorac Surg, 2013, 8 : 1. DOI:10.1186/1749-8090-8-1 |
| [18] | Ndumele CE, Matsushita K, Sang Y, et al. N-Terminal pro-brain natriuretic peptide and heart failure risk among individuals with and without obesity:the atherosclerosis risk in communities (ARIC) study[J]. Circulation, 2016, 133 (7): 631–638. DOI:10.1161/CIRCULATIONAHA.115.017298 |
| [19] | Groenning BA, Raymond I, Hildebrandt PR, et al. Diagnostic and prognostic evaluation of left ventricular systolic heart failure by plasma N-terminal pro-brain natriuretic peptide concentrations in a large sample of the general population[J]. Heart, 2004, 90 (3): 297–303. DOI:10.1136/hrt.2003.026021 |
| [20] | Huang SW, Lee YP, Hung YT, et a1. Exogenous interleukin-6, interleukin-13, and interferon-γ provoke pulmonary abnormality with mild edema in enterovirus 71-infected mice[J]. Respir Res, 2011 (12): 147. |
| [21] | Liang Y, Zhou X, Yang E, et al. Analysis of the Th1/Th2 reaction in the immune response induced by EV71 inactivated vaccine in neonatal rhesus monkeys[J]. J Clin Immunol, 2012, 32 (5): 1048–1058. DOI:10.1007/s10875-012-9690-3 |
| [22] | Metelev VG, Kubareva EA, Oretskaya TS. Regulation of activity of transcription factor NF-kappaB by synthetic oligonucleotides[J]. Biochemistry (Mosc), 2013, 78 (8): 867–878. DOI:10.1134/S0006297913080026 |
 2017, Vol. 19
2017, Vol. 19