肺出血(pulmonary hemorrhage,PH)是早产儿常见的并发症,病死率较高。PH的发生率在不同的报道中有所不同[1-3],其中大量肺出血(massive pulmonary hemorrhage,MPH)的发生率为4%[3]。PH临床症状明显时,出血量通常量较大,同时死亡的风险增加[4-5]。目前国内外关于PH的研究主要集中于极低出生体重(VLBW)患儿或胎龄小于30周的早产儿,而且国内也没有仅针对超低出生体重(extremely low birth weight,ELBW)患儿的研究,而临床上ELBW患儿的生理特点与VLBW患儿并不完全一致[6]。本研究希望通过对发生MPH的ELBW患儿进行分析,探讨该群体MPH发生的高危因素及临床特点。
1 资料与方法 1.1 研究对象选取2009年1月至2015年12月我院收治的35例发生MPH的ELBW患儿为肺出血组(MPH组)。MPH是指气管插管内出现新鲜血,血液中红细胞压积下降10%以上以及胸片上新出现的透过度下降[1];同期未发生PH的ELBW患儿176例为对照组。两组中正常出院患儿(指生长发育良好,生命体征平稳,除外死亡、病情危重退院及家属等其他因素退院的患儿)120例,其中MPH组6例,对照组114例。正常出院患儿均完善头颅磁共振检查。
纳入标准:(1)出生体重<1 000 g;(2)符合新生儿MPH诊断标准[1, 7]。
排除标准:(1)存活时间<12 h;(2)先天性畸形或遗传代谢病的患儿。
1.2 资料采集(1) 病史资料:包括患儿胎龄、出生体重、性别、1 min及5 min Apgar评分、出生方式、是否为小于胎龄儿;孕母是否有妊娠期高血压、妊娠期糖尿病、胎膜早破、胎盘早剥、产前感染、产前激素使用病史。
(2) 临床资料:包括是否有新生儿呼吸窘迫综合征(RDS)、动脉导管未闭(PDA)、早发型败血症(early-onset septicemia,EOS)、呼吸机相关性肺炎(ventilator-associated pneumonia,VAP)、晚发型败血症(late-onset septicemia,LOS)及是否应用肺泡表面活性物质(PS)、辅助通气时间、吸氧时间及住院时间。
(3) 死亡及主要合并症情况:包括死亡、颅内出血、支气管肺发育不良(BPD)、坏死性小肠结肠炎(NEC)、早产儿视网膜病(ROP)的发生情况。其中颅内出血通过头颅磁共振或腰椎穿刺液性质确诊。
1.3 统计学分析采用SPSS 19.0统计软件进行统计学分析,计量资料以均数±标准差(x±s)表示,两组间比较采用t检验;计数资料采用率(%)表示,组间比较采用χ2检验。采用多因素logistic回归性分析对危险因素进行分析。P<0.05为差异有统计学意义。
2 结果 2.1 一般情况本研究纳入的211例ELBW患儿中,MPH患儿35例(16.6%),死亡19例,正常出院 6 例,非正常出院10例;MPH发生时间为生后12~70 h,平均40±16 h;MPH患儿中应用PS 4例(11%),无创通气 3例(9%),有创通气 32例(91%)。对照组患儿中,死亡18例,正常出院120例,非正常出院38例。
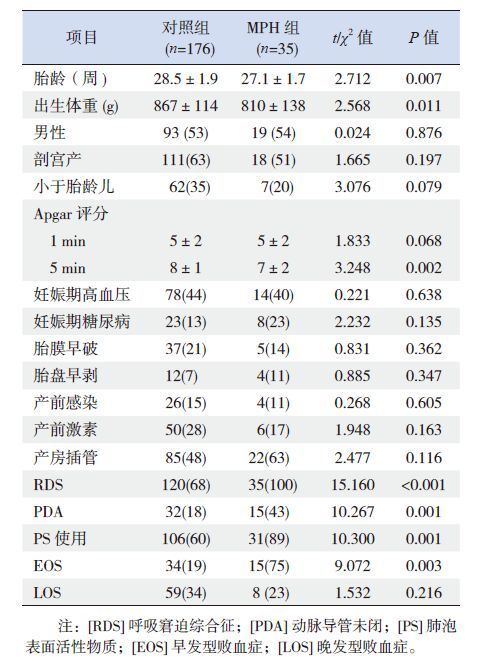
2.2 单因素分析结果对照组患儿胎龄及出生体重均大于MPH组(P<0.05),生后5 min Apgar评分均高于MPH组(P<0.01);MPH组患儿RDS、PDA、EOS的发生率及PS的使用率均大于对照组(P<0.01);两组性别、出生方式、是否为小于胎龄儿、1 min Apgar评分、孕母妊高症、妊娠期糖尿病、胎膜早破、胎盘早剥、产前感染发生率及产前激素、产房插管的使用率、VAP及LOS的发生率的差异均无统计学意义。见表 1。
| 表 1 MPH 高危因素的单因素分析 [(x±s)或n(%)] |
2.3 多因素logistic回归分析结果
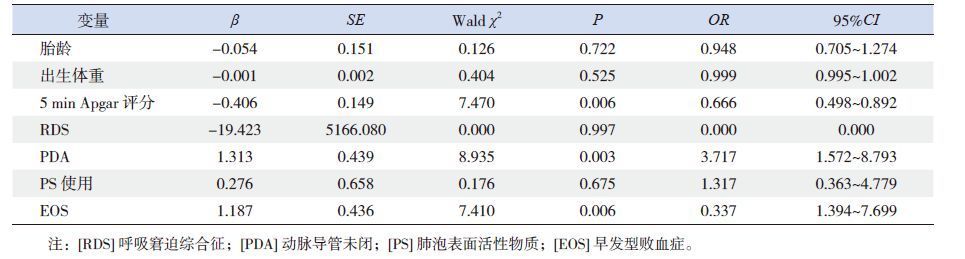
将单因素分析有意义的因素(胎龄、出生体重、5 min Apgar评分、RDS、PDA、PS使用、EOS)纳入多因素logistic回归模型中,发现5 min Apgar评分越高,MPH的发生率越低,说明较高的5 min Apgar评分是MPH的保护因素,而合并PDA、EOS是MPH发生的独立危险因素,见表 2。
| 表 2 MPH 高危因素的logistic 回归分析 |
2.4 并发症及预后分析
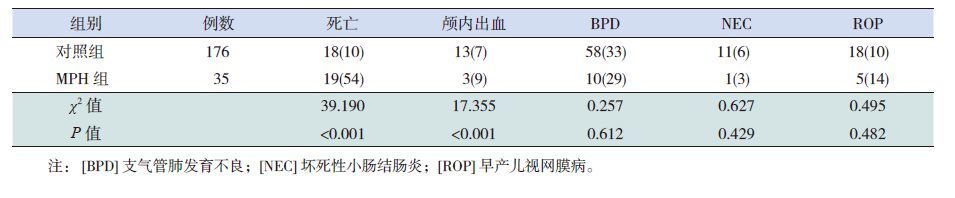
MPH组患儿死亡及颅内出血的发生率高于对照组(P<0.01);而BPD、NEC及ROP的发生率在两组间比较差异均无统计学意义(P>0.05)。见表 3。
| 表 3 两组并发症及预后比较 [n(%)] |
2.5 两组正常出院患儿临床资料比较
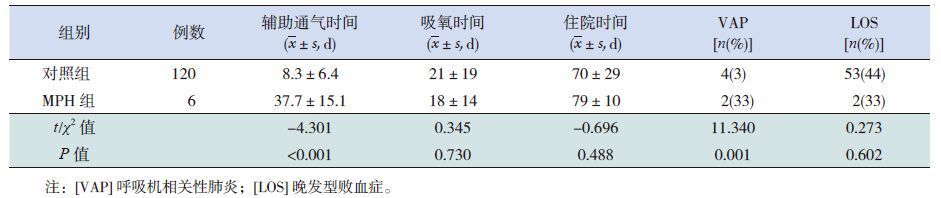
在正常出院的126例患儿中,MPH组辅助通气时间及VAP的发生率高于对照组(P<0.01);两组吸氧时间、住院时间及LOS发生率的差异均无统计学意义。同时两组患儿颅内出血、BPD、NEC及ROP的发生率的差异均无统计学意义。见表 4。
| 表 4 两组正常出院患儿临床资料的比较 |
3 讨论
PH是EBLW患儿常见的并发症,病死率及致残率极高[5]。PH的发生率报道不尽相同,Lin等[1]报道VLBW患儿PH的发生率为5.9%,Kluckow等[2]报道胎龄<30周PH的发生率为9.5%。另外一项研究显示活产儿PH的发生率为6.7%,<1 500 g为8%,<1 000 g为11%[8]。
关于PH的病因,目前并不十分清楚[9]。本研究中MPH组胎龄、出生体重均小于对照组,5 min Apgar评分低于对照组,与相关研究一致[3, 5],而且MPH组患儿PDA的发生率明显高于对照组,是MPH的独立高危因素。PDA可以引起左向右分流,从而导致肺血管床的高流量及高压力状态,尤其是应用过PS,肺血管阻力迅速下降,导管分流致肺血流增加,从而引起PH。Kluckow等[2]报道PH与明显的导管分流及肺脏高血流量相关,导管直径和右室流出量增加可能导致早期的PH。大导管的患儿早期应用吲哚美辛,PH的发生率低于未使用吲哚美辛治疗患儿(2% vs 21%),生后1周内预防性使用吲哚美辛可以将PH减少35%[10]。本研究发现MPH组患儿RDS的发生率和PS的使用率均高于对照组,考虑渗透性增高发生肺水肿,毛细血管充血从而引起PH,而PS也可使肺血流迅速增多,从而引起PH[4]。另外,本研究发现EOS是MPH发生的独立危险因素,而LOS则与PH发生无明显关系。宫内或出生时发生感染,内毒素的释放及微血管通透性的增高可能会引起PH。多因素logistic 回归分析发现较高的5 min Apgar评分是MPH的保护因素,说明生后5 min内建立有效的通气,保证循环功能正常能够降低PH的发生。有研究报道,小于胎龄儿及产房插管是PH高危的因素[4, 11],但本研究未发现两者与PH的发生相关。
另外,本研究发现孕母的一些高危因素,如妊娠期高血压、妊娠期糖尿病、胎膜早破、胎盘早剥、产前感染及激素的应用与新生儿MPH无相关性,提示孕母的一些常见疾病不会影响PH的发生。
有研究发现PH是VLBW患儿重要的合并症,可增加患儿的病死率及致残率[12]。本研究中211例ELBW患儿中,MPH组的病死率明显高于对照组。Tsou等[13]关于1997~2006年间早产儿死亡原因的研究发现,10.5%的早产儿死亡原因为PH。
本研究发现,MPH组颅内出血的发生率高于对照组,提示MPH可以引起脑血流变化、凝血功能障碍、缺氧导致颅内出血。MPH组患儿机械通气时间较对照组长,VAP的发生率也明显高于对照组,提示PH后发生的肺损伤需要一定时间修复,而且机械通气时间越长,发生VAP的风险越大。
综上,本研究发现较高的5 min Apgar评分是ELBW 患儿发生MPH的保护因素,而合并PDA、EOS是发生MPH的危险因素。发生PH的ELBW患儿病死率及发生颅内出血的风险更高,应用机械通气时间更长,发生VAP的可能性更大。但是由于本研究中病例较少,研究结果可能存在偏倚。继续收集相关病例,进行大样本分析是本课题组下一步工作的重点。
| [1] | Lin TW, Su BH, Lin HC, et al. Risk factors of pulmonary hemorrhage in very-low-birth-weight infants:a two-year retrospective study[J]. Acta Paediatr Taiwan, 2000, 41 (5): 255–258. |
| [2] | Kluckow M, Evans N. Ductal shunting, high pulmonary blood flow, and pulmonary hemorrhage[J]. J Pediatr, 2000, 137 (1): 68–72. DOI:10.1067/mpd.2000.106569 |
| [3] | Chen YY, Wang HP, Lin SM, et al. Pulmonary hemorrhage in very low-birthweight infants:risk factors and management[J]. Pediatr Int, 2012, 54 (6): 743–747. DOI:10.1111/ped.2012.54.issue-6 |
| [4] | Zahr RA, Ashfaq A, Marron-Corwin M. Neonatal pulmonary hemorrhage[J]. Neo Reviews, 2012, 13 (5): 302–306. |
| [5] | Aziz A, Ohlsson A. Surfactant for pulmonary haemorrhage in neonates[J]. Cochrane Database Syst Rev, 2012 (7): CD005254. |
| [6] | Ringer SA. Care of the extremely low birth weight infant[M]//Cloherty JP, Eichenwald EC, Hansen AR, et al. Manual of Neonatal Care. 7th ed. Philadelphia:Lippincott Williams & Willkins, 2011:154-165. |
| [7] | 中华医学会儿科学分会新生儿组, 中华儿科杂志编辑委员会. 新生儿肺出血的诊断及治疗方案[J]. 中华儿科杂志, 2001, 39 (4): 248. |
| [8] | Ferreira CH, Carmona F, Martinez FE. Prevalence, risk factors and outcomes associated with pulmonary hemorrhage in newborns[J]. J Pediatr (Rio J), 2014, 90 (3): 316–322. DOI:10.1016/j.jped.2013.12.008 |
| [9] | Hansen TN, Corbet A. Pulmonary physiology of the newborn[M]//Taeusch HW, Ballard RA, Gleason CA, et al. Avery's Diseases of the Newborn. 8th ed. Philadelphia:Saunders, 2005:634-647. |
| [10] | Kluckow M, Jeffery M, Gill A, et al. A randomised placebo-controlled trial of early treatment of the patent ductus arteriosus[J]. Arch Dis Child Fetal Neonatal Ed, 2014, 99 (2): F99–F104. DOI:10.1136/archdischild-2013-304695 |
| [11] | Scholl JE, Yanowitz TD. Pulmonary hemorrhage in very low birth weight infants:a case-control analysis[J]. J Pediatr, 2015, 166 (4): 1083–1084. DOI:10.1016/j.jpeds.2014.12.032 |
| [12] | Pandit PB, O'Brien K, Asztalos E, et al. Outcome following pulmonary haemorrhage in very low birthweight neonates treated with surfactant[J]. Arch Dis Child Fetal Neonatal Ed, 1999, 81 (1): F40–F44. DOI:10.1136/fn.81.1.F40 |
| [13] | Tsou KI, Tsao PN, Taiwan Infant Development Collaborative Study Group. The morbidity and survival of very-low-birth-weight infants in Taiwan[J]. Acta Paediatr Taiwan, 2003, 44 (6): 349–355. |
 2017, Vol. 19
2017, Vol. 19