患儿,男,8个月,因喂养困难伴运动发育落后8个月、眼球震颤4个月入院。患儿系第1胎第1产,足月剖宫产出生,出生体重3.0 kg、身长50 cm,无缺氧窒息史。自生后即被发现吸吮无力、喂养困难、嗜睡;1.5月龄出现体重不增、双侧眼球运动不同步;2月龄发现患儿追听、追视落后;3月龄时患儿俯卧抬头可至4°、持续约10 s,并间断出现肌张力低下,3.5个月开始康复训练;4月龄时出现眼球水平方向快速运动,每次持续约数秒至十余秒,以后逐渐发作频繁、持续时间延长,并伴痉挛发作:表现为上肢外旋、四肢肌张力增高、闭目不能,发作时可吃奶、间断哭笑、对外界刺激有反应,每次发作持续时间数秒至4 h;5月龄时逐步出现运动发育倒退,至今不能抬头、独坐、翻身,偶有肢体不自主运动。入院前3周开始维生素B6口服,每次100 mg、每天两次。
患儿新生儿期因“新生儿低血糖、低血糖脑损伤、代谢性酸中毒、髓鞘发育迟缓”住院治疗,颅脑MRI提示髓鞘发育延迟、低血糖脑损伤改变,脑电图无异常。血氨基酸+酰基肉碱谱分析提示多种酰基肉碱增高,一周后复查恢复正常;1月龄时复查提示丙氨酸、甘氨酸、鸟氨酸、丝氨酸升高,游离肉碱及多种酰基肉碱浓度降低,尿有机酸分析提示非酮性双羧酸尿,建议排除肝功能受损或脂肪酸代谢异常;3月龄时血氨基酸+酰基肉碱谱分析未见显著异常。6月龄时经患儿家属知情同意,行患儿及其父母的代谢性疾病基因筛查(北京益普康达医学科技有限公司),发现多巴胺脱羧酶(dopa decarboxylase,DDC)基因新双重杂合突变:c.1063dupA和c.250A>C,患儿父亲DDC基因c.250A>C突变,患儿母亲DDC基因c.1063dupA突变;染色体核型分析:46,XY。
患儿父亲育龄30岁、母孕龄28岁,父母体健,非近亲婚配,否认家族史。
入院体查:神志清楚,体温36.0℃,呼吸30次/min,心率 110次/min,血压 100/54 mm Hg,体重7.3 kg,身长71.0 cm,前囟平软,上睑下垂,皮肤、头发色浅,双肺呼吸音清晰,心音有力、律齐、无杂音,腹软,肝、脾无肿大,四肢肌力、肌张力低下。
实验室检查:血常规、尿常规未见异常;血乳酸、血糖、血氨未见异常;肝肾功能、心肌酶谱未见异常;心电图无异常。视频脑电图未见异常。
2 诊断思维患儿以肌无力、运动发育落后、倒退、眼球震颤、痉挛发作为主要特点,康复治疗无好转。患儿肌酸激酶正常,不支持肌病。患儿以进行性脑病症状为表现,代谢性脑病不能排除,而且伴有黑色素生成减少的表现如皮肤、头发色浅,尤其需警惕四氢生物蝶呤缺乏、多巴胺相关代谢障碍等疾病。已有的代谢相关产物检测未能发现异常,故进一步行代谢性疾病基因筛查,发现DDC基因双重杂合突变。
3 进一步检查结合患儿病史及DDC基因新突变,诊断考虑芳香族L-氨基酸脱羧酶(aromatic L-amino acid decarboxylase,AADC)缺乏症可能性较大。目前我国台湾已开展AADC缺乏症的干血滤纸片筛查,联系台湾大学医学院附设医院,送检患儿血滤纸片,液相色谱-串联质谱法检测3-O-甲基多巴,结果:1 052.89 ng/mL (正常值:< 300 ng/mL),明显升高,支持诊断。
4 确诊依据结合患儿临床特点及DDC基因结果、血滤纸片3-O-甲基多巴水平检测,确诊为AADC缺乏症。(1)出生后即出现症状:吸吮无力、喂养困难、嗜睡,继之体重不增,生长发育落后,运动倒退,肌张力低下,动眼危象,痉挛发作,多汗和睡眠障碍;(2)DDC基因外显子区域两处杂合突变,血滤纸片3-O-甲基多巴水平明显升高。
5 临床经过AADC缺乏症尚无成熟有效的治疗方法。经检索文献制定治疗方案,取得患儿监护人知情同意后采用多巴胺受体激动剂(盐酸普拉克索森)、儿茶酚-O-甲基转移酶(catechol-O-methyltransferase,COMT)抑制剂(恩他卡朋)并联合维生素B6的治疗方案。入院第1天即口服盐酸普拉克索森,每次0.02 mg(0.25 mg/片)、每日3次,以及维生素B6(每次100 mg、每日两次)。3 d后患儿上睑下垂缓解,痉挛发作由每2~3 d一次转变为每3~5 d一次,每次发作持续时间仍约3~4 h;眼球震颤频率较前减小,肢体不自主运动较前增多,但大运动功能、多汗等症状改善不明显。住院第11天加用恩他卡朋口服,每次0.02 g、每日5次,2 d后患儿眼球震颤消失,痉挛发作由夜间转为白天,因发作间隔缩短至2~3 d,并且有一次痉挛发作伴1~2 min的喉鸣、吸气性呼吸困难,予以恩他卡朋逐步减量至停药。治疗过程中患儿血压81~85/47~55 mmHg,无低血压、低血糖发生,20 d后出院。出院后继续原剂量口服盐酸普拉克索森、维生素B6,2周后再次加用恩他卡朋(每次0.02 g、每日2次)口服。出院后偶有间断停用普拉克索森、恩他卡朋,治疗2个月后,患儿出现体重减轻,排便困难。1岁2个月时(治疗半年后),患儿可发“爸爸”、“妈妈”等叠音,运动机能无明显改变,动眼危象伴痉挛发作仍有发生,每3~5 d夜间发作一次、每次持续3~5 h,家属自觉患儿发作时追听、追视增强,发作后2 h肌张力增强。
6 讨论AADC缺乏症是一种罕见的常染色体隐性遗传病,为AADC酶缺陷导致的先天性神经递质生物合成代谢紊乱,目前报道不到100例,主要表现为肌张力低下、动眼危象、发育落后和睡眠障碍、多汗等。Hyland等[1]在1992年首次对AADC缺乏症的临床特点、诊断及治疗进行了报道。我国除香港、台湾地区,尚无对于该病的报道。
AADC也称DDC,主要存在于神经组织和外周组织(如肝、肾),为左旋多巴转变为多巴胺、5-羟色氨酸转变为血清素/5-羟色胺过程中的限速酶,吡哆醇为这一生物过程的辅酶[2]。AADC缺陷将导致多巴胺、5-羟色胺、儿茶酚胺等神经递质生物合成代谢紊乱(见图 1),引起相应的临床症状[3]:多巴胺不足可表现为运动功能减退、肌张力障碍、远端舞蹈病、动眼危象;去甲肾上腺素不足可引起上睑下垂、瞳孔缩小、多涎、低血糖、体位性低血压、心动过缓、植物神经功能紊乱等;5-羟色氨减少可引起睡眠障碍、记忆、学习和行为障碍等症状。AADC患儿表现为生长发育落后、肌张力低下、不自主运动、自主神经功能紊乱、动眼危象、进行性脑病等;少部分有慢性腹泻,与去甲肾上腺素降低时乙酰胆碱活性无拮抗、肠蠕动加快、括约肌松弛、肠分泌受到刺激有关[2]。动眼危象亦名动眼痉挛,是肌张力障碍的一种类型,为眼外肌强直痉挛,表现为发作性两眼向上或一侧窜动,持续数秒至数小时,尚可出现调节辐辏障碍,垂直性(向上、向下)凝视麻痹等,个别可出现发作性眼睑痉挛。本例患儿有眼球震颤、闭目不能等动眼危象的表现以及运动功能减退、肌张力低下、多汗、睡眠障碍等,符合AADC缺乏症临床表现。
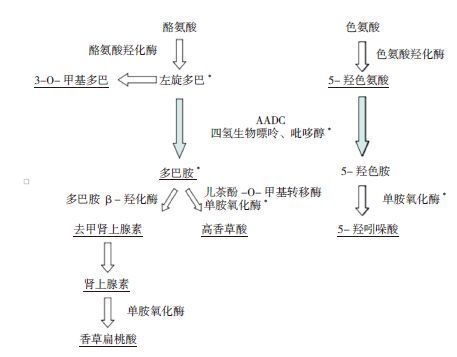
|
图 1 单胺类生物合成路径[2] 标记下划线者示经脑脊液/ 尿液可检测;标记* 者为AADC 缺乏症治疗的靶点。 |
AADC缺乏症患儿通常在出生时或生后数天至数月出现症状,约50%的患儿在1.6岁左右出现相关症状,由于AADC缺乏症临床症状不典型,以及人们对该病的认识不足和检查手段的局限性,AADC缺乏症的诊断通常延迟,平均确诊年龄为3.9岁,大部分患儿在5~6岁死亡[4]。
脑脊液中神经递质水平的检测可协助AADC缺乏症的诊断,典型患者的脑脊液神经递质分析提示3-O-甲基多巴、左旋多巴、5-羟色氨酸水平增加,以及高香草酸和5-羟吲哚酸下降[5]。AADC缺乏症的颅脑MRI可出现萎缩、脱髓鞘和白质变化;脑电图无特异性改变。内分泌检查可以发现催乳素升高、低血糖、生长激素缺乏。Lee等[2]通过尿液代谢检查诊断1例15岁男性AADC缺乏症患儿,该患儿婴儿期出现肌张力低下、发育迟缓、上睑下垂和动眼危象,5岁出现慢性腹泻,15岁经尿液代谢物检查发现香草乳酸、3-O-甲基多巴、N-乙酰-香草丙氨酸升高以及5-羟吲哚酸、香草扁桃酸减少,随后通过脑脊液检查和基因突变分析确诊。Atwal等[6]通过血浆代谢组学分析发现,AADC缺乏症患儿的血浆3-O-甲基多巴明显升高,因此血浆代谢组学分析可作为AADC缺乏症早期诊断的初筛方法。Chen等[7]在我国台湾地区开展了干血滤纸片3-O-甲基多巴水平检测,以进行AADC缺乏症高危筛查和新生儿筛查;该课题组还对127 987名新生儿进行了3-O-甲基多巴水平的检测,以3-O-甲基多巴水平>500 ng/mL为阳性,发现并确诊4名新生儿患有AADC缺乏症,认为该方法简便而且准确性较高[8]。本例患儿3-O-甲基多巴水平明显升高,支持AADC缺乏症诊断。
DDC 基因定位于染色体7p12.2。目前已报道的80多例AADC缺乏症筛查发现DDC基因存在28种错义突变,其中18种为纯合突变[9]。本例患儿新生儿期即出现吸吮无力、低血糖、髓鞘发育迟缓,如果尽早行脑脊液/血液/尿液的相关代谢检查及基因检测可能早期诊断AADC缺乏症;基因检测发现患儿DDC基因外显子区域两处分别来自于父母的杂合突变:c.1063dupA和c.250A>C,导致氨基酸改变p.I355fs,p.S84R(异亮氨酸>移码突变,丝氨酸>精氨酸)。此突变HGMDpro数据库未见报道,致病性尚不明确。但结合患儿临床表现及血3-O-甲基多巴明显升高,可确诊为AADC缺乏症,患儿DDC基因两处杂合突变可能具有致病性。
AADC缺乏症治疗的目的是纠正5-羟色胺和儿茶酚胺的中枢和外周的不足,减轻症状,但并不能降低死亡率[4]。首选AADC辅酶吡哆醇联合多巴胺受体激动剂,单胺氧化酶(monamine oxidase,MAO)抑制剂、抗胆碱药、褪黑素也可用于该病的治疗。据报道[2-3, 9-10],多巴胺受体激动剂(如溴隐亭、培高利特等)、吡哆醇可以改善患儿运动障碍;选择性的MAO-B抑制剂(如司来吉兰等)可缓解动眼危象、改善肌张力和胃肠功能紊乱、唾液分泌过多和睡眠障碍。磷酸吡哆醛较吡哆醇可能更有效,但其有效剂量尚不明确、效果有待观察[11]。Tay等[12]报道2例AADC轻症患者,表现为运动发育落后、易疲劳、嗜睡,给予MAO-B抑制剂司来吉兰以及吡哆醇治疗,效果较好。Alfadhel[3]报道1例8月龄AADC缺乏症患儿对吡哆醇、溴隐亭治疗无反应。Mastrangelo等[13]报道接受多巴胺受体激动剂罗替高汀经皮给药治疗的2例AADC缺乏症兄弟,12岁弟弟用药后运动迟缓症状减轻,动眼危象消失,多涎、缺乏面部表情、直立性低血压、睡眠障碍等无明显改善;17岁哥哥无明显效果。COMT主要灭活儿茶酚胺类递质,如肾上腺素、去甲肾上腺素、异丙肾上腺素、多巴胺,其抑制剂理论上可用于AADC缺乏症的治疗。恩他卡朋属于一种可逆的、特异性的、主要作用于外周的COMT抑制剂,通过抑制COMT减少,左旋多巴代谢为3-O-甲基多巴,使左旋多巴的生物利用度增加,并增加脑内可利用的左旋多巴。本例患儿予维生素B6联合多巴胺受体激动剂治疗后,上睑下垂、动眼危象缓解,运动机能似有改善;加用COMT抑制剂后动眼危象改为白天发作,眼球震颤消失,但维持一段时间后症状反复。由于无法监测COMT抑制剂血药浓度、神经递质及旁路代谢产物水平,尚不能明确此类药物的安全性及有效性,随后停药。
有研究表明[14-16],基因治疗可能改善AADC缺乏症儿童的运动机能。2012年,Hwu等[14]报道将腺病毒相关载体连接的AADC基因转入4例4~6岁AADC缺乏症患儿的大脑壳核区,1例患儿在基因转入16个月后可站立,另3例在基因转入6~15个月后能够在支撑下坐立。基因治疗对于AADC缺乏症的儿童是可行的,但目前仍存在一些缺陷,安全性及稳定性有待提升,在克服部分缺陷之后,相信基因治疗AADC缺乏症可成功应用于临床[17]。
7 结语由于AADC缺乏症的临床症状与脑瘫或癫痫等常见疾病有相似之处,因此容易被误诊。本文首次在国内报道了1例AADC缺乏症,该患儿生后即出现嗜睡、喂养困难,随后逐渐出现肌张力低下、运动落后、动眼危象等表现,多次行血氨基酸、尿有机酸分析无特异性提示,代谢性疾病基因筛查发现DDC基因新双重杂合突变,进一步行血滤纸片3-O-甲基多巴检测,证实了诊断。临床医师应提高对AADC缺乏症这一罕见病的识别能力,对肌张力低下、运动落后、动眼危象患儿应考虑到此病,建议有条件的医院开展血3-O-甲基多巴水平的新生儿筛查,必要时予以基因检测,以期早期诊断及治疗,并为有需要的家庭提供遗传咨询及产前诊断。期待基因治疗能进一步成熟、更有效地改善AADC缺乏症的预后。
| [1] | Hyland K, Surtees RA, Rodeck C, et al. Aromatic L-amino acid decarboxylase deficiency:Clinical features, diagnosis, and treatment of a new inborn error of neurotransmitter amine synthesis[J]. Neurology, 1992, 42 (10): 1980–1988. DOI:10.1212/WNL.42.10.1980 |
| [2] | Lee LK, Cheung KM, Cheng WW, et al. A rare cause of severe diarrhoea diagnosed by urine metabolic screening:aromatic L-amino acid decarboxylase deficiency[J]. Hong Kong Med J, 2014, 20 (2): 161–164. |
| [3] | Alfadhel M, Kattan R. Aromatic amino acid decarboxylase deficiency not responding to pyridoxine and bromocriptine therapy:case report and review of response to treatment[J]. J Cent Nerv Syst Dis, 2014, 6 : 1–5. |
| [4] | Brun L, Ngu LH, Keng WT, et al. Clinical and biochemical features of aromatic Lamino acid decarboxylase deficiency[J]. Neurology, 2010, 75 (1): 64–71. DOI:10.1212/WNL.0b013e3181e620ae |
| [5] | Haliloğlu G, Vezir E, Baydar L, et al. When do we need to perform a diagnostic lumbar puncture for neurometabolic diseases? Positive yield and retrospective analysis from a tertiary center[J]. Turk J Pediatr, 2012, 54 (1): 52–58. |
| [6] | Atwal PS, Donti TR, Cardon AL, et al. Aromatic L-amino acid decarboxylase deficiency diagnosed by clinical metabolomic profiling of plasma[J]. Mol Genet Metab, 2015, 115 (2-3): 91–94. DOI:10.1016/j.ymgme.2015.04.008 |
| [7] | Chen PW, Lee NC, Chien YH, et al. Diagnosis of aromatic L-amino acid decarboxylase deficiency by measuring 3-O-methyldopa concentrations in dried blood spots[J]. Clin Chim Acta, 2014, 431 : 19–22. DOI:10.1016/j.cca.2014.01.034 |
| [8] | Chien YH, Chen PW, Lee NC, et al. 3-O-methyldopa levels in newborns:Result of newborn screening for aromatic L-amino-acid decarboxylase deficiency[J]. Mol Genet Metab, 2016, 118 (4): 259–263. DOI:10.1016/j.ymgme.2016.05.011 |
| [9] | Montioli R, Dindo M, Giorgetti A, et al. A comprehensive picture of the mutations associated with aromatic amino acid decarboxylase deficiency:from molecular mechanisms to therapy implications[J]. Human Molecular Genetics, 2014, 23 (20): 5429–5440. DOI:10.1093/hmg/ddu266 |
| [10] | Manegold C, Hoffmann GF, Degen I, et al. Aromatic L-amino acid decarboxylase deficiency:clinical features, drug therapy and follow-up[J]. J Inherit Metab Dis, 2009, 32 (3): 371–380. DOI:10.1007/s10545-009-1076-1 |
| [11] | Allen GF, Land JM, Heales SJ. A new perspective on the treatment of aromatic L-amino acid decarboxylase deficiency[J]. Mol Genet Metab, 2009, 97 (1): 6–14. DOI:10.1016/j.ymgme.2009.01.010 |
| [12] | Tay SK, Poh KS, Hyland K, et al. Unusually mild phenotype of AADC deficiency in 2 siblings[J]. Mol Genet Metab, 2007, 91 (4): 374–378. DOI:10.1016/j.ymgme.2007.04.006 |
| [13] | Mastrangelo M, Caputi C, Galosi S, et al. Transdermal rotigotine in the treatment of aromatic L-amino acid decarboxylase deficiency[J]. Mov Disord, 2013, 28 (4): 556–557. DOI:10.1002/mds.25303 |
| [14] | Hwu WL, Muramatsu S, Tseng SH, et al. Gene therapy for aromatic L-amino acid decarboxylase deficiency[J]. Sci Transl Med, 2012, 4 (134): 134ra61. |
| [15] | Chtarto A, Bockstael O, Tshibangu T, et al. A next step in adeno-associated virus-mediated gene therapy for neurological diseases:regulation and targeting[J]. Br J Clin Pharmacol, 2013, 76 (2): 217–232. DOI:10.1111/bcp.2013.76.issue-2 |
| [16] | Lee NC, Chien YH, Hu MH, et al. Treatment of congenital neurotransmitter deficiencies by intracerebral ventricular injection of an adeno-associated virus serotype 9 vector[J]. Hum Gene Ther, 2014, 25 (3): 189–198. DOI:10.1089/hum.2013.170 |
| [17] | Kumar SR, Markusic DM, Biswas M, et al. Clinical development of gene therapy:results and lessons from recent successes[J]. Mol Ther Methods Clin Dev, 2016, 3 : 16034. DOI:10.1038/mtm.2016.34 |
 2017, Vol. 19
2017, Vol. 19


