患儿,女,2岁,因发育落后,间断抽搐1年半就诊。患儿于5月龄发热时出现惊厥发作,表现为双目向右侧凝视,呼之不应,伴或不伴有四肢阵挛性抽搐,每次持续约几分钟至1 h不等,约7~20 d发作1次,多为发热时或感冒时发作,外院诊断为“癫癎”。诊断为“癫癎”后一直口服左乙拉西坦治疗,但控制不良。头颅MRI检查未见异常。视频脑电图检查未见异常,发作间期无明显放电。后加用丙戊酸钠、妥泰、氯硝西泮均无效。患儿多次因惊厥持续状态住院治疗。患儿智力运动发育落后,3个月会抬头,5个月会翻身,1岁后会独坐,2岁来院就诊时仍不会走,不会说话,不认识家人。
出生史和家族史:患儿系第1胎第1产,足月、剖宫产(胎位不正)出生。出生体重3 kg。新生儿期曾因“缺氧及黄疸”住院治疗(病历丢失,家长描述不清)。3月龄时因颌下脓肿行手术治疗。父母体健,无特殊家族遗传病史。
实验室检查:血、尿常规及血肝肾功能、电解质检查均正常。多次视频脑电图检查大多正常或呈界线性(睡眠期中央、中线区小棘波发放)。头颅MRI正常。血、尿代谢筛查正常。发育商测定(大运动67,精细运动84,语言能59,应物能84,应人能76)。听性脑干反应检查未见异常。1岁8月龄行SCN1A基因检测,基因编码序列没有致病性突变位点。
2 诊断思维患儿来院时2岁,5月龄发热时首次抽搐发作,部分性发作,可继发全面强直阵挛发作,此后发热感冒时频繁抽搐发作,多次惊厥持续状态,多种抗癫癎药物治疗疗效差,伴有智力运动发育落后。既往多次视频脑电图及影像学、血尿代谢病筛查未见异常。根据患儿起病特点,考虑Dravet综合征不能除外,虽已行SCN1A基因检测阴性,仍不能完全除外。患儿系女性患儿,还应注意有无PCDH19基因突变,但患儿1岁后多次视频脑电图检查没有明显异常,且未出现Dravet综合征的其他发作类型。患儿新生儿期曾有“缺氧”病史,还应考虑到吡多醇依赖症可能。追问病史发现,患儿多次住院过程中在抗癫癎药治疗基础上给予吡哆醇静脉滴注,癫癎持续状态多在输液过程中缓解,出院后仅用抗癫癎药而未用吡哆醇维持治疗,抽搐反复发作,高度怀疑患儿系吡哆醇依赖性癫癎(pyridoxine-dependent epilepsy,PDE)。
3 进一步检查由于诊断不明确,故建议患儿全家进行癫癎基因包检测,重点检测ALDH7A1基因。采集患儿及其母亲(患儿父母离异,父亲未留血)外周血送基因检测。检测到患儿ALDH7A1基因(NM_006772)复合杂合变异:(1)c.977A>G,该变异导致p.Tyr326Cys氨基酸变化,杂合变异,母无来源;(2)c.1008+1G>A,杂合变异,母亲该位点亦有杂合变异(图 1)。
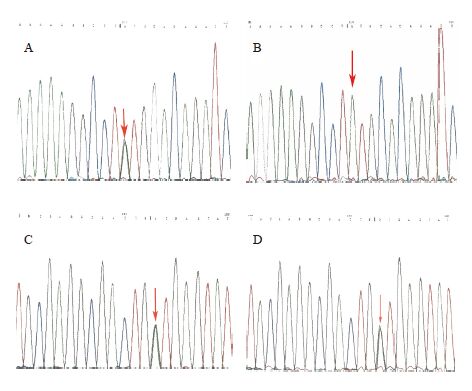
|
图 1 患儿及母亲ALDH7A1检测结果 A:患儿c.977A>G变异(编码区第977号核苷酸由A变为G),箭头所指为突变位点;B:患儿母亲c.977A位点无变异(箭头所示); C:患儿 c.1008+1G>A变异(编码区第1008号核苷酸后内含子中的第一个碱基由G变为A)(箭头所示); D:患儿母亲 c.1008+1G>A变异(箭头所示)。 中文注解 |
4 确诊依据
根据患儿临床表现以及基因检测分析结果,该患儿确诊为PDE。确诊依据包括:(1)患儿新生儿期曾有“缺氧”病史,婴儿期早期即出现难以控制的惊厥发作,多次呈癫癎持续状态,多种抗癫癎药物均不能控制发作,发热感冒时抽搐发作频繁;(2)多次视频脑电图检查未见明显异常;(3)吡哆醇治疗抽搐可控制;(4)ALDH7A1基因(NM_006772)检测到复合杂合变异。
5 临床经过根据患儿临床表现特点以及最终的基因检测分析结果,该患儿确诊为PDE,逐渐减停抗癫癎药物,仅单纯口服吡哆醇(每日10 mg/kg),发作基本控制。目前发热时偶尔抽搐1次,未再出现惊厥持续状态。随访至3岁,患儿智力运动仍有落后,较以前有所进步,能发单子音或偶有叠字音,行走平稳,认识妈妈。
6 讨论PDE是一种少见的常染色体隐性遗传性疾病,也是婴幼儿期起病的难治性癫癎之一。最早于1954年由Hunt等[1]报道1例新生儿耐药性癫癎静脉应用吡哆醇后发作控制,从而提出PDE的概念。PDE发病率曾有报道在1 : 400 000左右[2],实际发病率可能更高,与很多临床病例未被明确诊断有关。PDE临床特点:新生儿和婴儿早期出现常规抗癫癎药物难以控制的癫癎发作,多有惊厥持续状态[3];应用吡哆醇后癫癎发作立即停止,而应用其他抗癫癎药物无效;吡多醇撤药后癫癎发作反复。PDE患儿临床表现亦可不典型[4],表现为:围产期窒息;新生儿戒断综合征;脓毒症;肠炎;低血糖症;神经影像学异常(胼胝体、小脑畸形、出血、脑白质病变);生化异常(乳酸性酸中毒、电解质紊乱、神经递质异常)。PDE患儿宫内即可出现惊厥发作、出生时可出现Apgar评分减低和低脐带血氧等窒息表现,出生后常伴明显的烦躁、入睡困难和呕吐等脑病表现,因此常被误诊为缺氧缺血性脑病而遗漏了PDE的诊断[5]。 本研究报道的病例出生时有缺氧病史,未予重视,婴儿早期癫癎起病,首次癫癎发作为发热时频繁的部分性发作,多次癫癎持续状态,对热敏感,视频脑电图未见异常,这些均干扰了对PDE的考虑,更倾向于Dravet综合征。多次住院过程中,虽均给予了吡哆醇治疗,但同时也在不断地调整抗癫癎药的剂量或种类,所以癫癎发作虽被反复控制,但并未因此归因于吡哆醇的单纯作用,也因此造成诊断的延迟甚至漏诊。
随着分子遗传学的研究进展,目前PDE的诊断已经从临床拟诊发展到基因突变分析而确诊。Mills等[6]研究证实ALDH7A1基因为PDE患者体内存在的致病基因。本例通过ALDH7A1基因突变分析而确诊,且发现新的复合杂合突变,检测到的c.977A>G突变曾有报道与PDE相关[7],而检测到的c.1008+1G>A杂合变异尚未见文献报道,丰富了ALDH7A1基因的突变谱。
PDE确诊患儿应尽早开始惊厥发作急性期治疗,并应终身补充吡哆醇。推荐一般治疗剂量婴儿为每日15~30 mg/kg,新生儿高达200 mg/d,成人500 mg/d[8-9]。本例患儿确诊PDE后逐渐减停抗癫癎药物后仅单纯口服吡哆醇(每日10 mg/kg),发作基本控制,目前发热时偶尔抽搐1次,考虑与发热感染时体内吡哆醇的需要量增加有关。有些病例在患发热性疾病期间可能出现暴发性的惊厥发作,此期间可增大吡哆醇的治疗剂量(加倍)。PDE患儿在发育中,可能出现斜视、手足笨拙、失用、低智商[8,10]及言语表达差等临床表现[11]。仅极少数患儿经积极治疗后基本达到正常同龄儿智力水平或轻度智力落后[12-15]。本例患儿亦伴随智力运动发育落后。PDE预后影响因素较复杂,包括临床起病的早晚、有效治疗是否及时、吡哆醇治疗的并发症、ALDH7A1基因型和神经发育表型之间未知的关系等。PDE的预后存在较大的个体差异,早期诊断和早期治疗是改善预后至关重要的临床因素。
7 结语本例患儿新生儿期曾有“缺氧”病史,婴儿期早期即出现难以控制的惊厥发作,部分性发作为主,多次癫癎持续状态,多种抗癫癎药物均不能控制发作,发热感冒时抽搐发作频繁,曾考虑诊断为Dravet综合征,后通过ALDH7A1基因检测确诊为PDE。确诊PDE后逐渐减停抗癫癎药物仅单纯口服吡哆醇发作基本控制,但仍有明显智力运动发育落后。设想如能早期明确诊断,尽早补充吡哆醇治疗,及早控制癫癎发作,患儿生活质量能进一步提高。此病罕见,临床表现不典型,诊断较困难,易造成不同程度的误诊,因此对于一些新生儿及婴儿早期起病的难治性癫癎,可先予吡哆醇补充诊断性治疗,如应用后癫癎发作立即停止,而应用其他抗癫癎药物无效,吡多醇撤药后癫癎发作反复,应考虑到PDE的可能性,并应尽早行基因检测进一步确诊,而避免误诊误治。PDE患儿感染时期因吡哆醇需要量增多,抽搐可明显,应避免误诊为Dravet综合征而错过有效治疗。PDE患儿的预后存在较大的个体差异,早期诊断和早期治疗是改善预后至关重要的临床因素。因此,基因诊断的推广对疑诊患儿筛查、检出、遗传咨询、产前检查等都有极其重要的意义。
| [1] | Hunt AD Jr, Stokes J Jr, McCrory WW, et al. Pyridoxine dependency:report of a case of intractable convulsions in an infant controlled by pyridoxine[J]. Pediatrics, 1954, 13 (2): 140–145. |
| [2] | Been JV, Bok LA, Andriessen P, et al. Epidemiology of pyridoxine dependent seizures in the Netherlands[J]. Arch Dis Child, 2005, 90 (12): 1293–1296. DOI:10.1136/adc.2005.075069 |
| [3] | Yeghiazaryan NS, Zara F, Capovilla G, et al. Pyridoxine-dependent epilepsy:an under-recognised cause of intractable seizures[J]. J Paediatr Child Health, 2012, 48 (3): E113–E115. DOI:10.1111/jpc.2012.48.issue-3 |
| [4] | van Karnebeek CD, Tiebout SA, Niermeijer J, et al. Pyridoxine-dependent epilepsy:an expanding clinical spectrum[J]. Pediatr Neurol, 2016, 59 : 6–12. DOI:10.1016/j.pediatrneurol.2015.12.013 |
| [5] | Baxter P. Epidemiology of pyridoxine dependent and pyridoxine responsive seizures in the UK[J]. Arch Dis Child, 1999, 81 (5): 431–433. DOI:10.1136/adc.81.5.431 |
| [6] | Mills PB, Struys E, Jakobs C, et al. Mutations in antiquitin in individuals with pyridoxine-dependent seizures[J]. Nat Med, 2006, 12 (3): 307–309. DOI:10.1038/nm1366 |
| [7] | Nam SH, Kwon MJ, Lee J, et al. Clinical and genetic analysis of three Korean children with pyridoxine-dependent epilepsy[J]. Ann Clin Lab Sci, 2012, 42 (1): 65–72. |
| [8] | van Karnebeek CD, Jaggumantri S. Current treatment and management of pyridoxine-dependent epilepsy[J]. Curr Treat Options Neurol, 2015, 17 (2): 335. |
| [9] | Stockler S, Plecko B, Gospe SM Jr, et al. Pyridoxine dependent epilepsy and antiquitin deficiency:clinical and molecular characteristics and recommendations for diagnosis, treatment and follow-up[J]. Mol Genet Metab, 2011, 104 (1-2): 48–60. DOI:10.1016/j.ymgme.2011.05.014 |
| [10] | Bok LA, Halbertsma FJ, Houterman S, et al. Long-term outcome in pyridoxine-dependent epilepsy[J]. Dev Med Child Neurol, 2012, 54 (9): 849–854. DOI:10.1111/j.1469-8749.2012.04347.x |
| [11] | Basura GJ, Hagland SP, Wihse AM, et a1. Clinical features and the management of pyridoxine-dependent and pyridoxine-responsive seizures:review of 63 North American cases submitted to a patient registry[J]. Eur J Pediatr, 2009, 168 (6): 697–704. DOI:10.1007/s00431-008-0823-x |
| [12] | Oliveira R, Pereira C, Rodrigues F, et al. Pyridoxine-dependent epilepsy due to antiquitin deficiency:achieving a favourable outcome[J]. Epileptic Disord, 2013, 15 (4): 400–406. |
| [13] | Proudfoot M, Jardine P, Straukiene A, et al. Long-term follow-up of a successfully treated case of congenital pyridoxine-dependent epilepsy[J]. JIMD Rep, 2013, 10 : 103–106. |
| [14] | Riikonen R, Mankinen K, Gaily E. Long-term outcome in pyridoxine-responsive infantile epilepsy[J]. Eur J Paediatr Neurol, 2015, 19 (6): 647–651. DOI:10.1016/j.ejpn.2015.08.001 |
| [15] | Nasr E, Mamak E, Feigenbaum A, et al. Long-term treatment outcome of two patients with pyridoxine-dependent epilepsy caused by ALDH7A1 mutations:normal neurocognitive outcome[J]. J Child Neurol, 2015, 30 (5): 648–653. DOI:10.1177/0883073814531331 |
 2017, Vol. 19
2017, Vol. 19

