早产儿脑损伤是临床上早产儿最常见疾病之一,其发病主要与围生期缺氧缺血性损伤及感染相关[1]。脑室周围白质软化一直被认为是早产儿脑损伤的主要病理改变,然而近年来,国内外许多研究发现早产儿PVL同时伴有大脑皮质、海马、基底节、丘脑等多处白质损伤,远期随访也可见灰质相关认知功能下降[2]。因此,早产儿脑损伤不仅仅局限于白质,其相关的灰质损伤在临床上日益受到重视。
组蛋白乙酰化/去乙酰化调控是表观遗传学中研究的主要内容,组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂主要通过其功能基团与HDAC内Zn+形成螯合物,从而抑制HDAC活性,使核小体内组蛋白乙酰化程度增高,增加靶基因的转录及表达,其最早应用于抗肿瘤治疗[3]。近年来,研究发现HDAC抑制剂可通过增加组蛋白乙酰化水平对神经系统损伤发挥保护作用,其机制主要包括减少细胞凋亡、减少炎症反应、缩小梗死面积、促进细胞增殖和分化、以及增加新生血管等[4-8],但其在早产儿脑损伤模型中的作用尚不明确。
极早早产儿及早期早产儿由于处于脑白质少突胶质细胞发育易损期[9],因此被认为是临床上发生早产儿脑损伤的高危人群。流行病学调查显示极早早产儿发生脑损伤主要与缺氧缺血(hypoxic ischemia,HI)及感染相关 [10-11]。目前已有动物研究证实,脂多糖(lipopolysaccharide,LPS)预处理结合HI损伤可致新生大鼠大脑明显的白质及灰质损伤[12-13]。3日龄(P3)新生Sprague-Dawley(SD)大鼠脑发育程度(相当于人类28孕周左右)与极早及早期早产儿相似[14]。因此,本研究用LPS预处理结合HI建立P3 SD大鼠模型模拟早产儿脑损伤,并通过HDAC抑制剂丁酸钠处理,探讨增加组蛋白乙酰化程度在该模型脑皮层中的效应,为早产儿脑损伤的临床干预提供基础依据。
1 材料与方法 1.1 主要试剂6.5%氧气和93.5%氮气混合气(四川大学华西第二医院中央供气站);二氨基联苯胺(DAB);显色试剂盒(北京天根生化科技公司);ECL底物化学发光试剂(Pierce 公司,美国);BCA蛋白定量检测试剂盒(北京百泰克生物技术有限公司);乙烯(PVDF)膜(Millipore 公司,美国);LPS、丁酸钠、5-溴脱氧尿嘧啶核苷(BrdU)(Sigma公司,美国);兔抗鼠β-actin抗体、辣根过氧化物酶标记的抗兔IgG抗体(Santa Cruz公司,美国);兔抗鼠组蛋白H3(HH3)及乙酰化组蛋白H3(AH3)抗体、兔抗鼠脑源性神经营养因子(BDNF)抗体、小鼠抗大鼠神经元(NeuN)抗体(Millipore公司,美国);兔抗鼠活化型半胱天冬酶-3(CC3)抗体、兔抗鼠B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)抗体(CST公司,美国);山羊抗鼠BrdU抗体(Novus 公司,美国);荧光标记驴抗山羊IgG抗体、驴抗小鼠IgG抗体(Jackson公司,美国);4,6-二脒基-2-苯基吲哚(DAPI)染液(Sigma公司,美国);抗荧光淬灭剂(上海碧云天生物技术有限公司);激光共聚焦显微镜(Olympus公司,日本)。
1.2 实验动物及分组P3龄清洁级SD新生大鼠90只,雌雄不限,由四川省成都市达硕实验动物有限公司提供。将新生大鼠分为假手术组、模型组以及丁酸钠组,每组30只。
1.3 模型建立参照Wang等[15]的方法建立新生大鼠脑损伤模型:模型组及丁酸钠组腹腔注射LPS(0.05 mg/kg)2 h后行右侧颈总动脉结扎术:即乙醚麻醉后,将新生大鼠于手术台上固定,颈部正中偏右作长约5~6 mm切口,分离并用5-0丝线双重结扎右侧颈总动脉,缝合皮肤切口;术后恢复1 h,然后放入缺氧舱中给予含6.5%氧气90 min(氧流量2~3 L/min);而后置于常氧母鼠笼中饲养。假手术组腹腔注射等体积生理盐水,仅作颈部皮肤切口分离右侧颈总动脉并穿线而过,不予结扎、不予缺氧,其余同模型组。操作过程保持37℃恒温。
1.4 药物治疗及BrdU标记建立模型后,丁酸钠组立即腹腔注射丁酸钠(300 mg/kg),每天1次,连续7 d;假手术组及模型组注射同体积生理盐水。模型建立后第3天开始,各组均腹腔注射BrdU标记分裂细胞
(50 mg/kg),每天2次,连续5 d。
1.5 标本采集模型建立7 d后各组动物处死取材。各组20只动物于心脏内灌注20 mL生理盐水,再灌注4%多聚甲醛20 mL内固定,开颅将脑完整取出,平均分为两部分,分别用于苏木素-伊红染色和免疫荧光;各组10只动物开颅取脑,在冰袋上分离右侧大脑皮层组织,置于液氮中备用于Western blot 检测。
1.6 苏木精-伊红染色取完整脑组织用4%多聚甲醛外固定72 h后,石蜡包埋,从侧脑室水平(根据大鼠大脑立体定位图谱,相当于距离前囟向后1.2 mm到3.0 mm处)沿冠状面切片,厚度为5 μm,常规脱蜡水化后,苏木素染色5 min,盐酸酒精分化,自来水冲洗,伊红染色2 min。脱水、透明、封片。
1.7 Western blot检测HH3、AH3、Bcl-2、Bax、CC3及BDNF蛋白表达取冻存大脑皮层组织放入蛋白酶抑制剂的细胞裂解液中,匀浆,冰上静置30 min后于4℃、
14 000 r/min离心30 min,收集上清总蛋白。BCA 蛋白定量检测试剂盒测定蛋白浓度,调整蛋白浓度至同一浓度,以60 μg/孔上样,在12%十二烷基硫酸钠-聚丙烯酰胺凝胶中恒压110 V电泳1 h,以300 mA转膜45 min将蛋白转印至PVDF膜上,5%脱脂牛奶室温下封闭1 h后加入一抗,置于摇床室温孵育1 h后4℃过夜。β-actin作为内参。TBST洗膜3次,每次5 min,加入辣根过氧化物酶标记的二抗,室温孵育1 h,洗膜3次,每次5 min。在膜上加ECL发光剂,将膜放入凝胶成像仪成像。采用Quantity One 4.6.2(美国)软件定量分析其IOD值。目的蛋白条带和内参β-actin条带的IOD比值表示目的蛋白相对表达量。
1.8 免疫荧光法检测皮层细胞增殖取完整脑组织用4%多聚甲醛外固定72 h后,琼脂糖包埋,将组织块于震荡切片机上从侧脑室水平沿冠状面切片,厚度为40 μm,挑片,置于24孔板中,PBS洗5 min×3,为检测新生的BrdU+细胞,将切片于2 mol/L HCl中37℃孵育
30 min至DNA变性,用0.1 mol/L硼酸(pH=8.5)洗10 min,用含0.3%Triton X-100的PBS溶液穿膜30 min后封闭1 h,滴加一抗,在4℃冰箱孵育过夜;滴加荧光素标记的二抗,避光室温孵育2 h;PBS洗5 min×3,加入DAPI孵育5 min,PBS洗5 min×2,滴加抗荧光淬灭剂,封片,在激光共聚焦显微镜下观察结果。采用Image Pro Plus 4.5图像分析软件(Media Cybernetics 公司,美国)分析统计细胞数。每个脑组织样本随机取3张切片,每张切片将胼胝体以上全部右侧皮层沿冠状面由上到下均分为3个水平区域,每个区域随机选择3个视野,共9个视野观察并计数,每组共8个独立样本。
1.9 统计学分析采用SPSS 21.0统计软件对数据进行统计学处理,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果 2.1 各组新生大鼠脑室周围白质及大脑皮层细胞病理改变苏木精-伊红染色可见模型组脑室周围白质组织疏松,细胞不同程度肿胀,排列紊乱,间隙增宽;丁酸钠组上述病理改变均明显减轻。模型组大脑皮层细胞呈不同程度肿胀,排列紊乱,细胞核固缩;丁酸钠组大脑皮层细胞肿胀程度较模型组明显减轻,核固缩等细胞变性明显减少。假手术组细胞形态正常,排列整齐。见图 1。

|
图 1 模型建立后7 d各组新生大鼠脑室周围白质及大脑皮层细胞病理改变(苏木精-伊红染色,×400) 假手术组细胞形态正常,排列整齐。模型组可见脑室周围白质组织疏松,细胞不同程度肿胀,排列紊乱,间隙增宽;丁酸钠组上述病理改变均明显减轻。模型组大脑皮层细胞呈不同程度肿胀,排列紊乱,细胞核固缩;丁酸钠组大脑皮层细胞肿胀程度较模型组明显减轻,核固缩等细胞变性明显减少。 |
2.2 HDAC抑制剂丁酸钠对新生大鼠大脑皮层组织HH3及AH3的影响
Western blot结果显示,各组HH3水平比较差异无统计学意义(F=0.944,P=0.416)。各组AH3水平比较差异有统计学意义(F=9.73,P=0.003),其中模型组AH3水平低于假手术组和丁酸钠组(P<0.05),假手术组和丁酸钠组比较差异无统计学意义(P>0.05)。各组HH3/AH3比值比较差异有统计学意义(F=38.025,P<0.001),其中模型组HH3/AH3比值高于假手术组和丁酸钠组(P<0.05),假手术组HH3/AH3比值高于丁酸钠组(P<0.05)。见图 2。
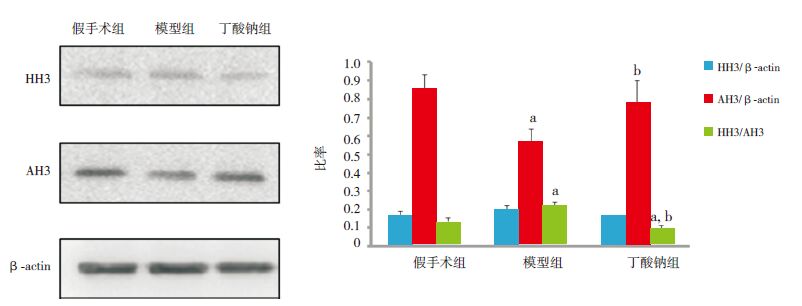
|
图 2 模型建立7 d后Western blot检测各组新生大鼠大脑皮层组织HH3及AH3蛋白表达水平 左图为蛋白电泳条带图;右图为统计图(n=5),a示与假手术组比较,P<0.05; b示与模型组比较,P<0.05。[HH3] 组蛋白H3;[AH3] 乙酰化组蛋白H3。 |
2.3 组蛋白乙酰化调控对新生大鼠大脑皮层组织细胞凋亡相关蛋白的影响
Western blot结果显示,各组Bax水平比较差异有统计学意义(F=9.39,P=0.004),其中模型组Bax水平高于假手术组和丁酸钠组(P<0.05),假手术组和丁酸钠组比较差异无统计学意义(P>0.05)。各组Bcl-2水平比较差异有统计学意义(F=5.86,P=0.019),其中模型组Bcl-2水平低于假手术组和丁酸钠组(P<0.05),假手术组和丁酸钠组比较差异无统计学意义(P>0.05)。各组Bcl-2/Bax比值比较差异有统计学意义(F=21.53,P<0.001),其中模型组Bcl-2/Bax比值低于假手术组和丁酸钠组(P<0.05),假手术组和丁酸钠组比较差异无统计学意义(P>0.05)。各组CC3水平比较差异有统计学意义(F=6.726,P=0.035),其中模型组CC3水平高于假手术组和丁酸钠组(P<0.05),假手术组和丁酸钠组比较差异无统计学意义(P>0.05)。见图 3。

|
图 3 模型建立7 d后Western blot检测各组新生大鼠大脑皮层Bax、Bcl-2及CC3蛋白表达水平 左图为蛋白电泳条带图;右图为统计图(n=5),a示与假手术组比较,P<0.05;b示与模型组比较,P<0.05。[Bcl-2] B细胞淋巴瘤-2;[Bax] Bcl-2相关X蛋白;[CC3] 活化型半胱天冬酶3。 |
2.4 组蛋白乙酰化调控对新生大鼠脑皮层组织细胞增殖的影响
免疫荧光结果显示,与神经元标志蛋白NeuN(绿色荧光)共染,可见BrdU阳性细胞(红色荧光)主要是新生神经元(图 4)。统计结果显示,各组BrdU阳性细胞数比较差异有统计学意义(F=165.4,P<0.001),其中丁酸钠组BrdU阳性细胞数较假手术组和模型组增加,差异具有统计学意义(P<0.05),假手术组和模型组比较差异无统计学意义(图 5)。
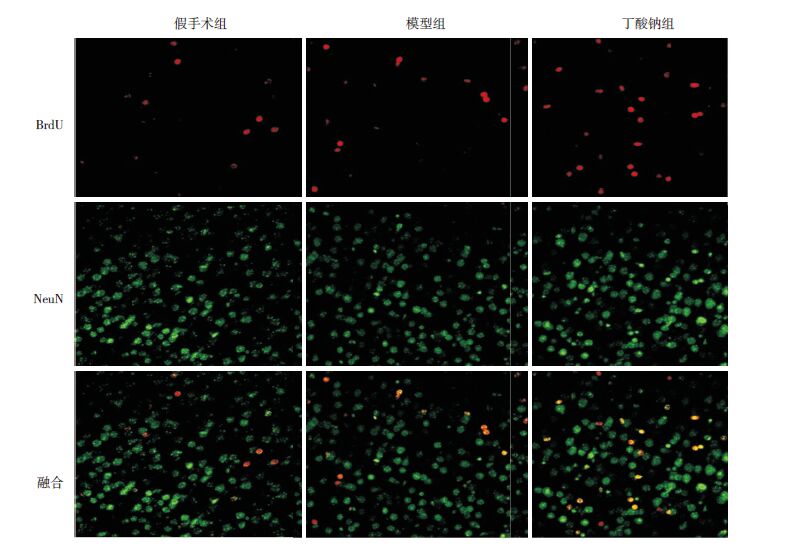
|
图 4 模型建立7 d后免疫荧光检测各组新生大鼠大脑皮层细胞增殖水平(×400) BrdU+细胞(红色)与NeuN+细胞(绿色)几乎完全重合(黄色),提示增殖细胞为新生神经元。 |
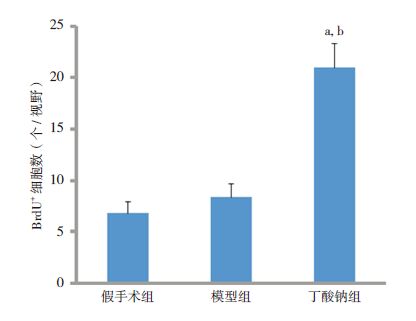
|
图 5 各组新生大鼠大脑皮层BrdU+细胞数比较(n=8) a示与假手术组比较,P<0.05;b示与模型术组比较,P<0.05。 |
2.5 组蛋白乙酰化调控对新生大鼠大脑皮层BDNF蛋白表达的影响
Western blot结果显示,各组新生大鼠大脑皮层BDNF蛋白水平比较差异有统计学意义(F=4.162,P=0.031),其中假手术组和丁酸钠组BDNF蛋白表达水平均高于模型组(P<0.05),假手术组和丁酸钠组间比较BDNF水平差异无统计学意义(P>0.05)。见图 6。
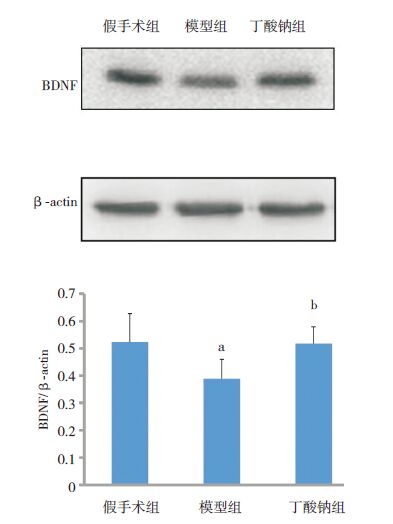
|
图 6 Western blot检测各组新生大鼠大脑皮层BDNF蛋白表达水平 上图为蛋白电泳条带图;下图为统计图(n=5),a示与假手术组比较,P<0.05;b示与模型组比较,P<0.05。[BDNF] 脑源性神经营养因子。 |
3 讨论
近年来,越来越多的研究发现组蛋白乙酰化/去乙酰化修饰参与了神经系统发育过程,其程度的改变可影响神经元前体细胞的增殖和分化。国内外许多学者通过建立成年大鼠大脑中动脉栓塞模型,将HDAC抑制剂应用于大鼠脑缺血模型的治疗,发现增加组蛋白乙酰化水平具有抗氧化应激损伤、抗内质网应激损伤、抗兴奋性中毒损伤、抗坏死性凋亡、抗炎症损伤、促神经元再生、以及促新生血管生成等保护作用,从而减少大脑梗死面积并提高远期灰质相关神经功能[16]。然而,成年脑缺血模型主要涉及弥漫性神经元损伤,这与早产儿脑损伤以脑室周围白质软化为主、同时伴神经元及其轴突损伤不尽相同。而组蛋白乙酰化调控在早产儿脑损伤中作用的研究,目前甚少。
在Wang等[15]的研究中,通过统计皮层尼氏染色阳性细胞并未发现HI组皮层细胞明显缺失,因而认为该模型不会导致皮层损伤。然而单纯通过统计皮层细胞数量并不能说明细胞有无病理改变甚至其相关的分子生物学改变。本研究通过HE染色与Western blot检测从细胞形态及分子层面证实了该模型所致的皮层损伤。利用此模型,我们进一步发现,组蛋白乙酰化水平增加对皮层损伤的治疗效应主要是通过减少细胞凋亡并增加细胞增殖实现的。半胱氨酸蛋白水解酶(Caspases)在介导细胞凋亡过程中发挥至关重要的作用。Caspase3是凋亡过程中主要的效应Caspase,是多种凋亡途径的共同下游部分,是凋亡过程的最后执行者[17]。因此,CC3水平可提示细胞凋亡程度。同时,Bcl-2蛋白家族作为CC3其中一条上游信号分子,通过线粒体途径介导细胞色素C(CytC)等物质的释放激活Caspase3,从而诱导凋亡的发生。促凋亡因子Bax形成同源二聚体时诱导细胞凋亡,而凋亡抑制因子Bcl-2增加,形成Bcl-2-Bax异二聚体时凋亡效应被中和[18-19]。 因此,细胞的存活取决于Bcl-2/Bax比值。本研究发现丁酸钠可降低模型组大鼠皮层增高的CC3水平、提高Bcl-2/Bax比值,提示组蛋白乙酰化调控减少皮层细胞凋亡的治疗效应。与此同时,本研究还发现丁酸钠组比模型组皮层细胞增殖显著增加,通过与神经元标志蛋白NeuN共染,发现新增殖细胞与NeuN几乎完全重叠,提示组蛋白乙酰化调控可以增加新生神经元的数目。此效应是否与其促进神经干细胞增殖分化相关还需进一步研究。
本研究发现,丁酸钠组较模型组BDNF蛋白在大脑皮层中表达显著增加,表明组蛋白乙酰化调控可提高BDNF基因表达。BDNF作为脑中含量最丰富的神经营养因子,主要分布在皮层、海马、基底节等灰质区域。多项早期研究发现,BDNF可促进神经元再生,并维持其存活、减少坏死性凋亡[20-21]。Kim等[22]研究发现在成年大鼠大脑中动脉栓塞模型中,HDAC抑制剂可通过增加脑室周围BDNF表达,从而发挥促进神经元增殖并减少凋亡的作用。这与本实验研究结果一致。然而,在早期中枢神经损伤修复的研究中,发现BDNF发挥神经保护作用涉及多条信号传导通路,包括TrkB受体的激活、MAPK级联、PI3K级联以及对其下游的基本螺旋-环-螺旋转录因子的调节[23]。因此,在本研究中,组蛋白乙酰化调控增加BDNF表达后,如何激活其下游信号分子并最终发挥减少细胞凋亡及增加细胞增殖效应,还有待进一步研究。
综上,本研究发现组蛋白乙酰化水平增加可通过减少细胞凋亡及促进神经元再生保护新生大鼠脑皮层损伤,其机制可能与BDNF表达增加相关。这为临床早产儿脑损伤尤其是皮层损伤的干预提供了新的实验依据。
| [1] | Volpe JJ. Brain injury in the premature infant:overview of clinical aspects, neuropathology, and pathogenesis[J]. Semin Pediatr Neurol, 1998, 5 (3): 135–151. DOI:10.1016/S1071-9091(98)80030-2 |
| [2] | Eaton-Rosen Z, Melbourne A, Orasanu E, et al. Longitudinal measurement of the developing grey matter in preterm subjects using multi-modal MRI[J]. Neuroimage, 2015, 111 : 580–589. DOI:10.1016/j.neuroimage.2015.02.010 |
| [3] | Zhang H, Shang YP, Chen HY, et al. Histone deacetylases function as novel potential therapeutic target for cancer[J]. Hepatol Res, 2016 . |
| [4] | Wang ZF, Fessler EB, Chuang DM. Beneficial effects of mood stabilizers lithium, valproate and lamotrigine in experimental stroke models[J]. Acta Pharmacol Sin, 2011, 32 (12): 1433–1445. DOI:10.1038/aps.2011.140 |
| [5] | Shein NA, Shohami E. Histone deacetylase inhibitors as therapeutic agents for acute central nervous system injuries[J]. Mol Med, 2011, 17 (5-6): 448–456. |
| [6] | Chuang DM, Leng Y, Marinova Z, et al. Multiple roles of HDAC inhibition in neurodegenerative conditions[J]. Trends Neurosci, 2009, 32 (11): 591–601. DOI:10.1016/j.tins.2009.06.002 |
| [7] | Langley B, Brochier C, Rivieccio MA. Targeting histone deacetylases as a multifaceted approach to treat the diverse outcomes of stroke[J]. Stroke, 2009, 40 (8): 2899–2905. DOI:10.1161/STROKEAHA.108.540229 |
| [8] | Ziemka-Nalecz M, Zalewska T. Neuroprotective effects of histone deacetylase inhibitors in brain ischemia[J]. Acta Neurobiol Exp (Wars), 2014, 74 (4): 383–395. |
| [9] | Volpe JJ, Kinney HC, Jensen FE, et al. The developing oligodendrocyte:key cellular target in brain injury in the premature infant[J]. Int J Dev Neurosci, 2011, 29 (4): 423–440. DOI:10.1016/j.ijdevneu.2011.02.012 |
| [10] | Vincer MJ, Allen AC, Allen VM, et al. Trends in the prevalence of cerebral palsy among very preterm infants (< 31 weeks' gestational age)[J]. Paediatr Child Health, 2014, 19 (4): 185–189. |
| [11] | Chenouard A, Gascoin G, Gras-Le Guen C, et al. Neurodevelop-mental impairment in preterm infants with late-onset infection:not only in extremely preterm infants[J]. Eur J Pediatr, 2014, 173 (8): 1017–1023. DOI:10.1007/s00431-014-2284-8 |
| [12] | Yang D, Sun YY, Lin X, et al. Taming neonatal hypoxic-ischemic brain injury by intranasal delivery of plasminogen activator inhibitor-1[J]. Stroke, 2013, 44 (9): 2623–2627. DOI:10.1161/STROKEAHA.113.001233 |
| [13] | Wang X, Svedin P, Nie C, et al. N-acetylcysteine reduces lipopolysaccharide-sensitized hypoxic-ischemic brain injury[J]. Ann Neurol, 2007, 61 (3): 263–271. DOI:10.1002/ana.v61:3 |
| [14] | Dean JM, Moravec MD, Grafe M, et al. Strain-specific differences in perinatal rodent oligodendrocyte lineage progression and its correlation with human[J]. Dev Neurosci, 2011, 33 (3-4): 251–260. DOI:10.1159/000327242 |
| [15] | Wang LW, Chang YC, Lin CY, et al. Low-dose lipopolysac-charide selectively sensitizes hypoxic ischemia-induced white matter injury in the immature brain[J]. Pediatr Res, 2010, 68 (1): 41–47. DOI:10.1203/PDR.0b013e3181df5f6b |
| [16] | Fessler EB, Chibane FL, Wang Z, et al. Potential roles of HDAC inhibitors in mitigating ischemia-induced brain damage and facilitating endogenous regeneration and recovery[J]. Curr Pharm Des, 2013, 19 (28): 5105–5120. DOI:10.2174/1381612811319280009 |
| [17] | Yang PM, Tseng HH, Peng CW, et al. Dietary flavonoid fisetin targets caspase-3-deficient human breast cancer MCF-7 cells by induction of caspase-7-associated apoptosis and inhibition of autophagy[J]. Int J Oncol, 2012, 40 (2): 469–478. |
| [18] | 王雪维, 李燕. Bcl-2、Bax在青光眼神经节细胞凋亡中的研究进展[J]. 医学综述, 2015, 21 (22): 4077–4079. |
| [19] | Siddiqui WA, Ahad A, Ahsan H. The mystery of BCL2 family:Bcl-2 proteins and apoptosis:an update[J]. Arch Toxicol, 2015, 89 (3): 289–317. DOI:10.1007/s00204-014-1448-7 |
| [20] | Kim G, Kim E. The effects of antecedent exercise on motor function recovery and brain-derived neurotrophic factor expression after focal cerebral ischemia in rats[J]. J Phys Ther Sci, 2013, 25 (5): 553–556. DOI:10.1589/jpts.25.5_553 |
| [21] | Wang NQ, Wang LY, Zhao HP, et al. Luoyutong treatment promotes functional recovery and neuronal plasticity after cerebral ischemia-reperfusion injury in rats[J]. Evid Based Complement Alternat Med, 2015, 2015 : 369021. |
| [22] | Kim HJ, Leeds P, Chuang DM. The HDAC inhibitor, sodium butyrate, stimulates neurogenesis in the ischemic brain[J]. J Neurochem, 2009, 110 (4): 1226–1240. DOI:10.1111/j.1471-4159.2009.06212.x |
| [23] | Heiser JH, Schuwald AM, Sillani G, et al. TRPC6 channel-mediated neurite outgrowth in PC12 cells and hippocampal neurons involves activation of RAS/MEK/ERK, PI3K, and CAMKIV signaling[J]. J Neurochem, 2013, 127 (3): 303–313. DOI:10.1111/jnc.2013.127.issue-3 |
 2017, Vol. 19
2017, Vol. 19


