2. 新疆伊犁州奎屯医院儿科, 新疆 奎屯 833200
新生儿缺氧性肺动脉高压(hypoxia induced pulmonary hypertension,HPH)是新生儿常见的急危重症,早期肺血管痉挛,及时治疗可逆,晚期肺血管重塑,发展为新生儿持续肺动脉高压[1](persistent pulmonary hypertension of the newborn,PPHN),病死率高。研究发现缺氧导致肺血管舒缩因子失衡,尤其是缩血管因子内皮素-1(endothelin-1,ET-1)和舒血管因子诱导型一氧化氮合酶(inducible nitric oxidesynthase,iNOS)的表达在新生儿HPH发病中占重要地位[2-3],本课题组前期研究表明缺氧诱导因子-1α(hypoxia inducible factor-1 alpha,HIF-1α)[4-5]是这两个因子的关键上游转录调节因子。目前有关HPH的临床治疗,重点是针对原发病及对各系统并发症的对症治疗为主,但临床治疗观察效果欠佳,如果能够阻断上游转录基因HIF-1α的表达,抑制下游靶基因ET-1、iNOS活性,从而保护缺氧引起的肺损伤,防止HPH的发生发展,可能会成为治疗新生儿HPH的新靶点。而热休克蛋白70(heat shock protein,HSP70)能够在长期缺氧状态下促进HIF-1α的降解[6],故本研究通过腺病毒介导HSP70转染提高肺组织HSP70表达,探讨HSP70能否在HPH新生大鼠肺组织发挥保护作用。
1 材料与方法 1.1 实验动物及仪器试剂7~10日龄健康、清洁级Wistar新生大鼠128只,体重27±3 g,由新疆医科大学第一附属医院医学研究中心动物实验研究部提供,实验动物许可证号:SCXK(新2011-0004)。CY-100B氧浓度测定仪由杭州利华科技有限公司提供;HX-200小动物呼吸机由成都泰盟科技有限公司提供;BX41TF光学显微镜由日本奥林巴斯公司提供;283BR11735电泳仪、电转仪由美国BIO-RAD公司提供。MST-8001VG染色试剂盒由福州迈新生物技术开发有限公司提供;WB7105 Western blot二抗试剂盒由美国Invitrogen公司提供;HSP-70单克隆抗体,HIF-1α、ET-1、iNOS多克隆抗体由美国Thermo公司提供;Ad-HSP70及Ad-GFP由上海汉恒生物公司提供。
1.2 分组及HPH模型建立128只新生大鼠随机分为空白对照组、HPH模型组、空病毒对照组和HSP70组,各组再分为缺氧3、7、10和14 d 4个亚组,每个亚组8只新生大鼠。空白对照组和HPH模型组大鼠通过尾静脉注射5 μL无菌生理盐水,空病毒对照组大鼠通过尾静脉注射5 μL Ad-GFP(1 010 PFU/mL),HSP70组大鼠通过尾静脉注射5 μL Ad-HSP70
(1 010 PFU/mL)。除空白对照组外,将上述其他3组新生大鼠与母鼠一起置于常压低氧舱内建立HPH模型[7],将8%氮氧混合气体输入低氧舱内,用氧浓度监测仪持续8 h监测氧浓度,使其维持在8%~10%,昼/夜比为12 h/12 h。空白对照组除未缺氧外,其他处理同HPH模型组。
1.3 平均肺动脉压力测定在缺氧第3、7、10、14天测定各组新生大鼠平均肺动脉压(mPAP),常规用氯胺酮
(75 mg/kg)、阿托品(0.375 mg/kg)和地西泮
(7.5 mg/kg)混合液腹腔内注射麻醉后,将新生大鼠仰卧位固定,备皮,常规消毒手术区皮肤,在胸骨柄上方约5 mm处,沿气管正前方作一约2 mm的纵行切口,充分暴露气管,行气管插管,连接小动物呼吸机(设置参数:呼吸频率120次/min、潮气量4 mL/min),保证胸廓对称起伏、与呼吸机同步,监测新生大鼠尾部血氧饱和度,使其维持在85%~95%,从胸骨右缘行U型切口打开胸腔,充分暴露肺动脉根部,用4.5号静脉穿刺针逆血流方向刺入肺动脉根部,迅速连接压力传感器,在多导生理记录仪上记录mPAP。
1.4 腺病毒定位在HPH新生大鼠肺组织的判定新生大鼠测定肺动脉压力后即处死取其右中肺组织,将其投入生理盐水中洗净血液,在4%多聚甲醛液中固定2 h,再用0.1 mmol/L的PBS液清洗3次,每次5 min,然后将标本置于15%的蔗糖中过夜,最后置于固定液中放入-20℃冰箱备用。将预先备好的标本做冰冻切片,避光,于20 min内置于免疫荧光显微镜下观察,腺病毒载体携带有增强型绿色荧光信号标记蛋白(enhanced green fluorescent protein,EGFP),在荧光显微镜下会发出绿色荧光信号,同时采集图片。
1.5 观察肺血管组织结构及重塑指标新生大鼠测定肺动脉压力后,立即处死,迅速切取右上肺组织,用4%多聚甲醛固定1周。常规石蜡包埋、切片,厚度4 μm,用1 : 1蛋白甘油贴片液贴片,放入45℃烤片盒内烘干。每只新生大鼠随机选取肺组织切片3张,进行Van Gieson(VG)染色,选取染色中与呼吸性细支气管及肺泡管相伴行的、横断面积较圆、直径约5~10 µm的肺小动脉,在光学显微镜下,每张切片随机选取5个视野,观察肺小动脉变化。用病理图像分析软件测定肺小动脉中层壁厚(MT)、肺小动脉外径(ED)、肺小动脉中层横截面积(MA)和总横截面积(TAA),根据公式MT%= MT/ED、MA%= MA/TAA计算,将MT%、MA%作为肺血管重塑指标。
1.6 Western blot测定HSP70、HIF-1α、ET-1、iNOS蛋白质表达按观察时间点测定肺动脉压后处死各组新生大鼠,快速切取右侧肺组织100 mg左右,液氮中低温冷冻,再保存于-80℃冰箱中备用。按蛋白提取试剂盒提取肺组织总蛋白,以LaminA/C作为细胞核蛋白内参,β-actin作为细胞浆蛋白内参。采用二奎林甲酸(bicinchoninic acid,BCA)法进行蛋白质浓度测定、定量及变性,SDS-聚丙烯酰胺凝胶30 mA恒流电泳,100 V恒压PVDF膜进行湿式电转1~2 h,室温封闭1 h,将待测蛋白质按HSP70:1:1 000,β-actin:1 : 400,LaminA/C:1 : 1 000,HIF-1α:1 : 500,iNOS:1 : 200,ET-1:1 : 500稀释比例加入一抗孵育液中,4℃环境下放置在摇床上过夜,二抗室温孵育1 h,碱性磷酸酶法显色。凝胶成像分析仪进行图像采集,通过Quantity One分析软件对目的条带灰度值进行数据分析,结果以目的条带/内参条带灰度值比值来表示。
1.7 统计学分析采用SPSS 20.0统计软件对数据进行统计学分析。符合正态分布的计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,组间两两比较采用SNK-q检验;不符合正态分布的计量资料采用中位数(四分位间距)[P50(P25,P75)]表示;多组间比较采用Kruskal-Wallis H检验,组间两两比较采用Nemenyi检验。P<0.05为差异有统计学意义。
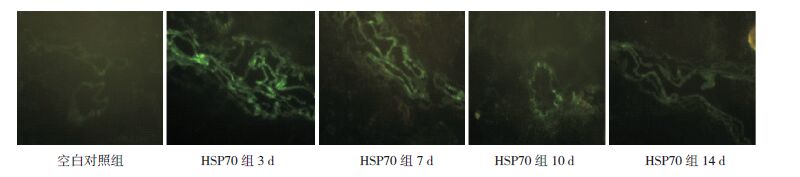
2 结果 2.1 HSP70基因转染液转染肺组织取HSP70组及空白对照组肺组织冰冻切片于免疫荧光显微镜下观察,发现缺氧3、7、
10 d HSP70组肺组织均可见免疫荧光;缺氧14 d HSP70组及空白对照组未见明显免疫荧光,表明腺病毒介导的HSP70成功定位到HPH新生大鼠肺组织,且随着缺氧时间延长在肺组织内逐渐衰减。见图 1。
|
图 1 免疫荧光观察腺病毒介导HSP70定位肺组织(GFP,×200) HSP70组肺组织在缺氧3 d时可见明显绿色免疫荧光,随着缺氧时间延长在肺组织内逐渐衰减,缺氧14 d时HSP70组及空白对照组均未见明显免疫荧光。 |
2.2 各组新生大鼠mPAP的变化
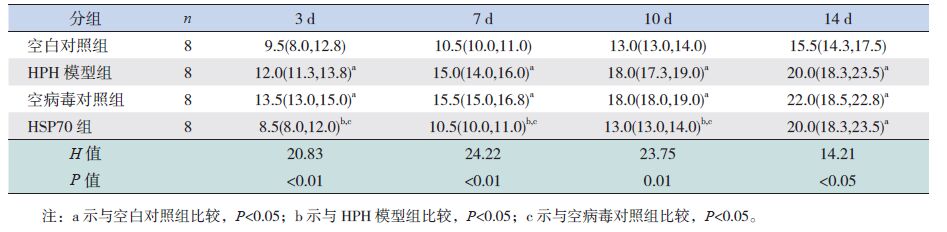
在缺氧3、7、10、14 d时,HPH模型组及空病毒对照组的mPAP水平与同日龄空白对照组比较显著增高(P<0.05);在缺氧3、7、10 d时,HSP70组的mPAP水平与同日龄空白对照组比较差异无统计学意义(P>0.05),与同日龄HPH模型组及空病毒对照组比较显著降低(P<0.05);缺氧14 d 时,HSP70组的mPAP水平与同日龄HPH模型组及空病毒对照组比较差异无统计学意义(P>0.05),但显著高于空白对照组(P<0.05)。见表 1。
| 表 1 各组新生大鼠mPAP比较 [P50(P25,P75),mm Hg] |
2.3 各组肺血管形态及重塑指标的改变
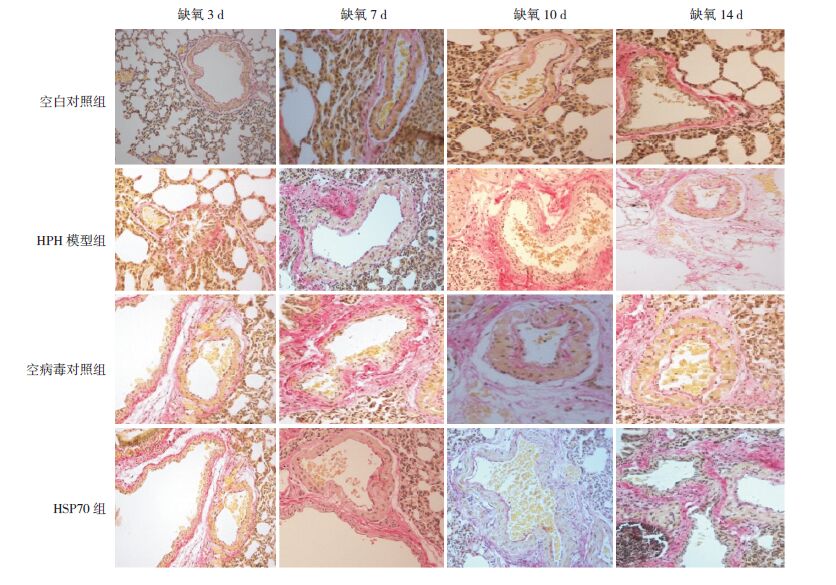
VG染色后观察空白对照组新生大鼠肺小动脉管腔大,管壁薄,血管壁结构层次清晰;HPH模型组、空病毒对照组新生大鼠缺氧3 d时动脉管壁均明显增厚,缺氧7 d时呼吸性细支气管水平肺小动脉平滑肌层增厚,管壁增厚,官腔缩小,缺氧10 d及14 d时肺小动脉中层平滑肌增生,管壁增厚,官腔更加狭小;HSP70组在缺氧3、7、10 d时肺小动脉中层平滑肌未见明显增生,管壁增厚不明显,官腔狭小不显著,缺氧14 d时肺小动脉中层平滑肌增生,管壁增厚,官腔狭小。见图 2。
|
图 2 各组新生大鼠肺血管形态学改变(VG染色,×200) 空白对照组新生大鼠肺小动脉管腔大,管壁薄。HPH模型组和空病毒对照组随着缺氧时间延长,肺小动脉管腔逐渐缩小,管壁增厚。HSP70组在缺氧3、7、10 d时肺小动脉管壁增厚、管腔狭小不明显,缺氧14 d时肺小动脉管壁增厚,管腔狭小。 |
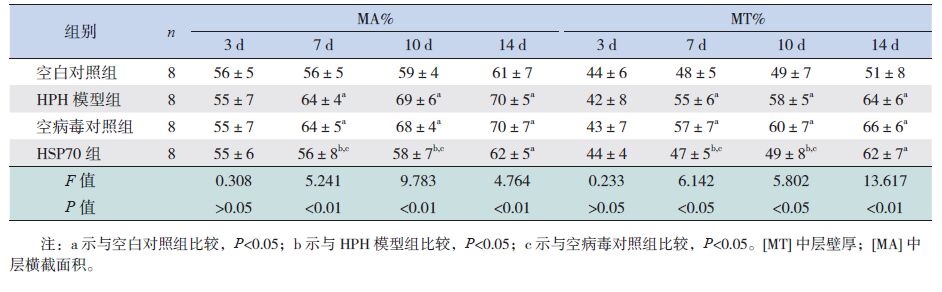
缺氧3 d时,各组MA%、MT%比较差异无统计学意义(P>0.05);缺氧7 d及10 d时,空白对照组及HSP70组MA%、MT%低于HPH模型组和空病毒对照组(P<0.01);缺氧14 d时,HPH模型组、空病毒对照组和HSP70组MA%、MT%比较差异无统计学意义(P>0.05),但高于空白对照组(P<0.01)。提示HSP70可以延缓肺血管重塑。见表 2。
| 表 2 各组新生大鼠MA%及MT%比较 ( x±s) |
2.4 各组肺组织中HSP70、HIF-1α、ET-1、iNOS蛋白表达变化
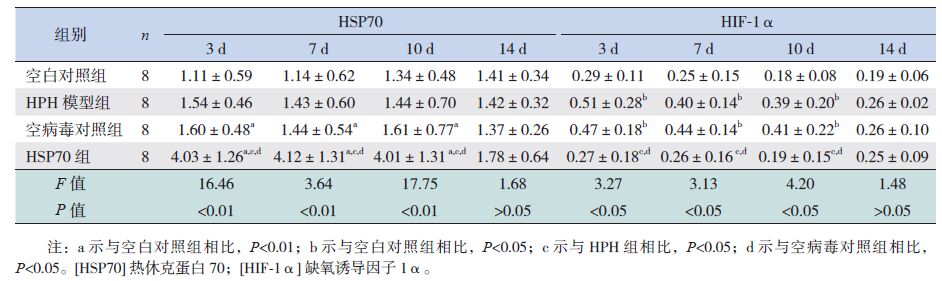
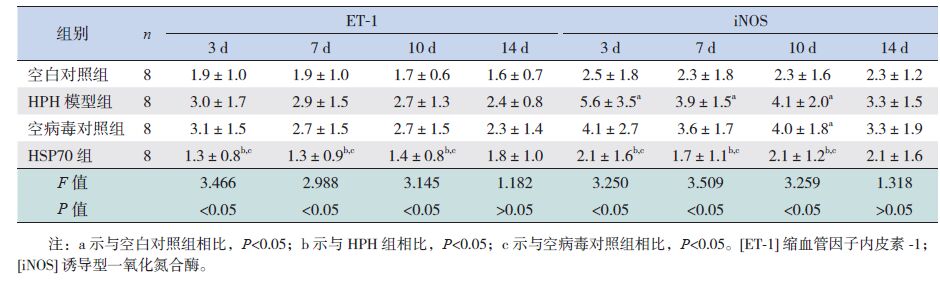
在缺氧3、7、10 d时,各组HSP70蛋白表达水平比较差异有统计学意义(P<0.05),其中HSP70组HSP70的蛋白表达水平高于HPH模型组、空病毒对照组和空白对照组(P<0.01)。在缺氧3、7、10 d时,各组HIF-1α蛋白表达水平比较差异有统计学意义(P<0.05),其中HPH模型组、空病毒对照组HIF-1α的蛋白表达水平高于空白对照组和HSP70组(P<0.05),而HSP70组和空白对照组间比较差异无统计学意义(P>0.05)。在缺氧3、7、10 d时,各组ET-1和iNOS的蛋白表达水平比较差异有统计学意义(P<0.05),其中HSP70组ET-1和iNOS的蛋白表达水平低于HPH模型组和空病毒对照组(P<0.05),而与空白对照组比较差异无统计学意义(P>0.05)。见表 3~4。
| 表 3 各组新生大鼠肺组织HSP70、HIF-1α蛋白表达水平比较 ( x±s) |
| 表 4 各组新生大鼠肺组织ET-1、iNOS 蛋白表达水平比较 ( x±s) |
3 讨论
晚期肺血管重塑[8] 是HPH患儿出现持续胎儿循环,救治困难,病死率高的主要因素,目前研究证实HIF-1α是一种氧依赖转录激活因子[9],通过促进下游靶基因表达,引起肺血管壁痉挛、重塑,导致肺动脉压力增高。如果在缺氧早期针对HIF-1α进行干预降低表达,可能是一个治疗新生儿HPH新的有效途径。已有研究证明采用基因工程技术诱导HSP70高效表达对心、脑、肺、肾脏、肝脏等器官的损伤有保护作用[10-13]。
本研究HSP70组在缺氧3、7、10 d时显示肺组织有绿色免疫荧光信号,证实腺病毒介导的HSP70成功靶向定位到新生大鼠肺组织中,而14 d时未见绿色免疫荧光信号蛋白显示。缺氧引起肺小动脉内皮损伤,导致血管舒缩因子平衡失调,肺血管痉挛、平滑肌增生、重塑,最终导致肺动脉高压发生。本研究结果显示HPH模型组及空病毒对照组肺动脉高压形成,缺氧7 d时肺血管重塑发生,缺氧14 d时肺血管重塑加剧,HSP70组缺氧3、7、10 d没有出现肺动脉高压,14 d时肺动脉压力又增高,显示较轻肺血管重塑,说明HSP70高效表达能够减轻或延缓肺血管重塑,降低肺动脉压力,而随着HSP70的表达减少,对减轻肺血管重塑的作用就减弱,说明HSP70高效表达能够发挥保护肺血管,减轻肺血管损伤的作用。
本研究显示HPH模型组HSP70表达在缺氧3、7、10 d时均有增加,一方面在缺氧应激情况下,机体内源性保护机制开始启动,引起内源性HSP70表达增多,另一方面HSP70组HSP70 蛋白表达水平高于HPH模型组、空病毒对照组,说明通过腺病毒介导HSP70可以诱导外源性HSP70在新生大鼠肺组织高效表达。病理学检测显示HPH模型组、空病毒对照组新生大鼠有肺血管损伤性改变,HSP70组新生大鼠肺血管损伤较轻,说明外源性HSP70高效表达后可以减轻HPH肺损伤,对HPH新生大鼠肺组织具有保护作用。本研究也显示内源性HSP70表达少,对HPH保护作用弱,不能减轻肺血管的损伤性改变,而应激刺激超过一定的强度,或持续时间过长,使维持细胞正常生长的蛋白质合成受阻,同时变性蛋白质产生过多超过了HSP70保护能力。
HPH模型组和空病毒对照组在缺氧3、7、10 d时,HIF-1α蛋白质表达均增高,但HSP70组表达降低,说明腺病毒介导的HSP70诱导的HSP70高效表达后,抑制HIF-1α的表达,14 d时HSP70在体内代谢表达减弱,对HIF-1α的抑制作用也减弱。说明在缺氧状况下HSP70对HIF-1α具有泛素化降解作用,与Gogate等 [14] 报导一致。缺氧时HIF-1α可以通过诱导其下游靶基因ET-1、iNOS的表达,来发挥其在缺血缺氧性疾病中的损害作用 [15]。Western blot检测结果显示HPH模型组和空病毒对照组在缺氧3、7、10 d时ET-1、iNOS蛋白表达均增高,缺氧促进其表达,而在HSP70组表达降低,进一步说明HSP70高效表达后,抑制HIF-1α的表达,同时也下调其下游靶基因ET-1、iNOS的表达。
缺氧刺激可以诱导HPH新生大鼠肺组织内源性的HSP70表达,但没有发挥对缺氧肺组织的保护作用,腺病毒介导的 HSP70 可以诱导HPH新生大鼠肺组织中 HSP70 高效表达,通过促进HIF-1α降解,下调其下游靶基因ET-1、iNOS表达发挥降低肺动脉压力,减轻或缓解肺血管重塑的作用,推测HSP70在HPH中可以发挥对肺损伤的保护作用。
| [1] | Storme L, Aubry E, Rakza T, et al. Pathophysiology of persistent pulmonary hypertension of the newborn:impact of the perinatal environment[J]. Arch Cardiovasc Dis, 2013, 106 (3): 169–177. DOI:10.1016/j.acvd.2012.12.005 |
| [2] | 王莉, 朱艳萍, 李明霞. HIF-1α、ET-1和iNOS在新生儿缺氧性肺动脉高压发病中的作用[J]. 中国当代儿科杂志, 2011, 13 (1): 8–11. |
| [3] | Ambalavanan N, Bulger A, Murphy-Ullrich J, et al. Endothelin-A receptor blockade prevents and partially reverses neonatal hypoxic pulmonary vascular remodeling[J]. Pediatr Res, 2005, 57 (5 Pt 1): 631–636. |
| [4] | Wang L, Zhou Y, Li M, et al. Expression of hypoxia-inducible factor-1α, endothelin-1 and adrenomedullin in newborn rats with hypoxia-induced pulmonary hypertension[J]. Exp Ther Med, 2014, 8 (1): 335–339. |
| [5] | 桑葵, 周英, 李明霞. 缺氧诱导因子-1α及其调控因子在新生大鼠缺氧性肺动脉高压发病机制中的作用研究[J]. 中华儿科杂志, 2012, 50 (12): 919–924. |
| [6] | Luo W, Zhong J, Chang R, et al. Hsp70 and CHIP selectively mediate ubiquitination and degradation of hypoxia-inducible factor (HIF)-1alpha but not HIF-2alpha[J]. J Biol Chem, 2010, 285 (6): 3651–3663. DOI:10.1074/jbc.M109.068577 |
| [7] | 桑葵, 周英, 李明霞. 缺氧性肺动脉高压新生大鼠肺血管重塑的研究[J]. 中国当代儿科杂志, 2012, 14 (3): 210–214. |
| [8] | Abud EM, Maylor J, Undem C, et al. Digoxin inhibits development of hypoxic pulmonary hypertension in mice[J]. Proc Natl Acad Sci U S A, 2012, 109 (4): 1239–1244. DOI:10.1073/pnas.1120385109 |
| [9] | Wang Y, Huang Y, Guan F, et al. Hypoxia-inducible factor-1alpha and MAPK co-regulate activation of hepatic stellate cells upon hypoxia stimulation[J]. PLoS One, 2013, 8 (9): e74051. DOI:10.1371/journal.pone.0074051 |
| [10] | Kim N, Kim JY, Yenari MA. Anti-inflammatory properties and pharmacological induction of Hsp70 after brain injury[J]. Inflammopharmacology, 2012, 20 (3): 177–185. DOI:10.1007/s10787-011-0115-3 |
| [11] | Ouyang YB, Xu LJ, Emery JF, et al. Overexpressing GRP78 influences Ca2+ handling and function of mitochondria in astrocytes after ischemia-like stress[J]. Mitochondrion, 2011, 11 (2): 279–286. DOI:10.1016/j.mito.2010.10.007 |
| [12] | Guo JR, Li SZ, Fang HG, et al. Different duration of cold stress enhances pro-inflammatory cytokines profile and alterations of Th1 and Th2 type cytokines secretion in serum of wistar rats[J]. J Anim Vet Adv, 2012, 11 (10): 1538–1545. DOI:10.3923/javaa.2012.1538.1545 |
| [13] | Sharp FR, Zhan X, Liu DZ. Heat shock proteins in the brain:role of Hsp70, Hsp27, and HO-1(Hsp32) and their therapeutic potential[J]. Transl Stroke Res, 2013, 4 (6): 685–692. DOI:10.1007/s12975-013-0271-4 |
| [14] | Gogate SS, Fujita N, Skubutyte R, et al. Tonicity enhancer binding protein (TonEBP) and hypoxia-inducible factor (HIF) coordinate heat shock protein 70(Hsp70) expression in hypoxic nucleus pulposus cells:role of Hsp70 in HIF-1α degradation[J]. J Bone Miner Res, 2012, 27 (5): 1106–1117. DOI:10.1002/jbmr.1571 |
| [15] | Ergorul C, Ray A, Huang W, et al. Hypoxia inducible factor-1α (HIF-1α) and some HIF-1 target genes are elevated in experimental glaucoma[J]. J Mol Neurosci, 2010, 42 (2): 183–191. DOI:10.1007/s12031-010-9343-z |
 2017, Vol. 19
2017, Vol. 19