近年来儿童哮喘的发病率逐年升高,严重影响其健康和生长发育。肺组织高迁移率族蛋白B1(high mobility group box 1,HMGB1)是一种高度保守的核蛋白,可作为一种免疫调节因子和炎性因子参与气道炎症;Toll样受体4(toll like receptors 4,TLR4)是一种重要的免疫识别受体,连接天然免疫和获得性免疫,在启动和调节气道炎症过程中发挥重要作用。HMGB1可与TLR4结合并相互作用,通过激活核因子κB(nuclear factor-kappa B,NF-κB),引起下游的炎症介质释放。维生素D既参与钙磷代谢调节,还具有免疫调节作用,主要通过影响单核细胞、树突状细胞(dendritic cell,DC)、淋巴细胞等免疫细胞发挥广谱的抗炎作用,并通过影响多种细胞的生长和分化参与气道结构的调节。
目前对哮喘中HMGB1/TLR4/NF-κB信号通路的研究较少,维生素D对该信号通路的研究,国内外尚未见报道。本课题组前期研究[1-2]初步探索了HMGB1/TLR4在哮喘小鼠肺组织中的表达及不同剂量维生素D的干预效果,摸索出了有效干预剂量,本研究在此基础上通过建立哮喘动物模型,进一步探讨HMGB1/TLR4/NF-κB信号通路及维生素D的调控机制,为哮喘的基础和临床研究提供实验依据。
1 材料与方法 1.1 动物及主要试剂6~7周龄清洁级BALB/c雌性小鼠48只,体重21.0±2.5 g,购于河南省实验动物中心,许可证号:SCXK(豫)2010-0002。鸡卵清蛋白(ovalbumin,OVA)和1,25-(OH)2D3购于Sigma公司;免疫组化一抗购于美国Gene Tex公司;二抗及显色剂购于北京博奥森生物技术有限公司。TRIzol 购于日本TAKARA公司;逆转录试剂盒BestarTM qPCR RT Kit和PCR试剂盒Bestar® SybrGreen qPCR master Mix均购于德国DBI公司;BCA蛋白浓度测定试剂盒购自美国Thermo Scientific公司。引物序列来源(Gene bank)分别为HMGB1(NM_001313894.1),TLR4(NM_021297.3),NF-κB(NM_009045.4)和β-actin(NM_007393.5),由上海生工生物工程有限公司合成。
1.2 动物分组和哮喘小鼠模型的制备按照随机数字表法原则将48只BALB/c小鼠随机分为对照组、哮喘组和1,25-(OH)2D3干预组(4 μg/kg),每组16只。动物模型制作参照参考文献[3-4]:哮喘组和干预组小鼠在第1、8、15天腹腔内注射抗原混合液0.2 mL(含OVA 50 μg、10%氢氧化铝0.15 mL和生理盐水0.05 mL)致敏,对照组用生理盐水代替。第22天开始,对哮喘组和干预组每只小鼠进行雾化吸入1% OVA激发,每日1次,每次30 min,雾化激发1周持续至第28天,共计7次;雾化激发2周持续至第35天,共计14次;对照组生理盐水雾化吸入。每次雾化激发前0.5 h,给予干预组每只小鼠腹腔内注射1,25-(OH)2D3混合液0.08 mL[含1,25-(OH)2D30.08μg、无水乙醇2.0 μL、生理盐水0.08 mL]。
1.3 肺组织标本制备分别在第29天(雾化激发1周)和第36天(雾化激发2周)两个时间点进行观察并留取标本(雾化激发结束24 h内取样)。迅速分离肺组织,取新鲜左肺,放置于-80℃冰箱冷冻,进行Real-Time PCR和Western blot检测。取右肺中叶,石蜡包埋固定,切片,进行苏木精-伊红染色及免疫组织化学染色。每组每个时间点采样标本为8只。
1.4 苏木精-伊红染色及免疫组化染色将小鼠肺组织制成4 µm厚的切片,每只小鼠随机选取3张石蜡切片,行苏木精-伊红染色,观察支气管壁的形态学改变,每张切片随机选取5个以上高倍镜视野,采用Image Pro Plus 6.0图像分析软件测定相同级别支气管横断面气道壁厚度变化。另随机选取3张石蜡切片进行免疫组化染色,观察阳性细胞中蛋白的表达。
1.5 Real-Time PCR 检测采用TRIzol 提取左肺组织总RNA,使用逆转录试剂盒合成单链cDNA,再设计引物,扩增目的基因HMGB1上游引物为:5'-GCGAGCATCCTGGCTTATC-3',下游引物为:5'-TTCAGCTTGGCAGCTTTCT-3';TLR4上游引物为:5'-AGCAGGTGGAATTGTATCGC-3',下游引物为:5'-TCAGGTCCAAGTTGCCGTTT-3';NF-κB上游引物为:5'-GCATTCTGACCTTGCCTATCT-3',下游引物为:5'-CTCCAGTCTCCGAGTGAAGC-3';内参β-actin上游引物为:5'-CATTGCTGACAGGATG-CAGA-3',下游引物为:5'-CTGCTGGAAGGTGGAC- AGTGA-3'。PCR反应体系(20 μL):PCR Forward Primer(10 μM)0.5 μL,PCR Reverse Primer(10 μM)0.5 μL,Bestar® Sybr Green qPCR Master Mix 10 μL,cDNA模板2 μL,ddH2O 7 μL。PCR反应条件:95℃ 2 min;94℃ 20 s,58℃ 20 s,40个循环。融解曲线分析:温度65~95℃。每个样重复3次。应用Agilent Stratagene Mx3000P荧光定量PCR仪进行荧光定量实验,记录每次测定的Ct值,以β-actin为内参照。按照2-△△Ct方法进行实验数据处理,目的基因的相对表达量=2-△△Ct。
1.6 Western blot蛋白印迹法检测取-80℃冰箱冻存的肺组织40 mg,剪碎后加入0.5 mL裂解液,匀浆研磨器处理1~2 min,冰上孵育30 min,离心10~15 min,收集上清。应用BCA蛋白定量分析盒测定蛋白浓度并定量,加入5×SDS上样缓冲液,上样,每孔上样量为20 μg。使用12%的聚丙烯酰胺凝胶进行电泳,电压为120 V,时间为1.5 h。然后转膜,使用PVDF膜,转膜条件为300 mA恒流,时间为HMGB1:25 min,TLR4:96 min,NF-κB:60 min。转膜完成后,5%脱脂奶粉室温封闭1 h,分别使用HMGB1、TLR4、NF-κB一抗(均为1 : 2 000)或GAPDH 4℃孵育12 h。然后TBST洗涤3次,应用辣根过氧化物酶标记的二抗室温孵育40 min,TBST洗涤后曝光显影。应用凝胶图像处理系统分析蛋白条带。根据相对灰度值公式(目的蛋白/GAPDH灰度值)计算出目的蛋白的相对表达量。
1.7 统计学分析应用SPSS 17.0统计软件对数据进行统计学分析,计量资料用均数±标准差(x±s)表示,多个样本均数的比较采用单因素方差分析,组间数据两两比较采用SNK-q检验,计量资料相关性使用Pearson相关性分析,P<0.05为差异有统计学意义。
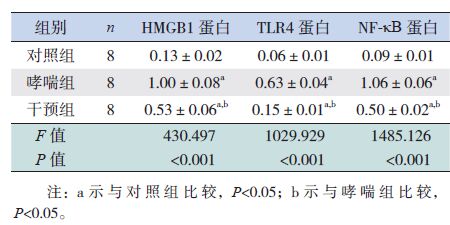
2 结果 2.1 各组小鼠肺组织病理形态学改变对照组小鼠支气管壁光滑完整,上皮细胞排列整齐,少量炎性细胞浸润。哮喘组小鼠气道充血水肿、上皮细胞排列紊乱、脱落,管腔狭窄,肺泡腔缩小,肺泡间隔增宽,气管壁及肺间质可见大量炎性细胞浸润,以嗜酸性粒细胞为主,各级气道及肺泡腔内可见渗出物;哮喘组激发第2周较第1周表现更为明显。干预组小鼠支气管壁较哮喘组光滑,气道壁肿胀、肺泡间隔增宽、管腔狭窄和炎性细胞浸润数量较哮喘组明显减轻。见图 1。
|
图 1 各组小鼠肺组织病理形态学改变(苏木精-伊红染色,×400) 对照组小鼠支气管壁光滑完整,上皮细胞排列整齐,少量炎性细胞浸润;哮喘组气道壁充血水肿、管腔狭窄,肺泡腔缩小,肺泡间隔增宽,大量炎性细胞浸润,上皮细胞排列紊乱、脱落;干预组支气管壁较哮喘组光滑,气道壁肿胀、肺泡间隔增宽、管腔狭窄和炎性细胞浸润数量较哮喘组明显减轻。 |
2.2 各组小鼠肺组织中HMGB1、TLR4和NF-κB 蛋白的定位表达情况
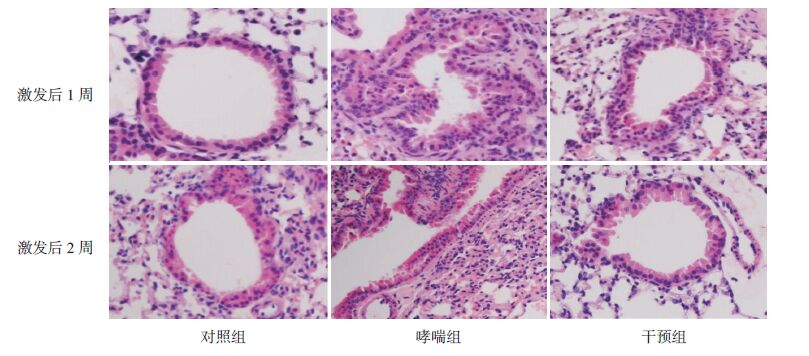
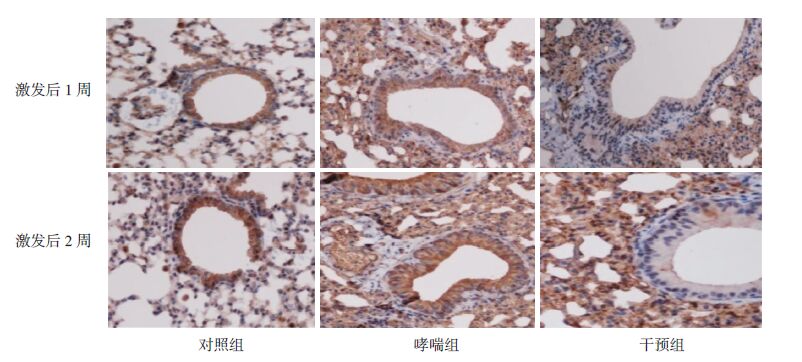
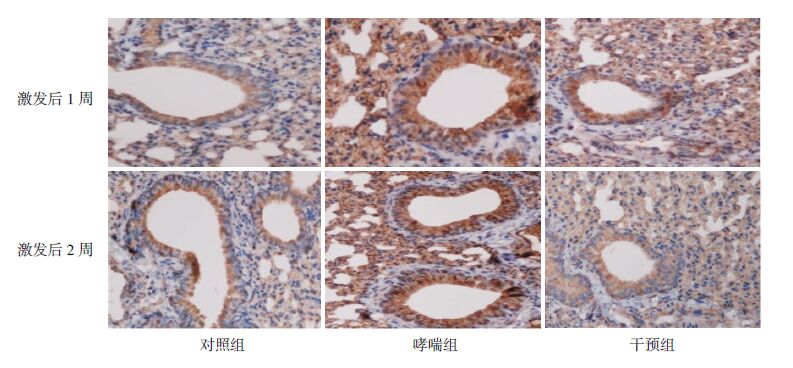
HMGB1主要定位于气道上皮细胞及炎症细胞的细胞核和细胞浆,TLR4位于上述细胞的细胞膜和细胞浆,NF-κB蛋白主要定位于细胞核。HMGB1、TLR4及NF-κB蛋白在对照组小鼠肺组织中表达均较弱;而在哮喘组小鼠肺组织中表达均较强,干预组HMGB1、TLR4和NF-κB蛋白表达较哮喘组明显减少。见图 2~4。
|
图 2 免疫组化法检测各组小鼠肺组织HMGB1的表达(DAB显色,×400) 对照组HMGB1表达较弱;哮喘组 HMGB1表达较强;干预组HMGB1表达较哮喘组减弱;深棕黄色为HMGB1表达阳性细胞。 |
|
图 3 免疫组化法检测各组小鼠肺组织TLR4的表达(DAB显色,×400) 对照组TLR4表达较弱;哮喘组TLR4表达较强;干预组TLR4表达较哮喘组减弱;深棕黄色为TLR4表达阳性细胞。 |
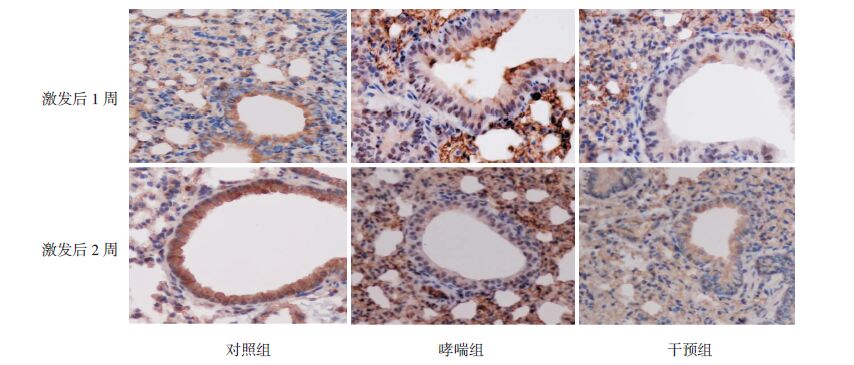
|
图 4 免疫组化法检测各组小鼠肺组织NF-κB的表达(DAB显色,×400) 对照组NF-κB表达较弱;哮喘组 NF-κB表达较强;干预组NF-κB表达较哮喘组减弱;深棕黄色为NF-κB表达阳性细胞。 |
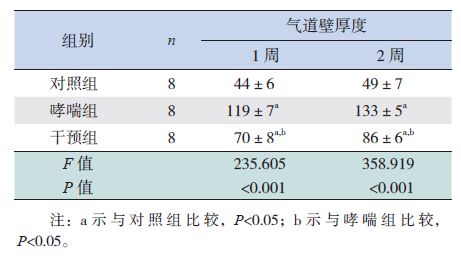
2.3 各组小鼠气道壁厚度变化
在激发1周和激发2周时,哮喘组小鼠气道壁厚度分别较对照组明显增加(P<0.05),干预组小鼠气道壁厚度分别较哮喘组明显下降(P<0.05),但仍分别高于对照组(P<0.05)。见表 1。
| 表 1 各组小鼠气道壁厚度比较 (x±s,μm) |
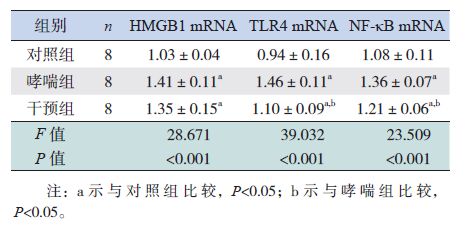
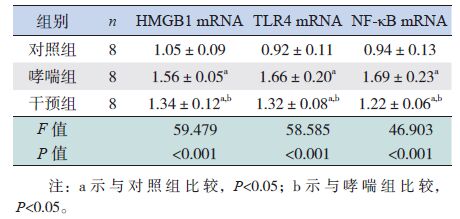
2.4 各组小鼠肺组织中HMGB1、TLR4和NF-κB mRNA的表达变化
RT-PCR结果显示:在激发1周和激发2周时,哮喘组小鼠肺组织中HMGB1、TLR4和NF-κB mRNA表达量均明显高于对照组(P<0.05);干预组小鼠肺组织中TLR4和NF-κB mRNA表达量明显低于哮喘组,但仍明显高于对照组(P<0.05)。在激发1周时,干预组HMGB1 mRNA表达量与哮喘组比较差异无统计学意义(P>0.05),但高于对照组(P<0.05);在激发2周时,干预组HMGB1 mRNA表达量低于哮喘组,但仍高于对照组(P<0.05)。见表 2~3。
| 表 2 激发1周时各组小鼠肺组织HMGB1、TLR4和 NF-κB mRNA表达量比较 (x±s) |
| 表 3 激发2周时各组小鼠肺组织HMGB1、TLR4和 NF-κB mRNA表达量比较 (x±s) |
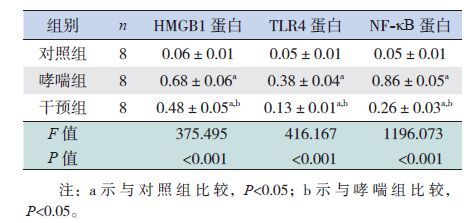
2.5 各组小鼠肺组织中HMGB1、TLR4和NF-κB 蛋白的表达变化
Western blot结果显示:在激发1周和激发2周时,哮喘组小鼠肺组织中HMGB1、TLR4和NF-κB蛋白表达量均明显高于对照组(P<0.05);干预组小鼠肺组织中HMGB1、TLR4和NF-κB 蛋白表达量均明显低于哮喘组,但仍明显高于对照组(P<0.05)。见图 5和表 4~5。
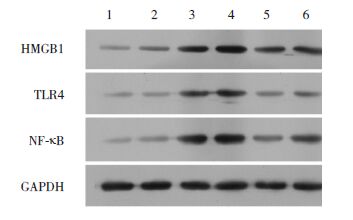
|
图 5 Western blot检测各组小鼠肺组织HMGB1、TLR4、NF-κB蛋白的表达水平 1:对照组激发第1周;2:对照组激发第2周;3:哮喘组激发第1周;4:哮喘组激发第2周;5:干预组激发第1周;6:干预组激发第2周。 |
| 表 4 激发1周时各组小鼠肺组织HMGB1、TLR4和 NF-κB蛋白表达量比较 (x±s) |
| 表 5 激发2周时各组小鼠肺组织HMGB1、TLR4和 NF-κB蛋白表达量比较 (x±s) |
2.6 气道壁厚度、HMGB1 mRNA、TLR4 mRNA和NF-κB mRNA的相关性分析
小鼠气道壁厚度与肺组织HMGB1、TLR4和NF-κB的mRNA表达量均呈正相关性(分别r=0.804、0.895、0.834;P<0.05);肺组织HMGB1 mRNA分别与TLR4、NF-κB mRNA表达量均呈正相关(分别r=0.752、0.734;P<0.05);TLR4 mRNA和NF-κB mRNA表达量也呈正相关(r=0.812,P<0.05)。见图 6~11。
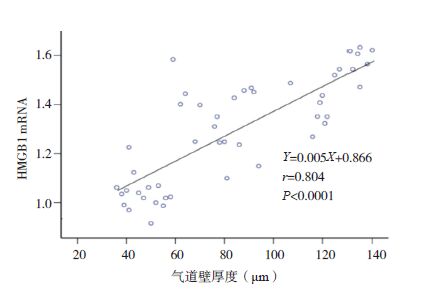
|
图 6 气道壁厚度与HMGB1 mRNA水平相关分析图 |
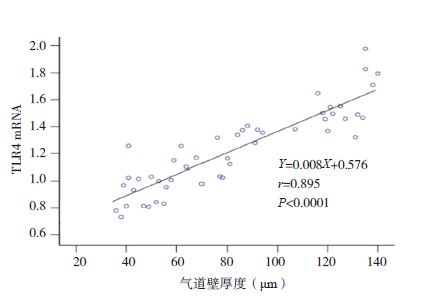
|
图 7 气道壁厚度与TLR4 mRNA水平相关分析图 |
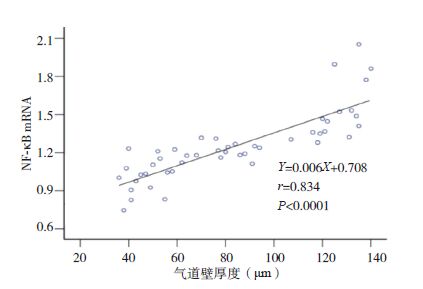
|
图 8 气道壁厚度与NF-κB mRNA水平相关分析图 |
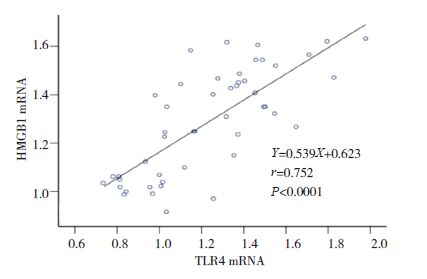
|
图 9 HMGB1 mRNA水平与TLR4 mRNA水平相关分析图 |
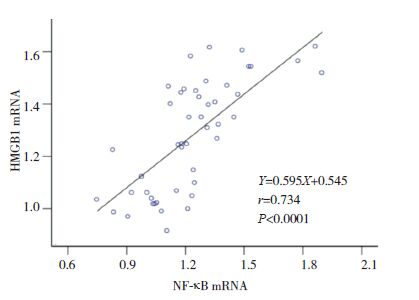
|
图 10 HMGB1 mRNA水平与NF-κB mRNA水平相关分析图 |
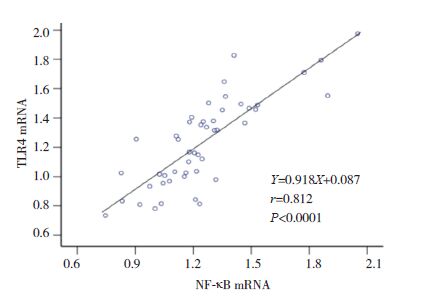
|
图 11 TLR4 mRNA水平与NF-κB mRNA水平相关分析图 |
3 讨论
Wang等[5]于1999 年首次发现,在脓毒症发病过程中,HMGB1 是一种重要的晚期炎性介质,巨噬细胞、DC、上皮细胞等在LPS、IFN-γ等因素刺激下,胞内HMGB1可被主动分泌到细胞外[6]。参与HMGB1信号转导的受体,包括晚期糖基化终末产物受体(RAGE)和TLR中的TLR2、TLR4和TLR9,LPS可以剌激DC分泌内源性HMGB1,通过RAGE传递信号激活MAPK、ERK1/2、NF-κB等下游信号通路,促使TNF-α,IFN-γ、IL-6等细胞因子的释放[7],脓毒症时毒素及炎症介质也可以激活TLR4,通过TLR4/IFN-β/STAT-1生物分子信号轴,引起HMGB1释放[8];炎症介质与HMGB1相互诱导,出现炎症瀑布,维持慢性炎症。上述HMGB1是一个晚期炎性介质,不能早期发挥作用。研究证实:炎症早期HMGB1可作为损伤相关分子模式(DAMP)与其受体TLR4结合并相互作用,激活NF-κB,导致下游的炎症介质释放,完成信号传导过程[9]。在细胞因子产生过程中,TLR4活性被中和后,HMGB1诱导细胞因子产生的效应显著减弱,表明TLR4是HMGB1促炎过程中必须的受体[10],因此认为,TLR4作为HMGB1的重要受体参与了HMGB1的信号传导过程,并且发现在机械通气肺损伤和气道上皮细胞释放炎性因子过程中HMGB1/TLRs信号通路发挥了重要作用[11, 12]。
本研究发现,第1周的哮喘组模型即出现明显的气道炎症和结构改变;第2周更为明显。哮喘组1、2周气道壁厚度较对照组1、2周均明显增加。应用1周的适量1,25- (OH)2D3干预即可明显改善气道炎症和气道结构改变。免疫组化发现,第1周时哮喘组小鼠HMGB1、TLR4和NF-κB蛋白均呈阳性表达,第2周表现更明显。应用Real-time PCR和Western blot检测发现,第1周时哮喘组肺组织中HMGB1、TLR4和NF-κB的mRNA和蛋白表达量均明显升高,第2周升高更明显;且HMGB1、TLR4、NF-κB三个指标的mRNA与气道壁厚度均呈明显正相关性,HMGB1 mRNA、TLR4 mRNA和NF-κB mRNA间也呈明显正相关;提示OVA诱导的哮喘小鼠模型中,HMGB1/TLR4/NF-κB信号通路发挥着重要作用,介导了哮喘发病及气道重塑过程。
一项研究显示OVA致敏的小鼠经过1周激发后HMGB1 mRNA水平明显升高,第2周时更高,然后逐渐下降,各时间段与对照组均有显著差异,干预治疗2周后HMGB1 mRNA 水平方开始下降,第4周才低于哮喘组[13]。我们通过OVA诱导的哮喘小鼠模型,通过免疫组化、实时荧光定量PCR、免疫蛋白印迹等方法,明确了HMGB1和TLR4无论从基因水平还是蛋白水平在哮喘小鼠肺组织的表达量确实是显著增加的,哮喘1周组即明显升高,第2周升高更明显,与上述研究结果一致,但因观察时间短,后期的变化未能证实;干预治疗后,第1周HMGB1 mRNA 表达量无明显变化,第2周才明显下降,低于哮喘组;但HMGB1蛋白表达量第1周即明显下降,低于哮喘组,与上述研究不完全一致,考虑与干预药物的效果存在差异有关。HMGB1既可被单核/巨噬细胞主动分泌,也可被坏死细胞早期被动释放,哮喘气道炎症中脱落、坏死的上皮细胞及激活的巨噬细胞等均可以释放HMGB1,因此,HMGB1可能会随着哮喘持续时间和气道损伤加重而出现高峰,而随着自身炎症的修复,炎症细胞和坏死的上皮细胞释放的HMGB1也逐渐减少,HMGB1可能逐渐下降,而本文使用的Vit D则可能具有促使自身炎症修复,下调HMGB1表达的作用。HMGB1 的升高也可能存在双重作用,一方面作为炎症因子发挥致炎作用,另一方面则可能通过激活DC,诱导Th0细胞向Th1分化,抑制Th2型反应,调节Th1/Th2 平衡,减轻气道炎症,促进组织结构修复。因此,HMGB1是一种重要的内源性炎性介质,既可作为早期的炎症触发因子,又可作为晚期的炎症启动因子;监测HMGB1的动态变化有利于进一步揭示其在哮喘中的作用机制。
1,25-(OH)2D3主要通过免疫调节机制影响哮喘发病过程。研究证实,1,25-(OH)2D3 可以减少气道上皮细胞IL-6、IL-8和TNF-α的分泌而减轻气道炎症[14],可以下调成纤维细胞分泌具有促纤维化活性的PGE2[15]、阻止ASMC的过度增殖[16]、抑制哮喘小鼠肺组织中MMP-9和NF-κB表达阻止气道重塑[17]。另外一项实验发现,VitD 缺乏组哮喘大鼠肺组织病理改变程度较正常模型组严重,提示VitD缺乏加重了大鼠哮喘的严重程度[18],说明VitD对哮喘可能有保护和改善作用。
目前关于1,25-(OH)2D3对哮喘中HMGB1和TLR4的研究很少。有人发现HMGB1在支气管哮喘小鼠的肺组织和BALF中表达明显增加,但地塞米松无明显拮抗效果[19];而OVA致敏小鼠后肺组织HMGB1 mRNA 水平明显升高,孟鲁斯特干预可以下调其表达,提示孟鲁司特对HMGB1有调控作用[13]。1,25-(OH)2D3对HMGB1和TLR4的调节机制并不清楚,但因它们与天然免疫和适应性免疫存在密切的联系,1,25-(OH)2D3可能通过与各种免疫细胞和支气管上皮细胞上广泛表达的VDR受体结合,介导TLR识别病原体的辅助分子CD14和抗菌肽的基因表达[20],发挥免疫调节作用,缓解气道炎症;而TLR受体被激活后又可以诱导细胞分泌1,25-(OH)2D3 并与VDR发生应答。另有人发现,1,25-(OH)2D3可以下调2型糖尿病患者单核细胞表面的TLR4和NF-κB 表达及炎症反应因子水平[21]。本研究和本课题组前期研究均发现,1,25-(OH)2D3可以下调HMGB1和TLR4 mRNA和蛋白在哮喘肺组织的表达,并且与哮喘气道炎症和重塑改善相关,因此,推测1,25-(OH)2D3可能通过参与HMGB1和TLR4的调控影响哮喘的发病过程。
NF-κB是具有广泛调节作用的核转录因子,涉及哮喘诸多环节,而VDR是NF-κB重要的上游分子[22],1,25-(OH)2D3 通过与VDR结合,增加哮喘肺组织中抑制蛋白IκBa的mRNA表达及减少其磷酸化等途径,抑制NF-κB信号通路,调节体内外多种生物学效应[23]。除此经典途径外,1,25-(OH)2D3 还通过调节NF-κB上游的其他因子对其进行调控。本研究发现,1,25-(OH)2D3干预后哮喘小鼠肺组织气道壁厚度明显减轻、HMGB1、TLR4、NF-κB的基因和蛋白表达均明显下降,且这些指标间均呈明显的正相关,因此认为,1,25-(OH)2D3 对 HMGB1/TLR4/NF-κB具有调控作用,可能是其干预改善哮喘气道炎症及气道重塑的重要机制。
鉴于维生素D广泛的免疫调节作用,其在哮喘治疗中的应用值得关注,进一步研究HMGB1/TLR4/NF-κB信号通路及1,25-(OH)2D3 对该通路和哮喘的调控作用将具有重要的基础和临床意义。
| [1] | Qiao J, Luan B, Gu H, et al. Effect of different 1,25-(OH)2D3 doses on high mobility group box1 and toll-like receptors 4 expression in lung tissue of asthmatic mice[J]. Int J Clin Exp Med, 2015, 8 (3): 4016–4023. |
| [2] | 李彦玲, 栾斌, 乔俊英, 等. 不同剂量1,25-(OH)2D3对哮喘小鼠肺内高迁移率族蛋白B1及IL-17表达的影响[J]. 中国当代儿科杂志, 2015, 17 (2): 190–195. |
| [3] | Temelkovski J, Hogan SP, Shepherd DP, et al. An improved murine model of asthma:selective airway inflammation, epithelial lesions and increased methacholine responsiveness following chronic exposure to aerosolised allergen[J]. Thorax, 1998, 53 (10): 849–856. DOI:10.1136/thx.53.10.849 |
| [4] | Mayuzumi H, Ohki Y, Tokuyama K, et al. Age-related difference in the persistency of allergic airway inflammation and bronchial hyperresponsiveness in a murine model of asthma[J]. Int Arch Allergy Immunol, 2007, 143 (4): 255–262. DOI:10.1159/000100570 |
| [5] | Wang H, Bloom O, Zhang M, et al. HMG-1 as a late mediator of endotoxin lethality in mice[J]. Science, 1999, 285 (5425): 248–251. DOI:10.1126/science.285.5425.248 |
| [6] | Pugin J, Dunn I, Jolliet P, et al. Activation of human macrophages by mechanical ventilation in vitro[J]. Am J Physiol, 1998, 275 (6 Pt 1): L1040–L1050. |
| [7] | Dumitriu IE, Baruah P, Valentinis B, et al. Release of high mobility group box1 by dendritic cells controls T cell activation via the receptor for advanced glycation end products[J]. J Immunol, 2005, 174 (12): 7506–7515. DOI:10.4049/jimmunol.174.12.7506 |
| [8] | Kim JH, Kim SJ, Lee IS, et al. Bacterial endotoxin induces the release of high mobility group box 1 via the IFN-beta signaling pathway[J]. J Immunol, 2009, 182 (4): 2458–2466. DOI:10.4049/jimmunol.0801364 |
| [9] | Park JS, Arcaroli J, Yum HK. Activation of gene expression in human neutrophils by high mobility group box1 protein[J]. Am J Physiol Cell Physiol, 2003, 284 (4): C870–C879. DOI:10.1152/ajpcell.00322.2002 |
| [10] | Yang H, Hreggvidsdottir HS, Palmblad K, et al. A critical cysteine is required for HMGB1 binding to Toll-like receptor 4 and activation of macrophage cytokine release[J]. Proc Natl Acad Sci U S A, 2010, 107 (26): 11942–11947. DOI:10.1073/pnas.1003893107 |
| [11] | 李菡, 姜宝珍, 刘泽玉, 等. HMGB1/TLRs信号通路在大鼠机械通气肺损伤中的作用[J]. 安徽医科大学学报, 2015, 50 (4): 458–462. |
| [12] | 吴国荣, 王发龙, 陈文, 等. 重组高迁移率族蛋白B1对肺上皮细胞细胞因子释放的影响及其机制[J]. 南京医科大学学报(自然科学版), 2012, 32 (5): 641–644. |
| [13] | 周卫芳, 刘芬菊, 金美芳, 等. 白三烯受体拮抗剂对哮喘小鼠肺组织HMGB1表达的影响[J]. 江苏医药, 2010, 36 (6): 696–698. |
| [14] | Khare D, Godbole NM, Pawar SD, et al. Calcitriol[1, 25(OH)2D3] pre-and post-treatment suppresses inflammatory response to influenza A (H1N1) infection in human lung A549 epithelial cells[J]. Eur J Nutr, 2013, 52 (4): 1405–1415. DOI:10.1007/s00394-012-0449-7 |
| [15] | Liu X, Nelson A, Wang X, et al. Vitamin D modulates prostaglandin E2 synthesis and degradation in human lung fibroblasts[J]. Am J Respir Cell Mol Biol, 2014, 50 (1): 40–50. |
| [16] | Foong RE, Shaw NC, Berry LJ, et al. Vitamin D deficiency causes airway hyperresponsiveness, increases airway smooth muscle mass, and reduces TGF-β expression in the lungs of female BALB/c mice[J]. Physiol Rep, 2014, 2 (3): e00276. |
| [17] | 宋颖芳, 洪景芳, 柳德灵, 等. 1,25-二羟维生素D3对慢性哮喘小鼠气道重塑中MMP-9及NF-κB表达的影响[J]. 中国呼吸与危重监护杂志, 2013, 12 (1): 36–40. |
| [18] | 顾海燕, 赵德育. 维生素D缺乏对大鼠哮喘模型气道炎症的影响[J]. 南京医科大学学报(自然科学版), 2015, 35 (10): 1369–1371. |
| [19] | 侯长春, 赵海金, 蔡绍曦, 等. 支气管哮喘小鼠模型肺组织和肺泡灌洗液高迁移率族蛋白B1的表达及地塞米松的干预作用[J]. 南方医科大学学报, 2010, 30 (9): 2051–2054. |
| [20] | Hansdottir S, Monick MM, Lovan N, et al. Vitamin D decreases respiratory syncytial virus induction of NF-kappaB-linked chemokines and cytokines in airway epithelium while maintaining the antiviral state[J]. J Immunol, 2010, 184 (2): 965–974. DOI:10.4049/jimmunol.0902840 |
| [21] | Mitrović M, Ilić T, Stokić E, et al. Influence of glucoregulation quality on C-reactive protein, interleukin-6 and tumor necrosis factor-alpha level in patients with diabetes type 1[J]. Vojnosanit Pregl, 2011, 68 (9): 756–761. DOI:10.2298/VSP1109756M |
| [22] | Riis JL, Johansen C, Gesser B, et al. 1 alpha, 25(OH)(2)D(3) regulates NF-kappaB DNA binding activity in cultured normal human keratinocytes through an increase in IkappaB alpha expression[J]. Arch Dermatol Res, 2004, 296 (5): 195–202. DOI:10.1007/s00403-004-0509-9 |
| [23] | 宋颖芳, 赖国祥, 柳德灵, 等. 1, 25-二羟维生素D3对支气管哮喘小鼠气道重塑的影响及其机制[J]. 中华结核和呼吸杂志, 2013, 36 (2): 119–121. |
 2017, Vol. 19
2017, Vol. 19