免疫性血小板减少症(immune thrombocytopenic purpura, ITP),原称特发性血小板减少性紫癜,是一种以血小板减少为特征的出血性疾病,是由于人体内产生抗血小板自身抗体导致单核巨噬细胞系统破坏血小板过多,从而造成血小板减少,发病原因尚不明确。临床上可分为新近诊断、持续性和慢性3种类型[1]。目前常用治疗药物是糖皮质激素和静脉用免疫球蛋白(IVIG)。但糖皮质激素治疗不良反应明显,而IVIG虽然作用迅速,但费用昂贵,且其为血制品,具有血液传播疾病的风险。抗-D免疫球蛋白(anti-D immunoglobulin, anti-D)通过致敏的红细胞竞争性抑制和阻断脾脏内的单核-巨噬细胞的Fc受体,从而阻断抗体致敏的血小板在脾脏内被吞噬[2],适用于Rh-D阳性、脾脏未切除的患者[3]。一些随机对照试验(RCT)对anti-D治疗儿童ITP的有效性和安全性进行了研究,但研究结果并不一致。2013年的1篇Meta分析认为anti-D治疗急性ITP疗效可能与大剂量IVIG相同[4]。但随着相关文献的增多和样本量的扩大,结论可能并不一致。本研究应用Meta分析方法,评价anti-D治疗儿童新近诊断的ITP的有效性及安全性,为临床治疗提供参考依据。
1 资料与方法 1.1 文献检索策略检索PubMed、EMBASE、Cochrane Library、Ovid、Web of Science、中国知网及万方数据库,收集anti-D与IVIG比较或不同剂量anti-D比较的RCT文献,检索时间均为各数据库建库至2017年4月。
中文检索词为:免疫性血小板减少症、血小板减少性紫癜、免疫性血小板减少性紫癜、特发性血小板减少性紫癜、儿童、小儿、抗-D免疫球蛋白。英文检索词为:anti-D immunoglobulin;immune thrombocytopenic purpura;idiopathic thrombocytopenic purpura;child;randomized controlled trial。
1.2 文献纳入标准纳入标准包括:(1)文献研究类型为RCT,试验组采用anti-D治疗,对照组采用IVIG治疗;(2)研究对象年龄为0.5~18岁;(3)均为新近诊断的ITP患者,且纳入前均未使用过激素等相关药物治疗;(4)血小板(PLT)计数≤ 20×109/L、脾脏未切除;(5)报道了本Meta分析设定的结局指标;(6)中文或英文文献。
1.3 文献排除标准排除标准包括:(1)重复发表的RCT文献、综述;(2)研究对象为持续性或慢性ITP患儿;(3)继发性血小板减少性紫癜患儿,如系统性红斑狼疮等;(4)未提供充分原始数据,且索取无果,无法获取原文的文献。
1.4 研究指标研究指标包括:(1)治疗24 h、72 h和7 d后PLT计数 > 20×109/L的患儿百分比;(2)治疗24 h、72 h和7 d后的PLT计数;(3)血红蛋白下降值;(4)不同剂量anti-D组间PLT计数的比较;(5)不良反应。(1)~(3)为主要结局指标,(4)和(5)为次要结局指标。
1.5 资料提取参考Cochrane协作网推荐的方法编制资料提取表,由2名研究者独立提取资料,交叉核对,如果有不一致观点通过讨论进行解决。本Meta分析提取的资料包括:(1)文献的基本特征(包括文题、年份、研究者姓名等);(2)所纳入文献研究对象的基本特征、干预措施和结局指标。
1.6 文献质量评价采用Cochrane系统评价手册5.1.0的标准行文献偏倚风险评估(Review Manager 5.3自带):(1)是否随机,随机方法是否正确;(2)是否采用盲法;(3)是否做到分配隐藏;(4)研究结局是否采用盲法评价;(5)随访是否完成。所有质量标准均满足者,发生偏倚的可能性最低;如其中任何一条或多条质量评价标准仅部分满足(或不清楚),则该研究存在相应偏倚的可能性为中等;如其中任何一条或多条完全不满足(未使用或不正确),则该研究存在相应偏倚的高度可能性。
1.7 统计学分析采用Review Manager 5.3进行Meta分析。计数资料的效应指标以比值比(OR)及其95%可信区间(CI)表示,计量资料的效应指标以加权均数差(WMD)及其95%CI表示。异质性检验的检验方法采用Q检验和I2统计量,如果异质性检验结果P≥0.1、I2≤50%,表示各研究间无统计学异质性,采用固定效应模型;如果异质性检验结果P < 0.1、I2 > 50%,表示研究间存在统计学异质性,若找不到异质性来源则采用随机效应模型进行数据合并。采用Cochrane风险偏倚评估工具分析是否存在偏倚。利用Review Manager 5.3软件采取去除单项研究法,即文献的逐一排除进行敏感性分析,评价Meta分析结果的稳定性。P < 0.05为差异有统计学意义。
2 结果 2.1 文献检索结果文献纳入情况:初步检出文献1 119篇,通过阅读标题、摘要,排除重复、动物实验、综述、包含成人的研究985篇,进一步阅读全文后排除非随机研究126篇,共获取8篇RCT研究[5-12],但1篇RCT文献[12]因结局指标判断方法不一致,将其剔除,最终7篇文献[5-11]符合纳入标准进入Meta分析。其中2篇文献[9-10]对anti-D 50 μg/kg与anti-D 75 μg/kg进行了比较。7篇文献共纳入490例患儿。
2.2 纳入研究的基本情况所纳入的7篇文献的基本情况见表 1。在有效率和(或)PLT上升数值方面进行比较,文献[5, 7, 10]结果显示anti-D与IVIG治疗ITP同样有效;文献[6, 9, 11]结果显示IVIG效果优于anti-D;文献[9]结果显示anti-D 50 μg/kg与anti-D 75 μg/kg疗效相当;文献[10]结果显示anti-D 75 μg/kg效果优于anti-D 50 μg/kg。
| 表 1 纳入文献的基本资料 |
|
|
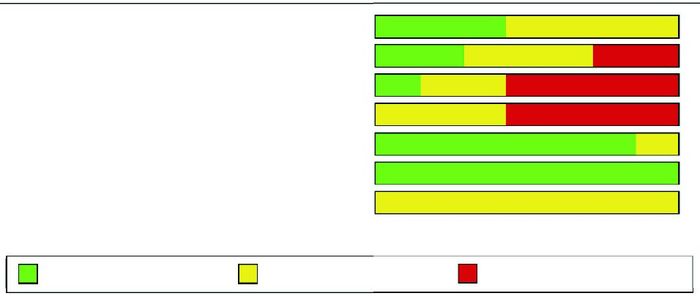
本Meta分析采用Cochrane风险偏倚评估工具进行文献偏倚评价,3篇文献[6, 8, 11]描述了随机序列产生方法,1篇文献[6]为盲法试验,2篇文献[6, 8]进行了分配隐藏,5篇文献[5-7, 10-11]报告了失访、随访;7篇文献均未明确说明结局是否采用盲法评价,其他偏倚来源均为不清楚;7篇文献结局数据完整,不存在选择性报告研究结果,故随访及报告的偏倚均较小。纳入研究的方法学质量评价见图 1。
|
图 1 文献偏倚评估 |
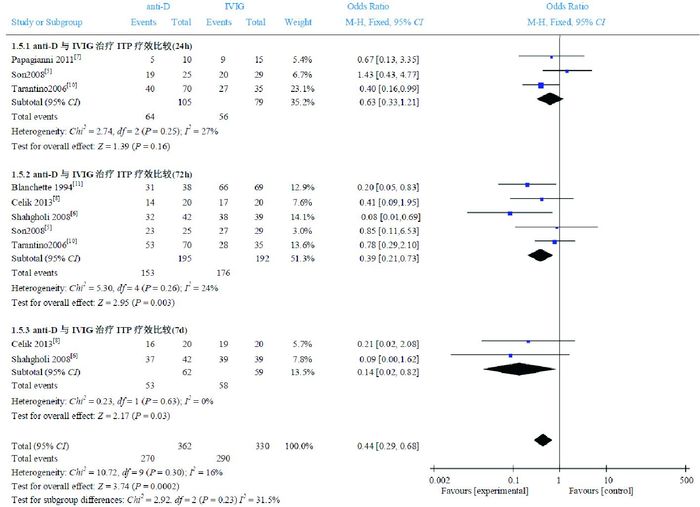
3篇文献[5, 7, 10]研究anti-D组与IVIG组比较治疗24 h后PLT > 20×109/L的患儿百分比,Meta分析结果显示,两组比较差异无统计学意义(OR=0.63,95%CI:0.33~1.21,P=0.16),文献间具有同质性(P=0.25,I2=27%)。5篇文献[5-6, 8, 10-11]研究anti-D组与IVIG组比较治疗72 h后PLT > 20×109/L的患儿百分比,Meta分析结果显示,anti-D组治疗72 h后PLT > 20×109/L的患儿百分比低于IVIG组,两组比较差异有统计学意义(OR=0.39,95%CI:0.21~0.73,P=0.003),文献间具同质性(P=0.26,I2=24%)。2篇文献[6, 8]研究anti-D组与IVIG组比较治疗7 d后PLT > 20×109/L的患儿百分比,Meta分析结果显示,IVIG组治疗7 d后PLT > 20×109/L的患儿百分比高于anti-D组,两组比较差异有统计学意义(OR=0.14,95%CI:0.02~0.82,P=0.03),文献间具同质性(P=0.63,I2=0%)。见图 2。
|
图 2 anti-D组与IVIG组治疗后PLT > 20×109/L的患儿百分比比较的Meta分析 |
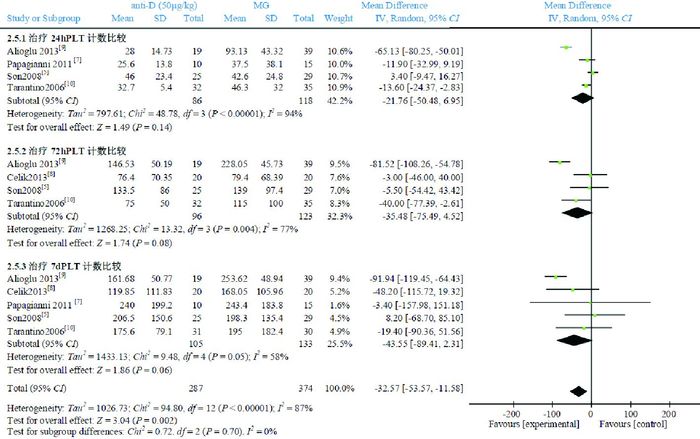
4篇文献[5, 7, 9-10]比较了anti-D 50 μg/kg组与IVIG组治疗24 h后的PLT计数,Meta分析结果显示,两组比较差异无统计学意义(WMD=-21.76,95%CI:-50.48~6.95,P=0.14),文献间具有异质性(P < 0.00001,I2=94%);4篇文献[5, 8-10]比较了anti-D 50 μg/kg组与IVIG组治疗72 h后的PLT计数,Meta分析结果显示,两组比较差异无统计学意义(WMD=-35.48,95%CI:-75.49~4.52,P=0.08),文献间具有异质性(P=0.004,I2=77%);5篇文献[5, 7-10]比较了anti-D 50 μg/kg组与IVIG组治疗7 d后的PLT计数,Meta分析结果显示,两组比较差异无统计学意义(WMD=-43.55,95%CI:-89.41~2.31,P=0.06),文献间具有异质性(P=0.05,I2=58%)。见图 3。
|
图 3 anti-D 50 μg/kg组与IVIG组治疗24 h、72 h及7 d后PLT计数比较的Meta分析 |
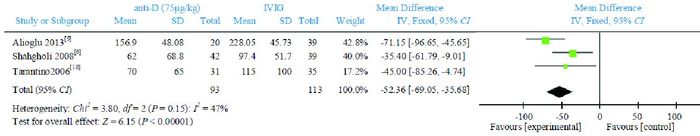
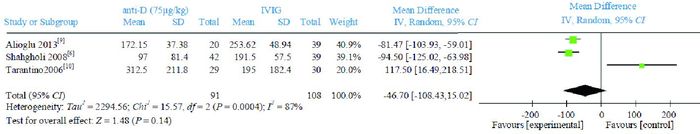
3篇文献[6, 9-10]比较了anti-D75 μg/kg组与IVIG组治疗72 h及7 d后的PLT计数。Meta分析结果显示,IVIG组治疗72 h后的PLT计数高于anti-D 75 μg/kg组,两组比较差异有统计学意义(WMD=-52.36,95%CI:-69.05~-35.68,P < 0.00001),文献间具有同质性(P=0.15,I2=47%),见图 4。治疗7 d后的PLT计数,两组比较差异无统计学意义(WMD=-46.70,95%CI:-108.43~15.02,P=0.14),文献间具有异质性(P=0.0004,I2=87%),见图 5。
|
图 4 anti-D 75 μg/kg组与IVIG组治疗72 h后PLT计数比较的Meta分析 |
|
图 5 anti-D 75 μg/kg组与IVIG组治疗7 d后PLT计数比较的Meta分析 |
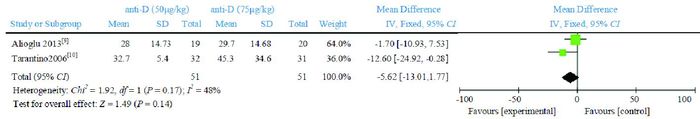
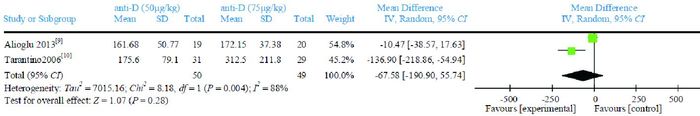
2篇文献[9-10]比较anti-D 50 μg/kg与anti-D 75 μg/kg治疗24 h、7 d后PLT计数。Meta分析结果显示,治疗24 h后的PLT计数,两组比较差异无统计学意义(WMD=-5.62,95%CI:-13.01~1.77,P=0.14),文献间具有同质性(P=0.17,I2=48%),见图 6。治疗7 d后的PLT计数,两组比较差异亦无统计学意义(WMD=-67.58,95%CI:-190.90~55.74,P=0.28),文献间具有异质性(P=0.004,I2=88%),见图 7。
|
图 6 anti-D 50 μg/kg与anti-D 75 μg/kg治疗24 h后PLT计数比较的Meta分析 |
|
图 7 anti-D 50 μg/kg与anti-D 75 μg/kg治疗7 d后PLT计数比较的Meta分析 |
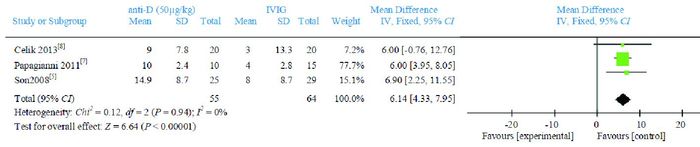
有3篇文献[5, 7-8]比较anti-D 50 μg/kg组与IVIG组治疗后血红蛋白下降的数值,Meta分析结果显示,anti-D组比IVIG组血红蛋白下降更明显,两组比较差异有统计学意义(WMD=6.14,95%CI:4.33~7.95,P < 0.00001),文献间具有同质性(P=0.94,I2=0%),见图 8。
|
图 8 anti-D 50 μg/kg组与IVIG组血红蛋白下降数值比较的Meta分析 |
不良反应的结局指标无法合并效应量进行Meta分析,只进行描述性分析。6篇文献[5-7, 9-11]描述了常见不良反应,主要为发热、寒战、头痛、恶心、呕吐等,anti-D组与IVIG组均发生了不同程度的常见不良反应,两组比较差异无统计学意义,两组均未出现严重不良反应(如溶血等)。治疗前或治疗后给予对乙酰氨基酚或抗组织胺药可以减轻不良反应[5, 7]。
2.6 敏感性分析anti-D 50 μg/kg与IVIG比较治疗24 h、72 h及7 d后的PLT计数,因文献间异质性较大,遂进行敏感性分析。因文献[9]纳入患者中包括了6例Rh(-)患者,其余文献纳入患者均为Rh(+),将其剔除后重新进行Meta分析。结果显示,排除前后Meta分析结果一致,说明研究合并结果稳定性较好,结果可靠,见表 2。
| 表 2 排除含Rh(-)患者的文献前后Meta分析结果比较 |
|
|
本文共纳入7篇RCT研究进入Meta分析,3篇文献描述了随机序列产生方法,1篇文献实施了盲法,5篇文献在选择偏倚、测量偏倚和失访偏倚方面的风险较小。7篇文献结局数据完整,随访及报告的偏倚均较小。敏感性分析提示本Meta分析结果稳定、可靠。
anti-D免疫球蛋白的主要机制是通过致敏的红细胞竞争性抑制和阻断脾内单核-巨噬细胞的Fc受体,从而阻断抗体致敏的PLT在脾脏内被吞噬,同时还具有免疫调节作用[2, 13]。本Meta分析结果显示,在治疗24 h后PLT > 20×109/L的患儿百分比anti-D组与IVIG组比较差异无统计学意义,但治疗72 h、7 d后IVIG组优于anti-D组。在治疗24 h后两组疗效相当,考虑与药物尚未完全起效有一定关系;治疗72 h及7 d后IVIG组优于anti-D组的结论显示anti-D在PLT上升的反应速度方面略差于IVIG。
对于anti-D组和IVIG组比较治疗24 h、72 h及7 d后PLT计数方面,本Meta分析分别将anti-D 50 μg/kg、anti-D 75 μg/kg与IVIG组进行比较,Meta分析结果显示,anti-D 50 μg/kg组与IVIG组比较治疗效果相当;anti-D 75 μg/kg组与IVIG组比较,在治疗72 h后IVIG组优于anti-D 75 μg/kg组,但治疗7 d后两组效果相当。总体来说,对于治疗后PLT计数方面,本Meta分析结果显示anti-D与IVIG治疗效果相当。
对不同剂量anti-D的治疗效果进行比较,本文纳入的文献anti-D使用剂量为厂家推荐的使用剂量(50 μg/kg或75 μg/kg),因此相关研究选择将50 μg/kg与anti-D 75 μg/kg两种剂量进行比较。将两组治疗后PLT计数进行比较,本Meta分析纳入2篇文献,结果显示治疗24 h及7 d后两组PLT计数差异无统计学意义,提示两种剂量治疗效果相当。
anti-D治疗的主要不良反应为可导致血红蛋白下降,本Meta分析结果显示anti-D治疗导致血红蛋白下降数值高于IVIG,考虑主要与anti-D的作用机制有关,但所纳入文献在使用推荐剂量时均未报道有严重贫血或溶血的发生,不需要输血治疗。有1篇文献[10]提到有3例患者使用anti-D(100 μg/kg)时发生溶血。其余常见的不良反应主要为发热、寒战、头痛、恶心、呕吐,多在用药初期出现,使用对乙酰氨基酚或抗组织胺药后可缓解。因此认为,使用推荐剂量的anti-D是安全的。
本Meta分析的局限性包括:(1)未能获取未发表的文献,因而不能排除潜在的发表偏倚;(2)只纳入英文和中文文献,可能存在语种偏倚;(3)仅1篇文献为盲法试验;(4)样本量不大;(5)纳入文献数 < 10篇,未能行漏斗图分析,存在潜在发表偏倚的风险。
综上所述,静脉注射anti-D治疗儿童急性ITP在提高PLT计数方面效果可能与IVIG相同,但在治疗后PLT上升的反应速度方面的效果可能略差于IVIG。使用剂量为50 μg/kg或75 μg/kg的anti-D疗效可能相当,患儿对anti-D不良反应的耐受性良好,但仍需要大样本、高质量的RCT研究进一步证实。
| [1] |
SahBK, 谢晓恬. 儿童免疫性血小板减少症发病机制与诊治研究进展[J]. 中国小儿血液与肿瘤杂志, 2017, 22(1): 51-54. (  0) 0) |
| [2] |
Cheung E, Liebman HA. Anti-RhD immunoglobulin in the treatment of immune thrombocytopenia[J]. Biologics, 2009, 3: 57-62. (  0) 0) |
| [3] |
Neunert C, Lim W, Crowther M, et al. The American Society of Hematology 2011 evidence-based practice guideline for immune thrombocytopenia[J]. Blood, 2011, 117(16): 4190-4207. DOI:10.1182/blood-2010-08-302984 (  0) 0) |
| [4] |
泥永安, 刘壮, 廖必才. 抗-D免疫球蛋白与大剂量静脉丙种球蛋白治疗儿童急性特发性血小板减少性紫癜的meta分析[J]. 临床儿科杂志, 2013, 31(8): 768-773. (  0) 0) |
| [5] |
Son DW, Jeon IS, Yang SW, et al. A single dose of anti-D immunoglobulin raises platelet count as efficiently as intravenous immunoglobulin in newly diagnosed immune thrombocytopenic purpura in Korean children[J]. J Pediatr Hematol Oncol, 2008, 30(8): 598-601. DOI:10.1097/MPH.0b013e31817541ba (  0) 0) |
| [6] |
Shahgholi E, Vosough P, Sotoudeh K, et al. Intravenous immune globulin versus intravenous anti-D immune globulin for the treatment of acute immune thrombocytopenic purpura[J]. Indian J Pediatr, 2008, 75(12): 1231-1235. DOI:10.1007/s12098-008-0243-y (  0) 0) |
| [7] |
Papagianni A, Economou M, Tragiannidis A, et al. Standard-dose intravenous anti-D immunoglobulin versus intravenous immunoglobulin in the treatment of newly diagnosed childhood primary immune thrombocytopenia[J]. Pediatr Hematol Oncol, 2011, 33(4): 265-269. DOI:10.1097/MPH.0b013e31820e2aa5 (  0) 0) |
| [8] |
Celik M, Bulbul A, Aydogan G, et al. Comparison of anti-D immunoglobulin, methylprednisolone, or intravenous immunoglobulin therapy in newly diagnosed pediatric immune thrombocytopenic purpura[J]. J Thromb Thrombolysis, 2013, 35(2): 228-233. DOI:10.1007/s11239-012-0801-z (  0) 0) |
| [9] |
Alioglu B, Ercan S, Tapci AE, et al. A comparison of intravenous immunoglobulin(2 g/kg totally) and single doses of anti-D immunoglobulin at 50 μg/kg, 75 μg/kg in newly diagnosed children with idiopathic thrombocytopenic purpura:Ankara hospital experience[J]. Blood Coagul Fibrinolysis, 2013, 24(5): 505-509. DOI:10.1097/MBC.0b013e32835e5337 (  0) 0) |
| [10] |
Tarantino MD, Young G, Bertolone SJ, et al. Single dose of anti-D immune globulin at 75 microg/kg is as effective as intravenous immune globulin at rapidly raising the platelet count in newly diagnosed immune thrombocytopenic purpura in children[J]. J Pediatr, 2006, 148(4): 489-494. DOI:10.1016/j.jpeds.2005.11.019 (  0) 0) |
| [11] |
Blanchette V, Imbach P, Andrew M, et al. Randomised trial of intravenous immunoglobulin G, intravenous anti-D, and oral prednisone in childhood acute immune thrombocytopenic purpura[J]. Lancet, 1994, 344(8924): 703-707. DOI:10.1016/S0140-6736(94)92205-5 (  0) 0) |
| [12] |
Swain TR, Jena RK, Swain KP. High dose intravenous anti-D immune globulin is more effective and safe in Indian paediatric patients of immune thrombocytopenic purpura[J]. J Clin Diagn Res, 2016, 10(12): FC12-FC15. (  0) 0) |
| [13] |
Cooper N. Intravenous immunoglobulin and anti-RhD therapy in the management of immune thrombocytopenia[J]. Hematol Oncol Clin North Am, 2009, 23(6): 1317-1327. DOI:10.1016/j.hoc.2009.09.002 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19

