关节挛缩、肾功能不全和胆汁淤积(arthrogryposis, renal dysfunction, and cholestasis, ARC)综合征是一种常染色体隐性遗传病,以关节挛缩、肾功能不全和胆汁淤积为主要表现,部分患者存在鱼鳞癣、血小板形态和功能异常及继发性感染等其它表现;涉及到多个系统,预后不良,绝大部分患者存活不到1年[1-2]。该病在1973年首次被报道,患者为一对近亲结婚夫妻的子代[3]。经过40多年研究,目前已知VPS33B和VIPAS39基因突变均可导致ARC综合征,而国外文献报道的以上两个基因的突变类型达到299种及34种[1]。2014年,国内曾报道2例ARC综合征患儿[4-5],但迄今有关本病的中文文献仅有会议摘要和综述各1篇[6-7]。因此,从总体上讲,ARC综合征的诊断和治疗经验仍有待积累。本研究报道1例经基因分析确诊的ARC综合征,为后续研究提供参考。
1 资料与方法 1.1 研究对象患儿,女,47 d,因皮肤巩膜黄染45 d、肝功异常39 d入院。患儿生后第3天出现皮肤巩膜黄染,并进行性加重,伴大便淡黄色,尿色深。生后第8天在当地医院查肝功能(表 1):总胆红素(Tbil)、结合胆红素(Dbil)、非结合胆红素(Ibil)均增高,以非结合胆红素增高为主,余项正常,予熊去氧胆酸等治疗,但皮肤及巩膜黄染仍持续不退。于生后1个月行腹部彩超:胆囊内壁稍毛糙。至生后40余天,多次肝功能检查(表 1)发现Tbil、Dbil、总胆汁酸(TBA)仍明显升高,丙氨酸氨基转移酶(ALT)及门冬氨酸氨基转移酶(AST)轻度升高,GGT大致正常;尿常规:尿红细胞++++,白细胞+,尿蛋白+,尿胆红素++,尿糖+/-,尿比重1.005;粪便常规、凝血功能无异常,弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒Ⅰ型和Ⅱ型抗体以及甲肝病毒抗体测定均阴性;头颅MRI未见明显异常。诊断考虑胆汁淤积症,继续予熊去氧胆酸利胆、维生素E抗氧化等治疗10余天,黄疸及肝功能异常等无明显改善,为明确病因收入院。患儿自起病以来,精神、食欲差,大便浅黄,小便深黄。
| 表 1 患儿历次生化检查结果 |
|
|
患儿系第一胎第一产,出生胎龄40周,顺产出生,出生体重3 300 g,身长50 cm。出生时无窒息史。父母体健,非近亲结婚,否认遗传病家族史。
入院体查:体重3.1 kg( < -2 SD),身长48 cm( < -2 SD),头围35.5 cm( < -2 SD)。精神萎靡。全身皮肤黄染且干燥,伴四肢和躯干部脱皮,未见肝掌及蜘蛛痣,皮下脂肪消失。前囟平软、1.5 cm×2.0 cm。巩膜明显黄染,双侧瞳孔等大等圆、直径2.5 mm,对光反射灵敏。双肺呼吸音清晰,未闻及干湿啰音。心音有力,心率125次/min,各瓣膜听诊区未闻及病理性杂音。腹部膨隆,肝右肋下2 cm,质软,边缘锐利,脾左肋下未及。双侧髋关节及膝关节屈曲,伸展受限。四肢肌张力低,腹壁和膝腱反射可引出,克、布氏征均阴性。
辅助检查:血常规白细胞14.35×109/L(参考值11~12×109/L),嗜中性粒细胞23.2%、淋巴细胞61.4%,红细胞2.23×1012/L(参考值4.0~4.3×1012/L),血红蛋白67 g/L(参考值110~120 g/L),余项正常。生化检查(表 1)示ALT及AST轻度升高,Tbil、Dbil、TBA升高明显,但GGT及胆固醇水平正常,ALB及25-羟基维生素D减低。
1.2 二代测序技术分析代谢性肝病相关基因本研究经暨南大学附属第一医院医学伦理委员会批准,并获得患儿父母知情同意。取患儿静脉血2 mL(EDTA抗凝),按照Blood DNA Mini kit试剂盒(Simgen公司,中国)说明书提取基因组DNA,建立含有与代谢性肝病相关基因(ACADVL、B4GALT1、C10orf2、DBT、EARS2、FADD、SLC25A13、VIPAS39及VPS33B等共233个基因)的基因组文库。上述目标基因均用液相捕获试剂盒(迈基诺公司,中国)捕获,通过新一代测序(next generation sequencing,NGS)仪IlluminaHiSeq2000(Illumina公司,美国)完成高通量测序,测序平均深度不小于200。根据所得数据,进行基因序列生物信息学分析,找出致病基因突变。
1.3 Sanger测序验证突变根据二代测序检测所得结果,对患儿及其父母DNA标本进行VPS33B突变基因Sanger测序分析。所用引物核苷酸序列(5'→3')为:上游引物GGACTCACTGGAAGCCTTGTC,下游引物GAAATGTGACAGTCTGGCTGC。根据VPS33B基因序列使用PrimerPremier5.0软件进行引物设计(北京迈基诺基因科技股份有限公司合成)。聚合酶链反应体系为:2×Goldstar Buffer Mix 10 μL,上游引物和下游引物各1.5 μL,DNA 1 μL,灭菌双蒸水6 μL,共20 μL。反应条件为:95℃预变性10 min;随后分为3步,第一步94℃变性30 s,64℃退火30 s,72℃延伸45 s,共反应3个循环;第二步94℃变性30 s,62℃退火30 s,72℃延伸45 s,共反应5个循环;第三步94℃变性30s,60℃退火30 s,72℃延伸45 s,共反应25个循环;最后再72℃延伸5 min。聚合酶链反应产物经琼脂糖凝胶电泳切胶纯化,纯化后的PCR产物送英潍捷基(上海)贸易有限公司测序。应用Chromas软件对测序结果进行分析,并应用DNAMAN软件与基因组VPS33B参考序列进行比对(Ensemble Genome Browser: ENSG00000184056)。
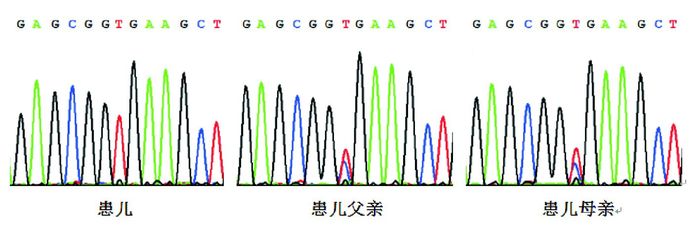
2 结果 2.1 遗传学分析结果NGS分析代谢性肝病相关基因未发现进行性家族性肝内胆汁淤积症1型(ATP8B1基因)、原发性胆汁酸合成或结合缺陷(HSD3B7、SLC27A5和CYP7B1等基因)等GGT水平正常的遗传性胆汁淤积性肝病致病基因的任何突变,亦未发现胆汁淤积性肝病常见病因Citrin缺陷病相关基因SLC25A13的致病性突变[8]。但患儿的VPS33B基因检测到1个纯合突变(图 1),该突变是位于外显子21的无义突变c.1594C > T(p.R532X)。经Sanger测序验证,确认该患儿为该突变的纯合子,而其父母均为携带者,见图 2。

|
图 1 患儿VPS33B基因突变的NGS分析结果 VPS33B基因互补链c. 1594位点的鸟嘌呤G全部突变为腺嘌呤A(如箭头所指)。 |
|
图 2 患儿及其父母VPS33B基因Sanger测序验证结果 患儿VPS33B基因为c. 1594 C > T纯合突变,其父母均为该突变携带者,突变位点如箭头所示。 |
入院后更换无乳糖强化中链脂肪酸奶粉喂养,予熊去氧胆酸、还原型谷胱甘肽利胆护肝,输注浓缩红细胞纠正贫血,补充维生素D和钙剂,以及抗感染(入院后出现反复低热)等对症治疗,治疗13 d后,皮肤黄染稍有减轻、感染控制,家属要求出院。出院2个月后因病情进行性加重死亡。
3 讨论近年来NGS以其高通量、成本低及敏感性高等优点,临床应用逐渐广泛。尤其对于临床表现相似但遗传学病因不同的遗传性疾病,靶向Panel高通量测序成本更低、覆盖面较广且数据分析速度更快,在遗传学病因识别方面具有良好的应用前景[9]。本例患儿胆汁淤积表现典型,借助NGS分析技术,发现该患儿为VPS33B无义突变纯合子,经Sanger测序验证,其父母均为该突变基因携带者,最终确诊ARC综合征。
VPS33B基因位于染色体15q26.1,全长23.9 kb,包含23个外显子,编码的VPS33B蛋白主要参与细胞内蛋白的运输[10-11]。可溶性N-乙基马来酰亚胺敏感因子附着蛋白受体复合物(soluble NSF attachment protein receptors, SNAREs)是由4个SNARE蛋白组成的复合体,其中3个SNARE蛋白主要锚定在靶膜上,如内质网、细胞膜;而第4个SNARE蛋白主要锚定在囊泡上,不同蛋白相互识别及连接,促使囊泡与靶膜靠近,在囊泡融合中起核心作用[10, 12-14]。VPS33B蛋白主要表达于胞质,通过其Sec1-样球形结构域与SNAREs结合,介导囊泡与细胞器膜及细胞膜之间的锚定、融合等过程,从而影响囊泡的转运功能,在细胞吞吐过程中发挥重要作用[10-11, 13-15]。VPS33B基因在胎儿及成人的骨骼、肾脏、肝脏及皮肤等均有表达,因此ARC综合征患者的运动单位、肾小管、肝小叶及上皮细胞等结构和功能均受损,出现关节挛缩、氨基酸尿和糖尿、胆汁淤积及鱼鳞癣等多系统受累表现[10-11, 15-16]。本文患儿主要表现为胆汁淤积性黄疸,双下肢髋关节及膝关节伸展受限,并伴四肢、躯干部片状脱屑、肾小管功能受损(氨基酸尿伴糖尿),符合ARC综合征的临床特点。
VPS33B蛋白的Sec1-样结构域由第31~611位氨基酸构成,可与SNAREs紧密结合,参与囊泡与细胞器及细胞膜之间的锚定[10-11, 13, 17-18]。本例患儿的VPS33B基因突变是国外文献已报道的致病性突变类型,可导致VPS33B蛋白第532位编码精氨酸的密码子改变为终止密码子,使翻译提前终止,蛋白截短,Sec1-样结构域的完整性受到影响,从而影响到细胞内囊泡运输及细胞膜的融合,最终出现典型ARC表现[10]。
本例患儿多次生化检查示ALT及AST轻度升高,Tbil、Dbil、TBA升高明显,但GGT正常。生理状态下,GGT在肝细胞内合成,通过糖化磷脂酰肌醇锚定于肝脏胆小管膜的管腔侧,并依靠胆汁中胆汁酸盐的洗刷作用从胆管细胞洗脱,作为胆汁成分之一排入肠腔[10, 19]。而ARC综合征患儿,由于囊泡功能不全,胆汁分泌受阻,低浓度的胆汁酸盐对GGT的洗脱作用微弱,故患儿血浆GGT水平可正常[19-20]。虽有文献[5]报道ARC综合征的患儿可能存在高GGT水平,但目前认为,正常水平GGT可作为诊断ARC综合征的4个临床特点之一(关节挛缩、肾小管功能不全、胆汁淤积及正常水平GGT)[15, 21]。
ARC综合征作为一种预后不良的常染色体隐性遗传病,绝大部分患儿因严重营养不良、反复感染、严重酸中毒、肝衰竭及凝血异常而死亡[15, 22-23]。本文患儿诊治结局不良,符合这一特点。本病内科治疗效果虽有限,但熊去氧胆酸、还原型谷胱甘肽及利福平等可能轻微缓解胆汁淤积及瘙痒症状[11]。针对部分患者的关节挛缩、髋关节脱位等畸形,手术矫正可恢复部分关节功能[24];但由于ARC综合征患儿免疫功能差及远期生存率低,除非严重病理性骨折或感染,不建议积极骨科手术治疗[25]。Dehghani等[26]报道1例进行了肝移植的ARC综合征患儿,随访5年,皮肤瘙痒及鱼鳞癣等症状明显改善,预后良好。但肝移植术后出血及感染的风险极大,疗效存在争议。
综上所述,本研究系统总结了1例经基因分析确诊的ARC综合征患儿的临床特点及遗传学特征,对于今后本病的分子诊断、临床管理及遗传咨询具有一定参考价值。
| [1] |
Zhou Y, Zhang J. Arthrogryposis-renal dysfunction-cholestasis (ARC) syndrome:from molecular genetics to clinical features[J]. Ital J Pediatr, 2014, 40: 77. DOI:10.1186/s13052-014-0077-3 (  0) 0) |
| [2] |
Abdullah MA, Al-Hasnan Z, Okamoto E, et al. Arthrogryposis, renal dysfunctionand cholestasis syndrome[J]. Saudi Med J, 2000, 21(3): 297-299. (  0) 0) |
| [3] |
Bretscher-Dutoit C. Familial bile duct malformations associated with tubular renal insufficiency:A.R. Lutz-Richner and R. F. Landolt. Helv. Paediatr. Acta 28:1-12 (March), 1973[J]. J Pediatr Surg, 1974, 9(4): 577. (  0) 0) |
| [4] |
Li LT, Zhao J, Chen R, et al. Two novel VPS33B mutations in a patient with arthrogryposis, renal dysfunction and cholestasis syndrome in mainland China[J]. World J Gastroenterol, 2014, 20(1): 326-329. DOI:10.3748/wjg.v20.i1.326 (  0) 0) |
| [5] |
Wang JS, Zhao J, Li LT., et al. ARC syndrome with high GGT cholestasis caused by VPS33B mutations[J]. World J Gastroenterol, 2014, 20(16): 4830-4834. DOI:10.3748/wjg.v20.i16.4830 (  0) 0) |
| [6] |
蓝天, 周瑶瑶. 关节弯曲-肾小管功能不全-新生儿胆汁淤积综合征的临床特点及分子遗传学进展[J]. 中华儿科杂志, 2014, 52(1): 69-71. (  0) 0) |
| [7] |
李丽婷, 赵静, 陈瑞, 等. ARC综合征病例报告[C]. 全国儿科感染性疾病学术会议, 黄山, 2012: 89-90.
(  0) 0) |
| [8] |
Song YZ, Zhang ZH, Lin WX, et al. SLC25A13 gene analysis in citrin deficiency:sixteen novel mutations in East Asian patients, and the mutation distribution in a large pediatric cohort in China[J]. PLoS One, 2013, 8(9): e74544. DOI:10.1371/journal.pone.0074544 (  0) 0) |
| [9] |
Rehm HL. Disease-targeted sequencing:a cornerstone in the clinic[J]. Nat Rev Genet, 2013, 14(4): 295-300. DOI:10.1038/nrg3463 (  0) 0) |
| [10] |
Gissen P, Johnson CA, Morgan NV, et al. Mutations in VPS33B gene, encoding a regulator of SNARE-dependant membrane fusion, cause ARC syndrome[J]. Nat Genet, 2004, 36(4): 400-404. DOI:10.1038/ng1325 (  0) 0) |
| [11] |
Smith H, Galmes R, Gogolina E, et al. Associations among genotype, clinical phenotype, and intracellular localization of trafficking proteins in ARC syndrome[J]. Hum Mutat, 2012, 33(12): 1656-1664. DOI:10.1002/humu.22155 (  0) 0) |
| [12] |
柳忠玉, 黄亚东, 庄楚雄. 参与植物膜泡运输的蛋白质家族及功能研究进展[J]. 中国细胞生物学学报, 2006, 28(3): 447-452. (  0) 0) |
| [13] |
陈立强, 王洋洋, 司艳辉, 等. SNAREs蛋白复合物与囊泡融合分子调节机制的研究进展[J]. 检验医学与临床, 2015, 12(10): 1462-1463. DOI:10.3969/j.issn.1672-9455.2015.10.057 (  0) 0) |
| [14] |
刘毅华, 高向东, 徐晨. 囊泡转运蛋白SM蛋白家族的研究进展[J]. 现代生物医学进展, 2013, 13(28): 5595-5600. (  0) 0) |
| [15] |
Gissen P, Tee L, Johnson CA, et al. Clinical and molecular genetic features of ARC syndrome[J]. Hum Genet, 2006, 120(3): 396-409. DOI:10.1007/s00439-006-0232-z (  0) 0) |
| [16] |
Choi HJ, Lee MW, Ghoi JH, et al. Ichthyosis associated with ARC syndrome:ARC syndrome is one of the differential diagnoses of ichthyosis[J]. Pediatr Dermatol, 2005, 22(6): 539-542. DOI:10.1111/pde.2005.22.issue-6 (  0) 0) |
| [17] |
Gissen P, Johnson CA, Gentle D, et al. Comparative evolutionary analysis of VPS33 homologues:genetic and functional insights[J]. Hum Mol Genet, 2005, 14(10): 1261-1270. DOI:10.1093/hmg/ddi137 (  0) 0) |
| [18] |
Rizo J, Südhof TC. The membrane fusion enigma:SNAREs, Sec1/Munc18 proteins, and their accomplices——guilty as charged?[J]. Annu Rev Cell Dev Biol, 2012, 28(28): 279-308. (  0) 0) |
| [19] |
van Mil SW, Houwen RH, Klomp LW. Genetics of familial intrahepatic cholestasis syndromes[J]. J Med Genet, 2005, 42(6): 449-463. DOI:10.1136/jmg.2004.026187 (  0) 0) |
| [20] |
Eastham KM, McKiernan PJ, Milford DV, et al. ARC syndrome:an expanding range of phenotypes[J]. Arch Dis Child, 2001, 85(5): 415-420. DOI:10.1136/adc.85.5.415 (  0) 0) |
| [21] |
Bull LN, Mahmoodi V, Baker AJ, et al. VPS33B mutation with ichthyosis, cholestasis, and renal dysfunction but without arthrogryposis:Incomplete ARC syndrome phenotype[J]. J Pediatr, 2006, 148(2): 269-271. DOI:10.1016/j.jpeds.2005.10.005 (  0) 0) |
| [22] |
Xiang B, Zhang G, Ye S, et al. Characterization of a novel integrin binding protein, VPS33B, which is important for platelet activation and in vivo thrombosis and hemostasis[J]. Circulation, 2015, 132(24): 2334-2344. DOI:10.1161/CIRCULATIONAHA.115.018361 (  0) 0) |
| [23] |
Saadah OI, Bokhari BE, Alshaeri TM, et al. Haematological manifestations of arthrogryposis-renal dysfunction-cholestasis (ARC) syndrome:A case report[J]. Arab J Gastroenterol, 2013, 14(1): 26-28. DOI:10.1016/j.ajg.2013.01.001 (  0) 0) |
| [24] |
Jang WY, Cho TJ, Bae JY, et al. Orthopaedic manifestations of arthrogryposis-renal dysfunction-cholestasis syndrome[J]. J Pediatr Orthop, 2011, 31(1): 107-112. DOI:10.1097/BPO.0b013e3182032c83 (  0) 0) |
| [25] |
Seo SH, Hwang SM, Ko JM, et al. Identification of novel mutations in the VPS33B gene involved in arthrogryposis, renal dysfunction, and cholestasis syndrome[J]. Clin Genet, 2015, 88(1): 80-84. DOI:10.1111/cge.2015.88.issue-1 (  0) 0) |
| [26] |
Dehghani SM, Bahador A, Nikeghbalian S, et al. Liver transplant in a case of arthrogryposis-renal tubular dysfunction-cholestasis syndrome with severe intractable pruritus[J]. Exp Clin Transplant, 2013, 11(3): 290-292. DOI:10.6002/ect (  0) 0) |
 2017, Vol. 19
2017, Vol. 19


