2. 浙江大学医学院附属儿童医院 神经内科, 浙江 杭州 310051;
3. 浙江大学医学院附属儿童医院 遗传代谢科, 浙江 杭州 310051
非酮性高甘氨酸血症(nonketotic hyperglycinemia, NKH, OMIM #605899)是一组常染色体隐性遗传的代谢性疾病,又称甘氨酸脑病,发病率估计为1 : 76 000[1]。本病是由甘氨酸裂解系统活性缺乏所致的甘氨酸代谢障碍,大量甘氨酸在尿液、血清和脑脊液沉积,并通过N甲基-D-天冬氨酸(NMDA)受体过度刺激引发神经损伤[2]。甘氨酸裂解系统是4个组分构成的多酶复合物:P-蛋白(吡哆醛磷酸依赖性甘氨酸脱羧酶),H-蛋白(硫辛酸蛋白),T-蛋白(四氢叶酸依赖氨基甲基转移酶)和L-蛋白(脂酰胺脱氢酶),分别由GLDC、GCSH、AMT和GCSL基因编码。遗传学研究证实NKH主要为甘氨酸裂解系统的相关基因GLDC、GCSH或AMT突变所致,有少量研究认为也可由GLRX5、BOLA3、LIAS基因缺陷引起[3]。NKH最常见的表型为新生儿NKH,表现为出生后嗜睡、肌张力低下、肌阵挛性癫癎发作、呼吸暂停,大部分1岁以内死亡。但该疾病也存在一系列表型变异,即非经典型NKH,表现为精神运动发育迟缓、癫癎发作、共济失调、舞蹈病、语言发育落后、行为问题和热诱发的肌张力低下、精神行为异常,血清和脑脊液甘氨酸浓度升高不如新生儿NKH明显[4-5]。目前国内仅有两篇新生儿NKH报道[6-7],非经典型NKH未见报道。本研究报道一个家系中一对兄妹因GLDC复合杂合突变所致的非经典型NKH,并将相关突变转染到H293T细胞后进行蛋白表达和酶活性测定。
1 资料与方法 1.1 研究对象病例1,男,6岁8个月,反复抽搐5年余就诊。9月龄起抽搐反复发作,表现为双眼凝视、呼之不应、牙关紧闭、口周发绀、肢体强直抽动,持续2~3 min不等,有时表现为肢体触电样快速抖动,每天发作10余次。诊断考虑癫癎,予以丙戊酸钠治疗,3天后患儿出现意识不清、肌张力降低,改用卡马西平、左乙拉西坦、氯硝西泮联合治疗,半年后患儿抽搐频率减少为数月1次。目前患儿不能独坐、独走,不会说话, 不会笑,不会主动抓物。患儿系第一胎第一产,足月顺产出生,出生时无窒息史。父母体健,家族中否认类似病史。体格检查:体重14 kg,头围49 cm,发育落后,营养差,神志清,反应迟钝,心、肺、腹部查体无异常,四肢肌肉萎缩、肌力4级、肌张力增高,双膝腱、跟腱反射亢进,病理反射未引出,脑膜刺激征阴性。辅助检查:尿、便常规,肝肾功能、血氨、乳酸以及脑脊液常规、生化均正常,干血斑串联质谱法分析提示氨基酸和酰基肉碱正常,头颅磁共振正常,脑电图显示广泛性癎样放电。
病例2,女,3岁5个月,病例1的妹妹。因精神行为异常、行走不稳1年余就诊。2岁时“急性上呼吸道感染”后出现烦躁不安、攻击行为、共济失调步态、四肢舞蹈样动作,以及发作性双眼斜视、上肢舞动。经抗感染及对症治疗后,患儿体温恢复正常,精神、行为异常好转。3岁1个月“急性上呼吸道感染”后再次出现烦躁不安、攻击行为,对症治疗后好转。目前患儿能独立行走,但步态不协调,可以理解简单语句,只能叫“爸爸、妈妈”。患儿系第二胎、第二产,足月顺产出生;3个月抬头,6个月独坐,17个月独立行走,3岁会叫“爸爸、妈妈”。体格检查:体重13.5 kg,头围49 cm,发育落后,营养中等,神志清,反应可,心、肺、腹部查体无异常,四肢肌力正常、肌张力偏低,直线行走不能,双膝腱、跟腱反射正常,病理反射未引出,脑膜刺激征阴性。辅助检查:血常规示淋巴细胞比例升高、余项正常;咽拭子副流感病毒阳性;血氨、血乳酸正常,尿粪常规、肝肾功能、脑脊液常规、生化均正常;干血斑串联质谱法分析提示氨基酸和酰基肉碱正常;头颅和胸腰髓磁共振正常;肌电图正常;心电图:窦性心律、室性早搏;动态心电图:窦性心动过速,频发室早,夜间出现一次2.4s的全心停搏;心脏彩超示三尖瓣轻度反流;脑电图显示广泛性、间断性、节律性δ活动。
1.2 分子遗传学分析取病例1外周血5 mL(EDTA抗凝),选择癫癎相关308个基因进行高通量测序(北京迈基诺公司),测序数据予以RTA软件(real-time analysis, Illumina)分析,CASAVAv1.8.2(Illumina)、BWA、GAT软件评估测序质量,获得单核苷酸变异(SNV)报告。再使用ANNOVAR、SIFT、PolyPhen-2.2.2、HGMD数据库、dbSNP数据库和1000基因组数据库进行变异注释和分析,以确认候选病原突变检测结果。对患儿突变区域进行Sanger测序验证,确定致病位点。并采集病例2及其父母的外周血5 mL(EDTA抗凝)进行Sanger测序验证。
本研究获得患儿父母知情同意。
1.3 甘氨酸浓度检测采集病例1血液、尿液、脑脊液各5 mL,及病例2的血液、脑脊液5 mL(尿液标本未能收集到),使用日立全自动氨基酸分析仪L8900及液相色谱法检测甘氨酸浓度(由杭州博圣生物技术公司检测)。
1.4 蛋白免疫印迹检测GLDC蛋白培养H293T细胞,分别转染pMCV、pMCV-GLDC,以及S419X突变或C1002W突变的pMCV-GLDC质粒,48 h后收集细胞、提取蛋白。30 μg蛋白上样,先恒压80V电泳至溴酚蓝指示剂在浓缩胶与分离胶交界处成线状,改为恒压120V至溴酚兰到凝胶底部。转膜、封闭,GLDC兔多抗(英国Abcam)4℃过夜,鼠抗兔二抗(北京中杉金桥生物技术有限公司)室温2 h反应后显影。上述实验重复3次。
1.5 酶联免疫吸附实验检测GLDC酶活性采用ELISA试剂盒(上海酶联生物)检测GLDC酶活性,取0.1 mL细胞上清液于反应孔中,按照试剂盒说明书进行操作,用酶标仪测定每孔在450 nm处的OD值。实验重复3次,每次检测3个复孔。
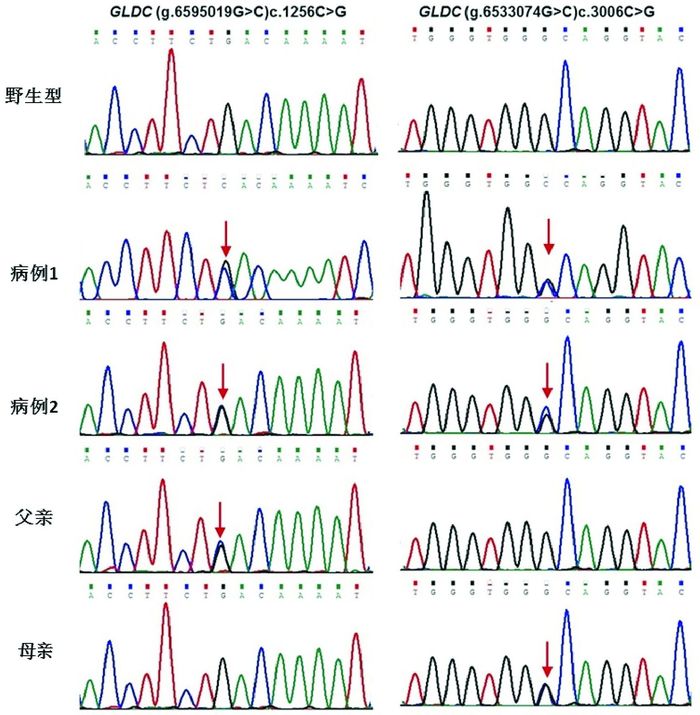
2 结果 2.1 患儿及父母GLDC基因测序结果2例患儿在GLDC基因均发现突变:c.3006C > G(p.Cys1002Trp)和c.1256C > G(p.Ser419STer),均为新发突变,其中突变c.3006C > G(p.Cys1002Trp)来自母亲,突变c.1256C > G(p.Ser419STer)来自父亲,见图 1。查询致病数据库(OMIM、HGMD、Clinvar等),p.Ser419STer为无义突变,419位的丝氨酸变为终止密码子,蛋白合成提前终止,具有高致病性。p.Cys1002Trp为错义突变,PolyPhen2.2.2预测评分为1、SIFT评分为0,提示有致病性。在线生物信息软件Clustal Omega(http://www.ebi.ac.uk/Tools/msa/clustalo/)查询提示c.3006C > G(p.Cys1002Trp)在不同物种间高度保守;c.1256C > G(p.Ser419STer)在不同物种间保守度为4/7,但该突变造成蛋白合成提前终止。
|
图 1 患儿GLDC基因测序结果及其家系验证 病例1、2检测到GLDC基因c.3006C > G(p.Cys1002Trp)和c.1256C > G(p.Ser419STer)复合杂合突变,父亲检测到GLDC基因c.1256C > G突变,母亲检测到GLDC基因c.3006C > G突变,突变位点如箭头所示。 |
病例1的尿液甘氨酸浓度与肌酐的比值为1 154 μmol/mmol(参考值:64~236 μmol/mmol),血清甘氨酸浓度为751 μmol/L(参考值:0~276 μmol/L),脑脊液甘氨酸为45.3 μmol/L(参考值:1.6~19.5 μmol/L),脑脊液/血清甘氨酸之比为0.06(参考值:≤0.02)。病例2的血清甘氨酸浓度正常,脑脊液甘氨酸浓度增高(36.7 μmol/L),脑脊液/血清甘氨酸之比增高(0.13)。
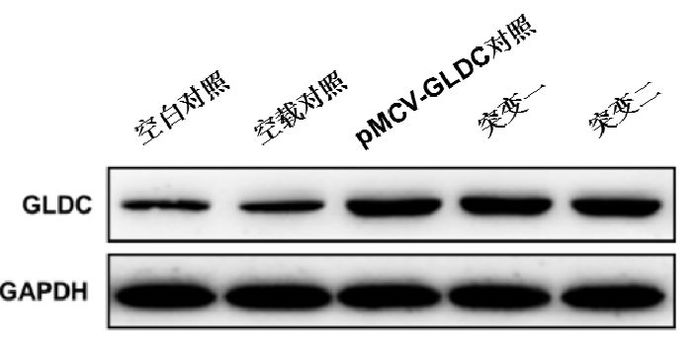
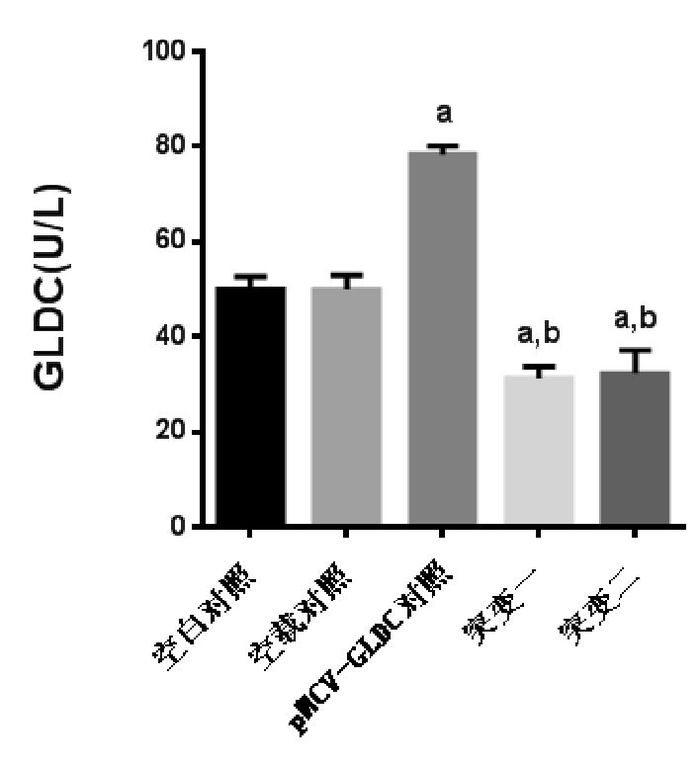
2.3 GLDC蛋白表达及酶的活性与空白对照和空载对照相比,突变一组(S419X突变)和突变二组(C1002W突变)的GLDC蛋白表达增高,酶活性降低;与pMCV-GLDC对照组相比,突变一组、突变二组的GLDC蛋白表达无明显变化,GLDC酶活性下降(P < 0.01),但突变一组和突变二组GLDC酶活性的差异无统计学意义(P > 0.05),见图 2、3。
|
图 2 GLDC蛋白的检测 突变一和突变二的GLDC蛋白表达高于空白对照和空载对照;与pMCV-GLDC对照相比,无明显变化。 |
|
图 3 GLDC酶活性的ELISA测定 a示与空白对照组及空载对照相比,P < 0.01;b示与pMCV-GLDC对照相比,P < 0.01。 |
根据发病年龄NKH可分为新生儿型、婴儿型和迟发型。经典型NKH即新生儿型NKH,非经典型NKH包括婴儿型NKH、迟发型NKH和具有较好精神运动发育的新生儿型NKH[5]。非经典型NKH可因症状不典型,血清和脑脊液甘氨酸浓度升高不显著导致诊治延误[8]。Brenton等[4]提到尿甘氨酸浓度与肌酐的比值增高对于晚发型NKH的诊断非常重要。本研究病例1的尿甘氨酸/肌酐比值明显升高,与文献相符,遗憾的是未获得其妹妹的尿液样本。Ezgu等[9]在一个4月龄的顽固性癫癎患儿使用第二代高通量测序寻找病因,诊断速度早于其他方法。本研究2例患者均非新生儿期起病,脑脊液/血清甘氨酸之比均增高,最终通过目标基因捕获高通量测序确诊为非经典型NKH。
578个已报道的经典型NKH家系中,遗传分析确定了410个相关突变,约80%的甘氨酸脑病由GLDC基因突变引起,错义突变占了GLDC突变类型的52%,15%的患者有减毒表型[1]。晚发型NKH患儿中,大部分情况下甘氨酸裂解系统维持正常的功能,但感染可导致甘氨酸裂解系统活性进一步降低,引起共济失调、舞蹈病样动作、精神问题等非特异性脑病表现[4]。本组2例患儿,父源c.1256C > G(p.S419X)无义突变导致第419氨基酸位置上丝氨酸突变为终止密码子,改变了蛋白结构,为致病突变;母源c.3006C > G(p.C1002W)错义突变,第1002氨基酸位置上半胱氨酸变为色氨酸,蛋白预测软件分析为致病突变。本研究兄妹基因型相同,而表型并不完全一样。Korman等[10]报道GLDC基因A802V(c.2405C > T)突变的两个家系,两个家系的父母均为表型正常的基因携带者,家系A的三姐妹均为纯合突变,其中2人新生儿期出现NKH症状、1人无症状;家系B中3个含纯合突变的孩子均为严重的新生儿型NKH,2人死亡,1人遗留严重神经系统后遗症,进一步用A802V突变的GLDC基因转染COS7细胞,其甘氨酸脱羧酶活性降低至32%。Swanson等[11]也发现含有相同GLDC复合杂合突变(p.A389V/p.R515S)的两个患儿具有较大差异的临床表型。基因型相同,而临床表型不同,可能与部分突变并未导致甘氨酸脱羧酶完全失活有关,而其他遗传或非致病因子对甘氨酸脱羧酶活性可能也有影响[11]。本研究将两种突变的pMCV-GLDC转染到H293T细胞,其甘氨酸脱羧酶活性下调至野生型的39.9%和41.2%,与Korman等[10]的报道类似。
目前,NKH的标准治疗策略包括采用苯甲酸钠降低脑内甘氨酸浓度,以及受体拮抗剂右美沙芬和氯胺酮阻断NMDA受体[12-13]。Deutsch等[14]认为右美沙芬治疗减少了癫癎发作,可以改善部分患者预后。Chien等[15]则认为苯甲酸钠和右美沙芬联合对预后没有任何帮助。NKH的治疗效果与患儿体内甘氨酸脱羧酶失活程度相关。如果甘氨酸脱羧酶完全失活,即使从出生时就开始治疗,患儿仍可表现频繁的癫癎发作、智力运动发育落后和痉挛性瘫痪,甚至死亡[16];如果甘氨酸脱羧酶活性部分丧失,早期使用右美沙芬和苯甲酸钠治疗可改善预后[10, 17]。丙戊酸盐是甘氨酸裂解系统抑制剂,可导致甘氨酸浓度增高,需慎用于NKH患者[18]。本研究病例1发病初期短暂使用丙戊酸盐后病情加重可能与此有关。
总之,本研究在一个非经典型的NKH家系中发现2个新的GLDC基因突变(p.C1002W、p.S419X),体外质粒转染实验进一步证实了其致病性,本研究丰富了GLDC突变谱,为研究中国人群GLDC突变类型、遗传方式提供了一定的参考。
| [1] |
Coughlin CR 2nd, Swanson MA, Kronquist K, et al. The genetic basis of classic nonketotic hyperglycinemia due to mutations in GLDC and AMT[J]. Genet Med, 2017, 19(1): 104-111. DOI:10.1038/gim.2016.74 (  0) 0) |
| [2] |
Perry TL, Urquhart N, Maclean J, et al. Nonketotic hyperglycinemia. Glycine accumulation due to absence of glycerine cleavage in brain[J]. N Engl J Med, 1975, 292(24): 1269-1273. DOI:10.1056/NEJM197506122922404 (  0) 0) |
| [3] |
Baker PR 2nd, Friederich MW, Swanson MA, et al. Variant non ketotic hyperglycinemia is caused by mutations in LIAS, BOLA3 and the novel gene GLRX5[J]. Brain, 2014, 137(Pt 2): 366-379. (  0) 0) |
| [4] |
Brenton JN, Rust RS. Late-onset nonketotic hyperglycinemia with a heterozygous novel point mutation of the GLDC gene[J]. Pediatr Neurol, 2014, 50(5): 536-538. DOI:10.1016/j.pediatrneurol.2014.01.018 (  0) 0) |
| [5] |
Dinopoulos A, Matsubara Y, Kure S, et al. Atypical variants of nonketotic hyperglycinemia[J]. Mol Genet Metab, 2005, 86(1-2): 61-69. DOI:10.1016/j.ymgme.2005.07.016 (  0) 0) |
| [6] |
张蓉, 陈超, 曹云, 等. 新生儿非酮症性高甘氨酸血症1例[J]. 中国循证儿科杂志, 2009, 4(2): 153-155. (  0) 0) |
| [7] |
高志杰, 姜茜, 陈倩, 等. 1个非酮性高甘氨酸血症家系的临床和分子遗传学分析[J]. 中国当代儿科杂志, 2017, 19(3): 268-271. DOI:10.7499/j.issn.1008-8830.2017.03.003 (  0) 0) |
| [8] |
Rahman S, Footitt EJ, Varadkar S, et al. Inborn errors of metabolism causing epilepsy[J]. Dev Med Child Neurol, 2013, 55(1): 23-36. DOI:10.1111/dmcn.2012.55.issue-1 (  0) 0) |
| [9] |
Ezgu F, Çiftci B, Topçu B, et al. Diagnosis of glycine encephalopathy in a pediatric patient by detection of a GLDC mutation during initial next generation DNA sequencing[J]. Metab Brain Dis, 2014, 29(1): 211-213. DOI:10.1007/s11011-014-9482-y (  0) 0) |
| [10] |
Korman SH, Boneh A, Ichinohe A, et al. Persistent NKH with transient or absent symptoms and a homozygous GLDC mutation[J]. Ann Neurol, 2004, 56(1): 139-143. DOI:10.1002/(ISSN)1531-8249 (  0) 0) |
| [11] |
Swanson MA, Coughlin CR, Scharer GH, et al. Biochemical and molecular predictors for prognosis in nonketotic hyperglycinemia[J]. Ann Neurol, 2015, 78(4): 606-618. DOI:10.1002/ana.24485 (  0) 0) |
| [12] |
Van Hove JL, Vande KK, Hennermann JB, et al. Benzoate treatment and the glycine index in nonketotic hyperglycinaemia[J]. J Inherit Metab Dis, 2005, 28(5): 651-663. DOI:10.1007/s10545-005-0033-x (  0) 0) |
| [13] |
Suzuki Y, Kure S, Oota M, et al. Nonketotic hyperglycinemia:proposal of a diagnostic and treatment strategy[J]. Pediatr Neurol, 2010, 43(3): 221-224. DOI:10.1016/j.pediatrneurol.2010.04.018 (  0) 0) |
| [14] |
Deutsch SI, Rosse RB, Mastropaolo J. Current status of NMDA antagonist interventions in the treatment of nonketotic hyperglycinemia[J]. Clin Neuropharmacol, 1998, 21(2): 71-79. (  0) 0) |
| [15] |
Chien YH, Hsu CC, Huang A, et al. Poor outcome for neonatal-type nonketotic hyperglycinemia treated with high-dose sodium benzoate and dextromethorphan[J]. J Child Neurol, 2004, 19(1): 39-42. DOI:10.1177/08830738040190010702 (  0) 0) |
| [16] |
Korman SH, Wexler ID, Gutman A, et al. Treatment from birth of nonketotic hyperglycinemia due to a novel GLDC mutation[J]. Ann Neurol, 2006, 59(2): 411-415. DOI:10.1002/(ISSN)1531-8249 (  0) 0) |
| [17] |
Bjoraker KJ, Swanson MA, Christodoulou J, et al. Neurodevelopmental outcome and treatment efficacy of benzoate and dextromethorphan in siblings with attenuated nonketotic hyperglycinemia[J]. J Pediatr, 2016, 170: 234-239. DOI:10.1016/j.jpeds.2015.12.027 (  0) 0) |
| [18] |
Subramanian V, Kadiyala P, Hariharan P, et al. A rare case of glycine encephalopathy unveiled by valproate therapy[J]. J Pediatr Neurosci, 2015, 10(2): 143-145. DOI:10.4103/1817-1745.159200 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19


