糖原贮积症Ⅱ型(glycogen storage disease type Ⅱ, GSDⅡ, MIM 232300)是编码酸性α-葡萄糖苷酶(acid-alpha-glucosidase, GAA)的基因突变引起的常染色体隐性遗传性疾病。该病由于GAA活性下降或缺乏,导致糖原堆积在溶酶体和胞质中,引起心脏、骨骼肌等脏器损害。根据发病年龄,可分为婴儿型和晚发型。婴儿型症状较为严重,以快速进展的骨骼肌无力所致的呼吸衰竭及心肌肥厚所致心力衰竭为其特征性表现,如不及时治疗,多在1岁死亡。晚发型在幼年期或成人期起病,以骨骼肌受累为主,进展较慢,但呼吸肌受累可合并呼吸功能不全。该病的预测发生率约1/40 000,其中婴儿型的发生率约1/138 000,晚发型的发生率约1/5 700。婴儿型在非裔美国人及中国人中发病情况高于其他国家,晚发型在荷兰人中的发病率较高[1]。Liu等[2]对我国案例分析发现,GSDⅡ的诊断主要以GAA基因检测为主(69.7%),约33%行肌活检,16.2%行皮肤成纤维细胞GAA活性检查,48.5%行干血滤纸片和外周血白细胞GAA活性测定;本文报道3例经GAA基因分析证实的GSDⅡ患儿的临床和遗传学特征,并发现2个新突变。
1 资料与方法 1.1 研究对象病例1:患儿,男,4个月12 d。因发现体重不增3个月,呼吸困难1 d于2016年7月22日来我院就诊。患儿1个月前因体重不增就诊于外院,查心脏彩超示心脏增大,心肌肥厚,诊断为“肥厚型心肌病”。予护心、改善心脏功能等对症支持治疗15 d后好转不明显。1 d前出现呼吸困难,四肢肌力及肌张力低下,遂转至我院。患儿系第2胎第2产,足月顺产儿,出生体重为3.25 kg。现头不能竖立,会笑,但不能追物。父母体健,非近亲结婚,否认家族遗传病史。第1胎,男,体健,无特殊及类似疾病。体查:体温37.6℃,脉博169次/min,呼吸40次/min,血压90/62 mm Hg,体重4.5 kg,身长60 cm。营养不良貌,慢性病容,神志清楚。全身皮肤、巩膜无黄染。头颅无畸形,鼻翼无煽动,唇黏膜稍发绀,可见三凹征。双肺呼吸音粗,可闻及细湿罗音。心前区无隆起,心率169次/min,律齐,心音低钝,无杂音。腹软,肝右肋下3 cm,质中,脾左肋下未触及。双下肢肌力3~4级,肌张力低下,脊柱四肢无畸形。实验室检查:ALT 256 U/L(5~40 U/L),AST 147 U/L(5~40 U/L),总胆红素12.8 μmol/L(2~19 μmol/L),总胆汁酸5.7 μmol/L(0~10 μmol/L),CK 1363 U/L(24~194 U/L),CK-MB 64 IU/L(0~25 IU/L),LDH 1363 IU/L(100~240 IU/L);N末端脑钠肽10 699.9 pg/mL( < 200 pg/mL)。胸片示双肺野未见明显主质病变,心影增大,心胸比值0.6,左心源膨隆外延,胸骨后间隙变窄。心脏彩超:左右心室壁明显增厚,左室壁最厚处约13 mm,室壁回声粗糙,呈斑点样改变,心肌纹理排列紊乱,运动减低,室间隔与左室后壁非对称性肥厚,其厚度之比≥1.5,左心室射血分数(LVEF)42%;提示肥厚型心肌病,左室收缩功能减退。但患儿肥厚型心肌病临床症状与原发性肥厚型心肌病、心内膜弹力纤维增生症、心肌致密化不全等疾病不相符,亦不支持心肌炎诊断,故临床考虑代谢性心肌疾病中的GSDⅡ,为明确诊断拟进行GAA活性检测或GAA基因分析。
病例2:患儿,女,8岁。因发现肝酶升高5年来我院就诊。患儿5年前因感冒发现肝酶异常,就诊于当地医院,诊断为“肝炎”,予护肝等对症支持治疗好转。1年后,复查肝功能,仍有肝损伤,就诊于某省级医院,未能诊断明确,后间断予口服中药治疗。1年前患儿因肺炎再次住院,查肝酶仍高,考虑“自身免疫性肝炎”,予护肝等对症支持治疗,疗效欠佳。患儿既往有反复呼吸道感染史,系第3胎第2产,32周顺产出生,出生无窒息;1岁半行走路、说话,生长发育低于同龄儿;父母体健,非近亲结婚,其姐体健,家族中叔伯年幼亡故,病因不祥。体查:体重15 kg(-2 SD),身高119 cm(-1 SD)。消瘦貌,神志清楚。皮肤、巩膜无黄染,浅表淋巴结不大。双肺呼吸音粗,可闻及少量细湿罗音。心前区无隆起,心音低钝,无杂音。腹软,肝右肋下3 cm,质偏硬,有轻压痛,脾左肋下未触及。四肢肌张力、肌力正常,无腓肠肌肥大,Gower征阴性,双膝反射存在,病理征阴性。实验室检查:肝酶及肌酶异常(表 1),肾功能、电解质、支原体抗体、G6PD酶、铜蓝蛋白、自身免疫性肝炎全套均阴性;腹部彩超无异常。心脏彩超:三尖瓣轻度反流;左心收缩功能正常范围。肺功能:用力肺活量(FVC)为38%,最大肺活量(VUMAX)为35.5%,提示限制性通气障碍。诊断考虑糖原贮积症,且糖原贮积症分型中GSDⅡ晚发型可出现呼吸功能不全而导致反复呼吸道感染,故为进一步明确诊断及类型拟进行GAA活性检测或GAA基因检测。
| 表 1 病例2患儿肝功能及肌酶等结果变化 |
|
|
病例3:患儿,男,13岁,因发现肝酶升高5年来我院就诊。患儿5年前因间断呕吐在我院就诊,发现转氨酶升高(AST 156 U/L,ALT 121 U/L),肝、脾不大,诊断为传染性单核细胞增多症恢复期,予护肝等对症支持治疗,转氨酶较前下降好转出院。出院后定期复查肝功能仍升高,并排除感染性肝炎、Wilson's病、自身免疫性肝炎等疾病,予间断口服护肝药物,疗效欠佳。于1个月前再次来我院查肝酶仍高,伴肌酶升高明显,疑进行性肌营养不良收住院。患儿平素体健,系第1胎第1产,孕40周顺产出生,出生时无窒息,生长发育相似于同龄儿。体查:体温正常,呼吸23次/min,血压128/70 mm Hg。发育正常,营养中等,面容正常,神志清楚,步态正常。全身皮肤、巩膜无黄染,浅表淋巴结未扪及。双肺呼吸音粗,未闻及干湿罗音。心率87次/min,率齐,心音有力,无杂音。腹平软,肝右肋下1 cm,质软,脾左肋下未触及。脊柱四肢无畸形,腓肠肌无肥大,肌力、肌张力正常,Gower征阴性,腱反射存在,病理征均阴性。辅助检查:肝功能示ALT 193 U/L(5~40 U/L),AST 251 U/L(5~40 U/L),总胆红素8.2 μmol/L(2~19 μmol/L),总胆汁酸2.1 μmol/L(0~10 μmol/L),碱性磷酸酶366 U/L(40~110 U/L),γ-谷氨酰转肽酶36 U/L( < 50 U/L),CK 1 231 U/L(24~194 U/L),CK-MB 64 IU/L(0~25 IU/L),LDH 327 IU/L(100~240 IU/L);肝炎全套阴性,铜蓝蛋白、结缔组织、免疫全套、TORCH定量检测、自身免疫性肝炎全套等均正常。胸片、腹部彩超、心脏彩超、肌电图未见异常。诊断考虑代谢性肌病,且其中的GSDⅡ晚发型主要表现为进行性近端肌肉无力,进展相对较慢,实验室检查发现肌酶、肝酶增高,故为进一步明确诊断拟进行GAA活性检测或GAA基因检测。
1.2 进一步检查本研究获得患儿家属的知情同意,并通过医院伦理委员会审查通过,提取受检者及其父母的外周血5 mL,采用天根生化有限公司血液基因组DNA提取试剂盒[DP318-03(200)],根据操作说明提取DNA,通过紫外线分光光度仪进行质量质检。构建DNA文库,采用Illumina Hiseq 4000高通量测序仪进行测序。对测序仪获取的原始短序列运用NextGene V2.3.4软件(Softgenetics,美国)与UCSC数据库提供的人类基因组hg19参考序列进行比对。分析人类基因突变数据库HGMD、千人基因组数据库、dbSNP数据库信息,对检出的变异位点进行注释,确定突变位点发生的基因、坐标、mRNA位点、氨基酸改变,并用SIFT、PolyPhen2、Mutation_Taster等软件预测单核苷酸改变对蛋白功能的影响。
Sanger测序验证:对患儿突变区域进行Sanger测序验证,并进行家系传递分析。引物由北京康旭医学检验公司合成。实验室反应体系:Goldstar 12.5 μL,ddH2O 9.5 μL,Primer 2 μL,Temple DNA 1 μL,总体系25 μL。PCR扩增反应条件为94℃预变性10 min;然后94℃变性30 s,60℃退火30 s,72℃延伸45 s,35个循环;然后再72℃延伸10 min。利用凝胶成像系统观察条带扩增,单一条带者进行Sanger测序。所有突变结果均进行DNA双向测序和独立重复实验证实。
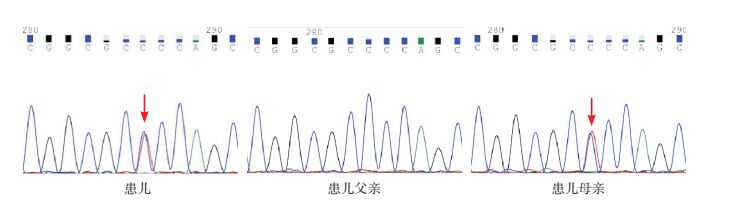
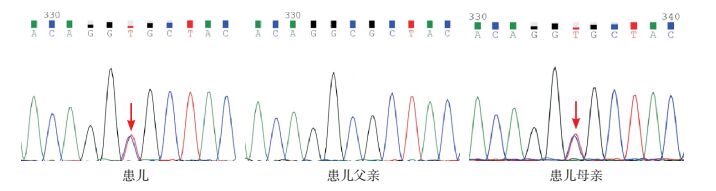
2 结果 2.1 GAA基因检测结果测序结果发现:在3例患者中共检出6种致病突变(表 2),包括c.1411_1414delGAGA(p.Glu471fs)阅读移码突变,c.2024_2026delACA(p.Asn675del)微小缺失突变,c.1843G > A(p.Gly615Arg)、c.2738C > T(p.Pro912Leu)、c.2104C > T(p.Arg702Cys)、c.568C > T(p.Arg190Cys)错义突变,其中c.2738C > T、c.568C > T错义突变尚未见文献报道,分别使第912位氨基酸由脯氨酸变成亮氨酸,第190位精氨酸转变为半胱氨酸,见图 1~2。
| 表 2 3例患儿的GAA基因突变 |
|
|
|
图 1 例2患儿及其父母GAA基因c.2738C > T突变位点测序图 例2患儿GAA基因检测中检出c.2738C > T新发突变,母亲为c.2738C > T杂合突变携带者,父亲c.2738C > T位点未见突变。箭头所示为突变位点。 |
|
图 2 例3患儿及其父母GAA基因c.568C > T突变位点测序图 例3患儿GAA基因检测中检出c.568C > T新发突变,其母亲为c.568C > T杂合突变携带者,父亲c.568C > T位点未见突变。箭头所示为突变位点。 |
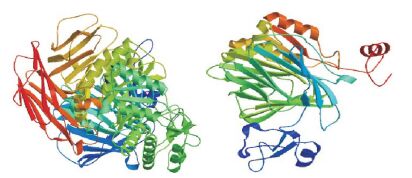
用SWISS-MODEL分别构建野生型和突变型GAA 3D模型,分析突变c.1411-1414delGAGA对GAA结构造成的影响,结果发现其突变导致GAA结构显著异常。见图 3。
|
图 3 野生型和突变型GAA 3D模型 左图:显示野生型GAA二聚体;右图:显示c.1411-1414delGAGA突变发生后GAA二聚体。 |
3例患儿经GAA基因突变检测后均诊断为GSDⅡ,其中例1为婴儿型GSDⅡ,例2、例3为晚发型GSDⅡ。3例患儿均因经济因素未予Myozyme特异性药物治疗。例1患儿于1岁内死亡;例2患儿经积极抗感染、护肝等治疗,仍频发肺部感染,且体重不增;例3患儿持续予护肝治疗,一般情况可,无肺部感染,乏力等,但其AST、ALT无明显下降。
3 讨论婴儿型GSDⅡ是GSDⅡ型最为严重的一型,因其GAA活性极低或缺乏( < 正常人的1%),而在婴儿期起病,快速进展的骨骼肌无力所致呼吸衰竭及心肌肥大所致心力衰竭为其特征性表现,例1属于经典婴儿型GSDⅡ。患儿多于出生后不久出现多器官组织的异常,常表现为心脏增大、心肌肥厚,肌力、肌张力低下,呼吸窘迫,喂养困难,发育不良[3]。晚发型GSDⅡ包括青少年型和成人型,其体内尚残留部分GAA活性(2%~30%),前者在1~19岁起病,后者常于20~40岁起病,本文例2、例3均属于晚发型中的青少年型。其主要表现为肢带型肌营养不良和呼吸功能不全。近几年发现晚发型GSDⅡ是一种多系统疾病,包括肌肉、呼吸、肌肉骨骼、周围神经、血管、心脏、胃肠道系统[4-6]。因临床症状多,不典型,临床罕见而常导致误诊、漏诊[7]。辅助检查中,95%的GSDⅡ患者CK升高,且常伴AST、ALT升高,但因其特异性较低,临床常易于忽略。Lukacs等[8]曾报道对于非特异性持续性不明原因的CK升高,尽早进行GAA基因检测比肌肉活检更有意义。GSDⅡ的诊断依赖于酶活性测定、肌肉活检以及基因检测。因实验条件限制,本文3例均未做GAA活性测定,而行GAA基因检测。
GAA基因突变主要通过改变酶活性而影响其临床表现。GAA基因突变可影响GAA的合成、磷酸化修饰、转运和分泌等环节,其突变性质及突变片段的不同组合最终决定残留GAA的活性水平。残留GAA活性越低、发病年龄越早、临床表现越严重[9]。GAA基因突变存在明显的种族特异性,例1患儿c.1483G > A和c.1411-1414 delGAGA复合杂合性突变,已被证实具有致病性[10-11],为我国台湾地区常见的婴儿型GSDⅡ基因型[12]。用SWISS-MODEL分别构建野生型和突变型GAA 3D模型,分析突变c.1411-1414delGAGA对GAA结构造成的影响,结果发现其突变导致GAA结构显著异常,对GAA活性影响大,故c.1411-1414delGAGA为严重致病突变,会导致病情严重的GSDⅡ。例2、例3患儿中的c.2024_2026delACA微小缺失突变及c.2104C > T错义突变,曾有文献[13-14]报道发生在婴儿型GSDⅡ中,但其临床意义未明,本文再次检测,证实为可能致病突变。例2患儿中位于第19号外显子上的c.2738C > T错义突变是迄今未曾报道过的新发现突变,它使第913位氨基酸由脯氨酸变成亮氨酸,由于带碱性的脯氨酸转变为中性氨基酸亮氨酸,可能影响了酶适宜的pH值,从而可能导致酶活性的减低。Herzog等[15]曾报道c.2738C > G可能为不严重致病突变,例2患儿在该位点发生错义突变,或可能与c.2024_2026delACA突变的复合杂合突变相互影响而导致临床表型的出现。例3患儿中c.568C > T错义突变导致第190位氨基酸由精氨酸变为半胱氨酸,该突变致病性尚未见文献报道,由于带碱性的精氨酸转变为中性氨基酸半胱氨酸,以致影响GAA的合成,该突变不属于多态性变化,在人群中发生的频率极低(参考数据库:1000Genomes、dbSNP),因而c.568C > T错义突变可能为新的致病突变。
Myozyme是目前唯一针对GSDⅡ的特异性治疗药物,较早用药可以获得较好疗效,能显著改善运动功能、缓解心肌病的进展[16]。迟发型GSDⅡ因其呼吸肌及膈肌的受累,肺功能常显示限制性通气障碍,且常导致长期慢性缺氧而不自知。肺功能的监测能有效预测患儿的通气功能及指导预后,一定程度延缓患儿的生命,提高生活质量[17]。故定期的检测肺功能,并在有呼吸衰退迹象时尽早予氧气吸入或无创呼吸机辅助呼吸,可尽早的稳定病情,延长恶化时间。
| [1] |
Kishnani PS, Howell RR. Pompe disease in infants and children[J]. J Pediatr, 2004, 144(5 Suppl): S35-S43. (  0) 0) |
| [2] |
Liu Y, Yang Y, Wang B, et al. Infantile Pompe disease:a case report and review of the Chinese literature[J]. Exp Ther Med, 2016, 11(1): 235-238. DOI:10.3892/etm.2015.2862 (  0) 0) |
| [3] |
Kishnani PS, Hwu WL, Mandel H, et al. A retrospective, multinational, multicenter study on the natural history of infantile-onset Pompe disease[J]. J Pediatr, 2006, 148(5): 671-676. DOI:10.1016/j.jpeds.2005.11.033 (  0) 0) |
| [4] |
Chan J, Desai AK, Kazi ZB, et al. The emerging phenotype of late-onset Pompe disease:a systematic literature review[J]. Mol Genet Metab, 2017, 120(3): 163-172. DOI:10.1016/j.ymgme.2016.12.004 (  0) 0) |
| [5] |
Chu YP, Sheng B, Lau KK, et al. Clinical manifestation of late onset Pompe disease patients in Hong Kong[J]. Neuromuscul Disord, 2016, 26(12): 873-879. DOI:10.1016/j.nmd.2016.09.004 (  0) 0) |
| [6] |
Kishnani PS, Steiner RD, Bali D, et al. Pompe disease diagnosis and management guideline[J]. Genet Med, 2006, 8(5): 267-288. DOI:10.1097/01.gim.0000218152.87434.f3 (  0) 0) |
| [7] |
Pérez-López J, Selva-O'Callaghan A, Grau-Junyent JM, et al. Delayed diagnosis of late-onset Pompe disease in patients with myopathies of unknown origin and/or hyperCKemia[J]. Mol Genet Metab, 2015, 114(4): 580-583. DOI:10.1016/j.ymgme.2015.02.004 (  0) 0) |
| [8] |
Lukacs Z, Nieves Cobos P, Wenninger S, et al. Prevalence of Pompe disease in 3, 076 patients with hyperCKemia and limb-girdle muscular weakness[J]. Neurology, 2016, 87(3): 295-298. DOI:10.1212/WNL.0000000000002758 (  0) 0) |
| [9] |
Hermans MM, van Leenen D, Kroos MA, et al. Twenty-two novel mutations in the lysosomal alpha-glucosidase gene (GAA) underscore the genotype-phenotype correlation in glycogen storage disease type Ⅱ[J]. Hum Mutat, 2004, 23(1): 47-56. DOI:10.1002/(ISSN)1098-1004 (  0) 0) |
| [10] |
陈素琴, 陈路明, 田秋红, 等. 婴儿肥厚型心肌病一家系GAA基因的突变分析[J]. 中山大学学报(医学科学版), 2014, 35(1): 139-143. (  0) 0) |
| [11] |
Shieh JJ, Lin CY. Identification of a small deletion in one allele of patients with infantile form of glycogen storage disease type Ⅱ[J]. Biochem Biophys Res Commun, 1996, 219(2): 322-326. DOI:10.1006/bbrc.1996.0231 (  0) 0) |
| [12] |
单岩东, 王朝东, 张昆南, 等. Ⅱ型糖原累积病的研究进展[J]. 中国临床神经科学, 2007, 15(2): 203-207. (  0) 0) |
| [13] |
Shieh JJ, Lin CY. Frequent mutation in Chinese patients with infantile type of GSD Ⅱ in Taiwan:evidence for a founder effect[J]. Hum Mutat, 1998, 11(4): 306-312. DOI:10.1002/(ISSN)1098-1004 (  0) 0) |
| [14] |
Montalvo AL, Cariati R, Deganuto M, et al. Glycogenosis type Ⅱ:identification and expression of three novel mutations in the acid alpha-glucosidase gene causing the infantile form of the disease[J]. Mol Genet Metab, 2004, 81(3): 203-208. DOI:10.1016/j.ymgme.2003.11.011 (  0) 0) |
| [15] |
Herzog A, Hartung R, Reuser AJ, et al. A cross-sectional single-centre study on the spectrum of Pompe disease, German patients:molecular analysis of the GAA gene, manifestation and genotype-phenotype correlations[J]. Orphanet J Rare Dis, 2012, 7: 35. DOI:10.1186/1750-1172-7-35 (  0) 0) |
| [16] |
Yang CF, Yang CC, Liao HC, et al. Very early treatment for infantile-onset Pompe disease contributes to better outcomes[J]. J Pediatr, 2016, 169: 174-180. DOI:10.1016/j.jpeds.2015.10.078 (  0) 0) |
| [17] |
Johnson EM, Roberts M, Mozaffar T, et al. Pulmonary function tests (maximum inspiratory pressure, maximum expiratory pressure, vital capacity, forced vital capacity) predict ventilator use in late-onset Pompe disease[J]. Neuromuscul Disord, 2016, 26(2): 136-145. DOI:10.1016/j.nmd.2015.11.009 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19


