Alagille综合征(Alagille syndrome, ALGS)是一种常染色体显性遗传病,可累及肝脏、心脏、骨骼、眼睛、肾脏、颜面等多个系统,常以婴儿期胆汁淤积为突出表现[1-2]。本病于1969年由Alagille等首次描述,并在1975年得到进一步阐述[3]。国外有文献报道本病发病率约1/30 000[4],目前国内尚无关于本病的流行病学数据。近年研究表明,94%的ALGS由编码JAGGED1蛋白的JAG1基因突变导致,约1.5%患者由NOTCH2基因突变导致,另有4.5%的患者致病基因不明[5]。
JAG1基因定位在染色体20p12,共有26个外显子和25个内含子,基因组全长38 kb,编码细胞膜表面蛋白JAGGED1。JAGGED1是Notch受体的功能性配体,受体与配体相互作用启动下游信号转录,从而影响细胞的增殖与分化[6]。目前人类基因突变信息库(HGMD,http://www.hgmd.cf.ac.uk)已收录JAG1突变467种,其中大片段缺失仅49例,约占JAG1基因突变的10%。国内儿科界虽有本病分子诊断的报道[7-8],但JAG1基因大片段缺失罕见。本文报道1例ALGS患儿的临床特征和一个新的包含JAG1基因的染色体中间缺失,为本病诊治提供参考。
1 资料与方法 1.1 病例介绍患儿,男,3个月10 d。因皮肤、巩膜黄染3个月来我院就诊。患儿生后约2周开始出现皮肤、巩膜黄染,不伴咳嗽、咳痰,无发热、寒战,无腹泻、便秘,无陶土样大便。生后3月龄时于当地医院诊治,查肝功能异常,总胆红素高,且以结合胆红素升高为主(表 1)。心脏彩超示:卵圆孔未闭(2.5 mm);主肺动脉形态偏细。上腹部磁共振(MR)平扫+磁共振胰胆管造影(MRCP)检查未见明确异常。腹部B超示肝脾未见明显异常,肠气影响胆囊显示不清。予甘草酸二胺护肝、口服茵栀黄退黄等治疗4 d。患儿肝功能及胆红素未见明显好转(表 1),为进一步诊治而转入我院。
| 表 1 患儿实验室指标随年龄的纵向比较 |
|
|
患儿系第1胎第1产,出生胎龄36+3周,因“双卵双胎,体外受精-胚胎移植术后”在当地医院行剖宫产出生,出生时1 min、5 min及10 min Apgar评分分别为9分、10分和10分,出生体重2.01 kg(小于胎龄儿)。双胎之小出生体重2.0 kg,体健。父母体健,非近亲结婚。母孕期按时产检,未发现异常。否认家族史。
体格检查:体重4.1 kg( < -3 SD),身长43 cm( < -3 SD),头围37 cm( < -2 SD)。神志清楚,精神可,发育落后,营养差。全身皮肤、巩膜黄染,无皮疹及皮下出血点,浅表淋巴结未触及肿大。前囟平软,宽额头,小下颌,可追视物体,唇红,咽无充血,未见脓性分泌物。颈软,无抵抗,可竖头,气管居中,胸廓对称,双肺呼吸音清,未闻及干、湿罗音。心律齐,心音有力,胸骨左缘第2、3肋间可闻及3~4/6级收缩期杂音。腹胀,腹壁静脉可见,肝右肋下3 cm,质地中等;脾肋下未及,移动性浊音(-),肠鸣音正常。脊柱、四肢无畸形,四肢有自主活动,肛门及外生殖器无异常。生理性反射正常,病理反射未引出。
辅助检查:入院后查血常规大致正常。生化检查示肝功能异常,总胆红素升高,且以结合胆红素升高为主(表 1),电解质检查示血清锌10.5 μmol/L(参考值11.5~25.5 μmol/L),铜25 μmol/L(参考值11.0~22.0 μmol/L),余电解质大致正常。25-(OH)D3 6.14 ng/mL(参考值30~100 ng/mL)。血清铁蛋白、尿及粪便常规正常。腹部彩超示:胆囊充盈欠佳,吃奶后胆囊可收缩;肝门部未见明显增厚的纤维索;肝实质弹性在正常范围;脾脏未见明显异常。心脏彩超示:符合先天性心脏病—房间隔缺损(继发孔型,左向右分流);肺动脉狭窄(轻度);三尖瓣反流(轻度)。脊柱正侧位片未见明显异常。眼科会诊示:眼底未见明显异常;无角膜后胚胎环;视网膜正常;双侧虹膜褪色暗淡。
1.2 目标基因捕获及二代测序用EDTA抗凝管采集患儿静脉血2 mL,采用Blood DNA Minikit试剂盒(杭州新景生物试剂开发有限公司)提取患儿基因组DNA并进行质量控制。质控合格的基因组DNA打断并进行扩增,建立代谢性肝病相关基因(JAG1、NOTCH2、G6PC、GALT、GBA等)的全基因组文库。用液相捕获试剂盒(北京迈基诺基因科技股份有限公司)捕获上述目标基因,然后利用新一代测序仪HiSeq2000(Illumina公司,美国)进行高通量测序。对测序获得的序列进行单核苷酸多态性(single nucleotide polymorphisms, SNP)和插入缺失标记(insertion-deletion, InDel)分析。利用共识编码序列(consensus coding sequence, CCDS)、人类基因组数据库(NCBI36.3)、寡核苷酸多态性数据库(database of SNP, dbSNP)(v130)信息对SNP和InDel进行注释,确定突变位点发生的基因、坐标、mRNA位点、氨基酸改变、SNP功能(错义突变/无义突变/可变剪切位点)、InDel功能(氨基酸插入/氨基酸缺失/移码突变)。
1.3 染色体微阵列技术定位缺失片段用EDTA抗凝管采集患儿静脉血2 mL送广州金域医学检验中心。采用Affymetrix公司染色体微阵列试剂盒,经过DNA提取、酶切、连接、PCR、PCR产物纯化、片段化、标记、杂交等过程,然后使用CytoScanHD基因芯片进行全基因组范围扫描,最后以Affymetrix公司提供的正常人DNA作为对照标准,对扫描结果参照基因变异数据库(Database of Genomic Variants, DGV)使用Chromosome Analysis Suite软件进行分析。
2 结果 2.1 遗传学分析结果二代测序发现该患儿JAG1基因存在整体杂合缺失,但具体断裂点不详(图 1)。
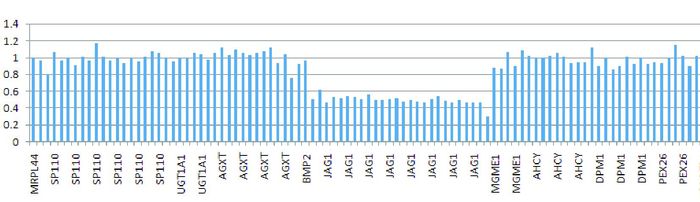
|
图 1 患儿二代测序缺失基因图 可见JAG1基因所有外显子信号均明显低于其他基因,提示JAG1基因整体杂合缺失。 |
进一步采用染色体微阵列技术,在患儿chr20p12.3p12.2(7 824 240~10 831 812)处检出一个约3.0 Mb的中间缺失(图 2)。缺失片段中包含HAO1、TMX4、PLCB1、PLCB4、LAMP5、PAK7、SNAP25-AS1、ANKEF1、SNAP25、MKKS、SLX4IP和JAG1等12个基因。经检索UCSC Genome Browser(http://genome.ucsc.edu),发现这个3.0 Mb的染色体缺失片段,包含在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man, OMIM)已收录的9种基因(表 2),其中包含重要功能基因JAG1,从而证实该患儿为完整JAG1基因杂合缺失导致的ALGS患者。经检索HGMD、PubMed、万方、维普和知网等国内外数据库,未发现该缺失的文献报道。HGMD数据库中收录的表现为ALGS的3.0~4.0 Mb的缺失片段共5个(表 3)[9],均与本研究发现的中间缺失性质不同。
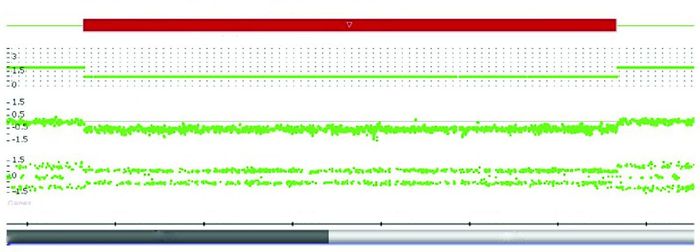
|
图 2 染色体微阵列检测结果截图 患儿chr20p12.3p12.2(7 824 240~10 831 812)处存在3 007 573 bp的缺失。 |
| 表 2 患儿缺失片段包含的在OMIM中已报道的基因 |
|
|
| 表 3 HGMD数据库中收录的表现为ALGS的染色体缺失片段 |
|
|
患儿入院后给予无乳糖并强化中链甘油三酯的配方奶粉喂养,还原型谷胱甘肽护肝,康普力星补锌,补充维生素AD及维生素E等对症支持治疗9 d后出院,嘱门诊随访。出院诊断:胆汁淤积症;房间隔缺损(继发孔型,左向右分流);肺动脉口狭窄(轻度);锌缺乏症;维生素D缺乏症。8个月大时门诊复查肝功能明显好转,胆红素较前明显下降(表 1)。11个月大时门诊随访,身高69.0 cm( < -1 SD),体重7.25 kg( < -2 SD),头围43.5 cm( < -1 SD),无肉眼可见黄疸,与住院时比较胆红素水平下降(表 1)。
3 讨论ALGS的诊断经历了从临床诊断[10]到加入肝脏活检病理诊断依据[1],再到加入分子生物学诊断依据[11]的过程。Kamath[12]和Guru Murthy等[13]提出本病修订诊断标准,纳入了肾脏表现、家族史和基因突变等诊断依据。根据该标准,若检测到JAG1基因突变,有1个或以上主要临床特征即可确诊。本例患儿存在JAG1基因缺失,并存在特殊面容、心脏畸形和胆汁淤积等临床表现,诊断ALGS明确。遗传性胆汁淤积症致病基因种类繁多,采用二代测序技术可同时对多个致病基因进行检测,降低漏诊及误诊率,同时避免了一代测序耗费人力、物力及耗时长等缺点。然而二代测序对于大片段基因缺失不能明确缺失起止位点,需要通过染色体微阵列技术等手段深入分析才能明确突变具体性质。2010年国际细胞基因组芯片标准协作组推荐将染色体微阵列技术作为对原因不明的多种体征畸形患者的首选临床一线检测方法[14]。本例患儿就是联合应用二代测序和染色体微阵列技术,最终发现了一个涉及JAG1基因的新中间缺失,从而为患者确诊提供了遗传学依据。HGMD数据库中已收录5个导致ALGS的染色体缺失,但其性质均与本病例不同[9]。
本研究发现的中间缺失包含HAO1、TMX4、PLCB1、PLCB4、LAMP5、PAK7、SNAP25-AS1、ANKEF1、SNAP25、MKKS、SLX4IP和JAG1等12个基因,其中有9个已被收录于OMIM。JAG1、PLCB4和SNAP25基因可呈常染色体显性遗传方式,PLCB1和MKKS基因呈常染色体隐性遗传,其余4个基因遗传方式不明。但PLCB4突变可引起耳髁状突综合征,表现为外耳或下颚畸形,而SNAP25突变可引起先天性肌无力。本文患儿缺乏相应临床表现,所以不能确诊相应的遗传性疾病。患儿虽有PLCB4和SNAP25基因缺失却未出现相应临床表现,这种现象在遗传学上称为不穿透(non-penetrance)[15]。实际上,并非所有含有JAG1基因突变者均有ALGS的临床表现,ALGS的穿透度约为94%[16]。
ALGS目前尚无根治手段,其治疗以对症支持为主。注意平衡膳食,补充微量元素及脂溶性维生素,可改善生长发育落后[17]。予以深度水解蛋白及强化中链甘油三酯奶粉喂养。轻症者可口服熊去氧胆酸促进胆汁分泌,口服考来烯胺吸附胆汁酸。药物治疗失败可行胆汁部分外转流术[18]。若出现门脉高压,继发严重胆汁淤积,黄色瘤病,难治性瘙痒,生长发育落后、生活质量下降需要进行肝移植[19]。几乎所有早期死亡者均死于心脏病变。周围肺动脉狭窄是ALGS最常见的心脏异常,可进行导管介入干预[20]或行肺动脉重建术[21]。Fukumoto等[22]的实践表明,对ALGS相关白内障病人可进行白内障超声乳化术及人工晶体植入术。肾脏损伤可考虑透析治疗,但对于严重肾病可进行肾移植[23]。本文患儿经特殊配方奶粉喂养,并补充锌和脂溶性维生素等对症支持治疗,目前病情平稳,但其远期预后有待随访观察。
总之,本研究采用目标基因捕获二代测序技术和染色体微阵列技术,在1例ALGS患儿中检测到1个包含JAG1基因的新中间缺失。这一发现扩展了JAG1基因突变谱,同时为患儿诊断和治疗,以及家系遗传咨询和产前诊断提供了遗传学依据。
| [1] |
McElhinney DB, Krantz ID, Bason L, et al. Analysis of cardiovascular phenotype and genotype-phenotype correlation in individuals with a JAG1 mutation and/or Alagille syndrome[J]. Circulation, 2002, 106(20): 2567-2574. DOI:10.1161/01.CIR.0000037221.45902.69 (  0) 0) |
| [2] |
Balistreri WF, Bezerra JA, Jansen P, et al. Intrahepatic cholestasis:summary of an American Association for the Study of Liver Diseases single-topic conference[J]. Hepatology, 2005, 42(1): 222-235. DOI:10.1002/(ISSN)1527-3350 (  0) 0) |
| [3] |
Alagille D, Odièvre M, Gautier M, et al. Hepatic ductular hypoplasia associated with characteristic facies, vertebral malformations, retarded physical, mental, and sexual development, and cardiac murmur[J]. J Pediatr, 1975, 86(1): 63-71. DOI:10.1016/S0022-3476(75)80706-2 (  0) 0) |
| [4] |
Kamath BM, Yin W, Miller H, et al. Outcomes of liver transplantation for patients with Alagille syndrome:the studies of pediatric liver transplantation experience[J]. Liver Transpl, 2012, 18(8): 940-948. DOI:10.1002/lt.v18.8 (  0) 0) |
| [5] |
Leonard LD, Chao G, Baker A, et al. Clinical utility gene card for:Alagille syndrome (ALGS)[J]. Eur J Hum Genet, 2014, 22(3): e1-e4. (  0) 0) |
| [6] |
Vanorny DA, Prasasya RD, Chalpe AJ, et al. Notch signaling regulates ovarian follicle formation and coordinates follicular growth[J]. Mol Endocrinol, 2014, 28(4): 499-511. DOI:10.1210/me.2013-1288 (  0) 0) |
| [7] |
程映, 赵书涛, 郭丽, 等. 1个Alagille综合征家系中JAG1基因新突变的识别[J]. 中国当代儿科杂志, 2016, 18(11): 1130-1135. DOI:10.7499/j.issn.1008-8830.2016.11.015 (  0) 0) |
| [8] |
Li L, Dong J, Wang X, et al. JAG1 mutation spectrum and origin in Chinese children with clinical features of Alagille syndrome[J]. PLoS One, 2015, 10(6): e0130355. DOI:10.1371/journal.pone.0130355 (  0) 0) |
| [9] |
Kamath BM, Thiel BD, Gai X, et al. SNP array mapping of chromosome 20p deletions:genotypes, phenotypes, and copy number variation[J]. Hum Mutat, 2009, 30(3): 371-378. DOI:10.1002/humu.v30:3 (  0) 0) |
| [10] |
Alagille D, Estrada A, Hadchouel M, et al. Syndromic paucity of interlobular bile ducts (Alagille syndrome or arteriohepatic dysplasia):review of 80 cases[J]. J Pediatr, 1987, 110(2): 195-200. DOI:10.1016/S0022-3476(87)80153-1 (  0) 0) |
| [11] |
Li L, Krantz ID, Deng Y, et al. Alagille syndrome is caused by mutations in human Jagged1, which encodes a ligand for Notch1[J]. Nat Genet, 1997, 16(3): 243-251. DOI:10.1038/ng0797-243 (  0) 0) |
| [12] |
Kamath BM. Alagille syndrome[M]//Suchy FJ, Sokal RJ, Balistreri WF, et al. Liver disease in children. 3rd ed. New York:Cambridge University Press, 2007:326-345.
(  0) 0) |
| [13] |
Guru Murthy GS, Rana BS, Das A, et al. Alagille syndrome:a rare disease in an adolescent[J]. Dig Dis Sci, 2012, 57(11): 3035-3037. DOI:10.1007/s10620-012-2226-0 (  0) 0) |
| [14] |
Miller DT, Adam MP, Aradhya S, et al. Consensus statement:chromosomal microarray is a first-tier clinical diagnostic test for individuals with developmental disabilities or congenital anomalies[J]. Am J Hum Genet, 2010, 86(5): 749-764. DOI:10.1016/j.ajhg.2010.04.006 (  0) 0) |
| [15] |
Angus J. Genetics[M]//Lissauer T, Carrol W. Illustrated textbook of pediatrics. 5 th ed. Amsterdam:Elsevier, 2017:128.
(  0) 0) |
| [16] |
Dhorne-Pollet S, Deleuze JF, Hadchouel M, et al. Segregation analysis of Alagille syndrome[J]. J Med Genet, 1994, 31(6): 453-457. DOI:10.1136/jmg.31.6.453 (  0) 0) |
| [17] |
Turnpenny PD, Ellard S. Alagille syndrome:pathogenesis, diagnosis and management[J]. Eur J Hum Genet, 2012, 20(3): 251-257. DOI:10.1038/ejhg.2011.181 (  0) 0) |
| [18] |
Whitington PF, Whitington GL. Partial external diversion of bile for the treatment of intractable pruritus associated with intrahepatic cholestasis[J]. Gastroenterology, 1988, 95(1): 130-136. DOI:10.1016/0016-5085(88)90301-0 (  0) 0) |
| [19] |
Mozer-Glassberg Y, Hojsak I, Zevit N, et al. Pruritus responsive to naltrexone in a patient with cholestatic liver disease[J]. Isr Med Assoc J, 2011, 13(2): 111-112. (  0) 0) |
| [20] |
Cunningham JW, McElhinney DB, Gauvreau K, et al. Outcomes after primary transcatheter therapy in infants and young children with severe bilateral peripheral pulmonary artery stenosis[J]. Circ Cardiovasc Interv, 2013, 6(4): 460-467. DOI:10.1161/CIRCINTERVENTIONS.112.000061 (  0) 0) |
| [21] |
Mainwaring RD, Sheikh AY, Punn R, et al. Surgical outcomes for patients with pulmonary atresia/major aortopulmonary collaterals and Alagille syndrome[J]. Eur J Cardiothorac Surg, 2012, 42(2): 235-240. DOI:10.1093/ejcts/ezr310 (  0) 0) |
| [22] |
Fukumoto M, Ikeda T, Sugiyama T, et al. A case of Alagille syndrome complicated by intraocular lens subluxation and rhegmatogenous retinal detachment[J]. Clin Ophthalmol, 2013, 7: 1463-1465. (  0) 0) |
| [23] |
Shrivastava R, Williams A, Mikhail A, et al. An unusual cause of hypertension and renal failure:a case series of a family with Alagille syndrome[J]. Nephrol Dial Transplant, 2010, 25(5): 1501-1506. DOI:10.1093/ndt/gfp692 (  0) 0) |
 2017, Vol. 19
2017, Vol. 19


