2. 江西省儿童医院呼吸科, 江西 南昌 330006
例1,女,2岁,因面色苍白伴间断性咳嗽1年余、加重6 d入院。患儿1年前出现咳嗽、面色苍白,无发热及咯血,当地医院诊断为“特发性肺含铁血黄素沉着症、重度贫血”,给予输血及激素治疗(甲泼尼龙琥珀酸钠每日2 mg/kg静滴,2周后改为甲泼尼龙片每日1.5 mg/kg口服,口服4周后渐减量,每周减量2 mg,以8 mg/d维持),病情有好转,但反复发作。入院查体:神志清楚,T36.2℃,P128次/min,R 26次/min,BP 90/60 mm Hg。全身皮肤未见皮疹及出血点,库欣貌,贫血面容,双肺呼吸音粗,未闻及干湿性啰音。心脏、腹部检查无特殊。双下肢无水肿,无杵状指趾。神经系统检查无特殊。患儿无药物及食物过敏史,无传染病及其接触史。患儿出生胎龄29+5周,有窒息抢救史。家族中无类似病史。辅助检查:血常规示WBC 9.7~20.3×109/L,Hb 67.2~90.2 g/L,PLT、白细胞分类及网织红细胞计数正常;大小便常规正常;CRP、血气分析、凝血功能、肝肾功能、T细胞斑点试验(T-SPOT)、抗中性粒细胞胞浆抗体(ANCA)、抗核抗体、抗线粒体抗体、抗肝肾微粒体抗体、抗双链DNA(dsDNA)抗体、抗组织细胞抗体、Coomb's试验、免疫球蛋白、淋巴细胞亚群分析均正常;肺部CT提示双肺透亮度不均匀降低,呈毛玻璃样改变,两肺弥漫分布小颗粒影和网格影;纤维支气管镜肺泡灌洗液呈不凝固的血性改变,含铁血黄素试验阳性。
例2,女,8岁,因反复面色苍白7年伴间断性咳嗽入院。患儿7年前因面色苍白住院,诊断为“肺含铁血黄素沉着症、重度贫血”,给予输血、抗感染及激素治疗(氢化可的松每日10 mg/kg静滴,1周后改为强的松片每日1 mg/kg口服,口服2周后减量,以5 mg/d维持2年),病情好转但有反复,并多次因贫血住院。入院查体:神清,T 36.3℃,P 82次/min,R 28次/min,BP 100/75 mm Hg。全身皮肤无皮疹及出血点,双肺呼吸音粗、未闻及干湿啰音,心脏、腹部体查无特殊。双下肢无水肿,无杵状指趾。神经系统检查无特殊。既往史、个人史及家族史无特殊。辅助检查:血常规Hb 100 g/L,余项正常;大小便常规正常;CRP、凝血功能、ANCA、抗核抗体、抗线粒体抗体、抗肝肾微粒体抗体、抗dsDNA抗体、抗组织细胞抗体、Coomb, s试验、免疫球蛋白、淋巴细胞亚群分析及中性粒细胞呼吸爆发功能均正常;肺部CT示两肺上叶及下叶多发斑片状、条片状及磨玻璃样高密度影;纤维支气管镜肺泡灌洗液呈不凝固的血性改变,含铁血黄素试验阳性。
例3,女,3岁,因面色苍白、间断咳嗽1年余,加重伴气促3 d住院。患儿1年余前出现面色苍白、间断咳嗽,诊断为“肺炎、重度贫血”,予抗感染及输血治疗,效果不佳,咳嗽、贫血反复发作,半年前行纤维支气管镜检查,考虑“肺含铁血黄素沉着症”,给予激素治疗(甲泼尼龙琥珀酸钠每日2 mg/kg静滴,1周后改为甲泼尼龙片每日1.5 mg/kg口服,2周后逐渐减量,每日4mg/d口服维持),1个月后好转,3 d前因面色苍白加重、呼吸急促住院。入院查体:神清,T 37℃,P 124次/min,R 34次/min,BP 102/59 mm Hg。贫血貌,呼吸急促,全身皮肤无皮疹及出血点,双肺呼吸音粗,未闻及干湿性啰音,心脏、腹部体查无特殊。双下肢无水肿,神经系统查体无特殊。既往史、个人史及家族史无特殊。辅助检查:血常规示Hb 107.2 g/L,网织红细胞比例6.0%,余项正常;CRP 12 mg/L;大小便常规、凝血功能、肝肾功能、ANCA、抗核抗体、抗线粒体抗体、抗肝肾微粒体抗体、抗dsDNA抗体、抗组织细胞抗体、Coomb, s试验、免疫球蛋白、淋巴细胞亚群分析及中性粒细胞呼吸爆发功能均正常;胸部增强CT提示两肺广泛间质改变;纤维支气管镜肺泡灌洗液呈不凝固的血性改变,含铁血黄素试验阳性。
例4,女,3岁,因咳嗽1周余入院。患儿1周余前无明显诱因出现咳嗽,无发热,无喘息,予以抗感染、止咳等治疗无好转,5 d前发现血红蛋白88 g/L,4 d前血红蛋白降至61 g/L;胸部CT提示两肺纹理增多,呈磨玻璃样改变,另见团片状密度增高影。入院查体:神志清楚,T 36℃,P 122次/min,R 23次/min,BP 94/51 mm Hg。皮肤黏膜无皮疹及出血点,双肺呼吸音粗,未闻及干湿性啰音,心脏、腹部检查无特殊,肌力及肌张力正常,神经系统检查无特殊。既往史、个人史及家族史无特殊。辅助检查:血常规示WBC 11.7×109/L,N 62.6%,Hb 88 g/L,余项正常;大小便常规、CRP、凝血功能、肝肾功能、ANCA、T-SPOT、免疫球蛋白、淋巴细胞亚群分析、抗核抗体、抗线粒体抗体、抗肝肾微粒体抗体、抗dsDNA抗体、抗组织细胞抗体均正常;胃液含铁血黄素细胞阳性;胸片示两肺渗出改变;纤维支气管镜肺泡灌洗液呈不凝固的血性改变,含铁血黄素试验阳性。
2 诊断思维4例患者均有咳嗽/贫血,有的以贫血为首发症状,有的伴气促,肺部影像学检查均有磨玻璃样改变或间质样改变,肺泡灌洗液均呈不凝固的血性改变、含铁血黄素试验阳性,弥漫性肺泡出血(diffuse alveolar hemorrhage, DAH)的诊断是明确的。
儿童DAH的病因根据是否存在肺泡毛细血管炎或心血管疾病分为:(1)存在肺泡毛细血管炎者,如ANCA相关肾小球肾炎、自身免疫性疾病相关小血管炎等;(2)心血管疾病,如肺动脉高压、血管畸形、肺栓塞等;(3)无肺泡毛细血管炎及心血管疾病,如特发性肺含铁血黄素沉着症(idiopathicpulmonary hemosiderosis, IPH)、血液系统相关疾病、感染、中毒、免疫缺陷病等[1]。本研究4例患儿均无皮肤、关节症状及体征,无肾脏及其他系统受累的线索,ANCA、抗核抗体、抗dsDNA抗体、抗线粒体抗体均阴性,无ANCA相关的肾小球肾炎,也无幼年特发性关节炎、系统性红斑狼疮、皮肌炎等自身免疫性疾病的依据;4例患者均无反复发热、特殊用药及毒物接触史,血小板及出血、凝血时间正常,免疫球蛋白、淋巴细胞亚群分析、中性粒细胞呼吸爆发功能正常,不考虑感染、中毒、血液系统疾病及免疫缺陷病等;4例患儿无浮肿、肝脾大、心率快等心衰表现,心脏听诊无杂音,心脏彩超无异常,既往也无先天性心脏病史,可排除二尖瓣狭窄、肺动脉高压、肺栓塞等心血管疾病。
患儿无肺泡毛细血管炎以及肺动脉高压、肺栓塞等心血管疾病依据,也无血液系统相关疾病、感染、中毒、免疫缺陷等线索,按照IPH予以激素治疗效果不佳,需考虑一些少见疾病如肺动静脉瘘、支气管动脉-肺循环瘘、肺毛细血管瘤病等血管畸形所致的DAH,行选择性支气管动脉造影(selective bronchial arteriography, SBAG)检查明确有无肺血管畸形。
3 进一步检查4例患者均行支气管动脉造影术(图 1A~D),提示:1例为支气管动脉-肺动静脉瘘,1例为支气管动脉-肺动脉瘘,1例为支气管动脉与肋间动脉共干并伴有部分右支气管动脉与肺静脉沟通,1例支气管动脉与肋间动脉共干伴肺静脉瘘与轻微肺动脉瘘。
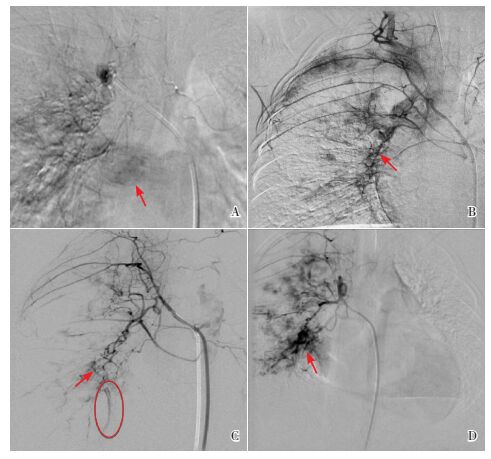
|
图 1 4例患者的支气管动脉造影 A:病例1支气管动脉-肋间动脉共干,动脉造影可见右肺静脉提前显影,回流入左心房,提示右支气管动脉-肺静脉瘘(箭头所指为回流入左心房的造影剂);B:病例2动脉造影示右支气管动脉与肺动脉分流(箭头所示),肺静脉提前显影,提示右支气管动脉-肺静脉瘘;C:病例3动脉造影示右支气管动脉与肺动脉分流(箭头所指),圈内为右肺动脉远端显影;D:病例4支气管动脉、肋间动脉共干,动脉造影示右支气管动脉与肺动脉分流(箭头所示),部分右支气管动脉与右肺静脉沟通,提示支气管动脉-肺静脉瘘。 |
患儿确诊为DAH,病因为支气管动脉-肺循环瘘(bronchial artery to pulmonary circulation shunt, BPS)。诊断依据:(1)反复咳嗽、贫血,激素治疗效果不佳;(2)肺部影像学表现为磨玻璃样或间质样改变,肺泡灌洗液呈不凝固的血性改变,免疫学指标无异常,血小板及凝血功能正常;(3)支气管动脉造影提示支气管动脉-肺循环瘘。
5 临床经过4例患者入院后行全麻下选择性支气管动脉造影术,病例1见支气管动脉与肋间动脉共干、支气管动脉-肺静脉瘘,选用弹簧圈堵闭主干。病例2造影示肺静脉瘘和少许肺动脉瘘,支气管动脉略有增粗(内径1 mm左右),多次推注500~700 μm的Embosphere微球至可达的支气管动脉主干最远端,再次造影显示右支气管动脉远端栓塞成功。病例3造影示右支气管动脉-肺动脉瘘,经微导管多次推注300~500 μm Embosphere微球至可达的支气管动脉主干最远端,再次造影显示栓塞完全。病例4造影示部分右支气管动脉与肺静脉沟通,右上及右下支气管动脉有侧枝沟通,经微导管多次、少量推注500~700 μm Esbophere微球;左支气管动脉亦分上、下两支,左上支气管动脉增粗扭曲,与远端肺泡有沟通,微导管推注500~700 μm Esbophere微球直至远端异常血管栓塞完全。术后4例患者随访半年,均未因“咳嗽、贫血”再度入院。1例患者术后3个月复查胸部CT提示双肺透亮度不均匀降低,呈毛玻璃样改变,双肺弥漫性分布斑片状、小颗粒状及网格影,胸膜下可见少许纤维条索影及透亮带,同术前大致相仿。
6 讨论DAH是一种比较少见的由多种原因导致的肺循环小血管(毛细血管、动脉、静脉)损伤,以肺泡腔内广泛出血为表现[2]。其病因复杂,血管畸形是其中一种少见病因,一项138例的儿童DAH临床研究[3]发现DAH以特发性肺含铁血黄素沉着症最多,而肺动脉高压、血管畸形等心血管疾病所致仅5例。本研究4例患儿均以咳嗽、贫血为表现,其中3例曾被诊断为IPH,激素治疗无效,通过支气管动脉造影最后诊断BPS。
BPS指支气管动脉与肺动脉或肺静脉之间的异常分流,常于成年后发病,儿童病例少见。该病病因不明确,可能是一种罕见的先天性肺部疾病,与早产及基因缺陷有关[4-5];也有文献[6]认为可能与肺部慢性炎症相关,长期慢性炎症刺激导致肺血流量增加,使原本潜在的体-肺循环通道重新开放,形成体-肺分流。BPS患者由于支气管动脉与肺血管直接相通,不产生青紫及红细胞增多症,临床表现不典型;部分患者可由于分流导致肺循环压力增高、肺泡内出血,表现为咳嗽、咯血及反复贫血。BPS的肺部影像学呈现弥漫性改变,难以与IPH鉴别。本文的4例患儿均没有青紫、红细胞增多症状,曾被诊断为IPH,最长达7年。
BPS咯血症状的发生与患者年龄及分流量密切相关,成年期患者常有不同程度咯血甚至危及生命的大咯血[7]。本研究4例BPS患者均无急性咯血表现,可能与患者发病年龄早、分流量小有关。X线及胸部CT平扫是诊断DAH的必要条件,均见不同程度的双肺弥漫性磨玻璃样或网格状实变影,亦可见局部浸润,肺出血越多,改变越重。但影像学改变缺乏特异性,也不能明确出血部位。本研究4例患儿肺部CT均呈毛玻璃样改变或间质改变。64排CT增强扫描及重建技术可获得较精准的支气管动脉影像,显示支气管动脉的起源、形态、分布及走形[8];CT血管造影(CTA)对于咯血患者可以敏感地定位出血部位(肺泡或气管),指导介入栓塞治疗,缩短手术时间,减少漏栓现象。但仍有20%~30%的患者通过CTA无法确定出血部位[9]。
值得注意的是,本研究1例BPS患者在纤维支气管镜检查中发现右中叶开口1点钟方位一扩张血管影。周希玲等[10]也报道1例14岁咯血患者在支气管镜下发现支气管粘膜下血管粗重、紊乱,后经造影确诊为右肺动脉缺如。因此,对于咯血或不明原因反复咳嗽、贫血患儿,如纤支镜检查发现粘膜下血管,可能需注意是否存在血管畸形。
SBAG对于BPS不仅能明确诊断,还能进行经导管栓塞治疗[11]。本研究4例患者1例使用弹簧圈、3例使用微球进行了栓塞堵漏,随访半年,均未因咳嗽、贫血再度入院。
7 结语BPS是一种较隐匿的导致肺泡内出血的原因,症状可不典型,而且儿童病例少见,因此对于初诊考虑IPH但激素治疗效果不佳者需警惕该病。
SBGA能发现异常交通支或异常血管,还可根据分流量大小选择栓塞剂进行栓塞治疗,对BPS的诊断及治疗具有重要作用。但栓塞治疗只能缓解症状而无法消除原发病,BPS的病因寻找是进一步研究的方向。
| [1] |
Park JA. Diffuse alveolar hemorrhage and recombinant factor Ⅶa treatment in pediatric patients[J]. Korean J Pediatr, 2016, 59(3): 105-113. DOI:10.3345/kjp.2016.59.3.105 (  0) 0) |
| [2] |
Onuk T, Ipek G, Karatas MB, et al. Diffuse alveolar hemorrhage after clopidogrel use[J]. Balkan Med J, 2016, 33(6): 719-720. DOI:10.5152/balkanmedj. (  0) 0) |
| [3] |
王维, 张慧, 田小银, 等. 138例儿童弥漫性肺泡出血临床特点及病因分析[J]. 临床儿科杂志, 2016, 34(9): 670-673. (  0) 0) |
| [4] |
Babaker M, Breault S, Beigelman C, et al. Endovascular treatment of pulmonary arteriovenous malformations in hereditary haemorrhagic telangiectasia[J]. Swiss Med Wkly, 2015, 145: w14151. (  0) 0) |
| [5] |
刘晖, 姜鹃. 儿童先天性支气管动脉-肺动脉瘘的漏诊分析[J]. 心肺血管病杂志, 2014, 33(4): 483-485. (  0) 0) |
| [6] |
李娴, 朱巧洪. 体-肺分流在大咯血患者中的发病率及病因探讨[J]. 放射学实践, 2016, 7(31): 617-620. (  0) 0) |
| [7] |
Wolf M, Schmidt U, Bieselt R. Malformation of a bronchial artery with shunt into the pulmonary vascular bed-a rare cause of massive haemoptysis[J]. Pneumonologie, 2001, 55(11): 520-526. (  0) 0) |
| [8] |
Camera L, Campanile F, Imbriaco M, et al. Idiopathic pulmonary fibrosis complicated by acute thromboembolic disease:chest X-ray, HRCT and multi-detector row CT angiographic findings[J]. J Thorac Dis, 2013, 5(1): 82-86. (  0) 0) |
| [9] |
Adachi T, Oki M, Saka H. Management considerations for the treatment of idiopathic massive hemoptysis with endobronchial occlusion combined with bronchial artery embolization[J]. Intern Med, 2016, 55(2): 173-177. DOI:10.2169/internalmedicine.55.5261 (  0) 0) |
| [10] |
周希玲, 江载芳. 42例咯血患儿病因分析[J]. 中华儿科杂志, 1998, 36(2): 114-115. (  0) 0) |
| [11] |
赵趣鸣, 刘芳. 介入栓塞技术在儿童咯血中的应用[J]. 中国循证儿科杂志, 2016, 11(6): 463-468. (  0) 0) |
 2017, Vol. 19
2017, Vol. 19


